飞蝗表皮蛋白LmKnk3-5′的抗体制备及组织定位
张睿,张学尧,赵小明,马恩波,张建珍✉
1山西大学应用生物学研究所,太原 030006;2山西大同大学生命科学学院,山西大同 037009
0 引言
【研究意义】飞蝗(Locusta migratoria)是一种重要的农业害虫,主要危害禾本科作物,给农业生产带来巨大的经济损失[1]。表皮是昆虫重要的组织结构,呈层状排列,具有保护虫体免受机械损伤等功能。几丁质是昆虫表皮的重要组成成分之一,在昆虫发育过程中,表皮不停地蜕去并再次形成,以适应不断成长的虫体形态结构。在此过程中伴随着几丁质不断地合成、降解及组装[2-4]。由于人类以及高等哺乳动物均缺乏昆虫所特有的表皮及几丁质,因此研究昆虫表皮发育相关基因功能有助于害虫防治新靶标的挖掘。【前人研究进展】几丁质的有序排列对昆虫表皮层状结构的形成至关重要。首先几丁质需要形成有序排列的网状结构,然后表皮蛋白与几丁质和醌类物质进行交联,才能形成层状表皮,上述过程需要多个表皮蛋白参与。Knickkopf(Knk)是昆虫蜕皮发育过程中的重要表皮蛋白[5],可分为Knk、Knk2和Knk3 3类[6]。在果蝇(Drosophila melanogaster)中有3类Knk,其中理论上预测果蝇DmKnk3基因Skeletor有多个转录本[7]。赤拟谷盗(Tribolium castaneum)中,TcKnk、TcKnk2均只有一个转录本,而TcKnk3的转录本却有多个,TcKnk3除包括2个编码全长蛋白的转录本TcKnk3-FL-1和TcKnk3-FL-2外,还包括3个编码缩短蛋白的转录本 TcKnk3-5′、TcKnk3-3′-1 和 TcKnk3-3′-2[6]。目前有关Knk家族蛋白功能的研究仅在果蝇、赤拟谷盗中有报道。2002年,OSTROWSKI等[8]利用果蝇突变体首次鉴定Knk,并推测其可能参与表皮几丁质排列。进一步研究发现,Knk是一个膜结合蛋白,通过糖基磷酯酰肌醇(GPI)锚定于质膜上。DmKnk参与果蝇气管、胚胎、翅盘原表皮几丁质纤维的装配[9-10]。目前果蝇中尚无Knk其他家族蛋白的功能研究。免疫组化试验证明,TcKnk在赤拟谷盗新表皮中与几丁质共定位,负责保护新表皮不被几丁质酶降解。TcKnk缺失导致赤拟谷盗表皮几丁质片层结构无法正常形成[11]。CHAUDHARI等[6]采用RNAi结合表型及透射电镜观察,发现TcKnk家族基因出现了功能分化,TcKnk影响赤拟谷盗每一次蜕皮发育过程,而TcKnk2和TcKnk3-3′只影响其预成虫期蜕皮发育。笔者课题组前期以飞蝗为试验材料,克隆获得3个LmKnk(LmKnk、LmKnk2和 LmKnk3)基因,其中 LmKnk3拥有LmKnk3-FL和LmKnk3-5′两个不同的选择性剪切子,并采用RNAi的方法对其功能进行了初步研究,证明LmKnk和LmKnk3-5′与飞蝗发育及表皮形成有关[12-13]。LmKnk主要定位于飞蝗新表皮中[13]。【本研究切入点】上述有关TcKnk和LmKnk的定位工作均是使用 DmKnk特异性抗体完成的[11,13],尚缺乏源自飞蝗Knk蛋白家族的抗体,特别是飞蝗Knk3的特异抗体。制备LmKnk3-5′抗体,有利于从蛋白层面阐明LmKnk3-5′在飞蝗表皮形成及发育中的作用。【拟解决的关键问题】经氨基酸序列比对选取LmKnk3-5′特异抗原序列,进行重组融合蛋白的表达纯化及多克隆抗体制备,检测抗体效价和特异性,明确LmKnk3-5′在飞蝗体壁组织的定位。为进一步研究 LmKnk蛋白家族在飞蝗表皮形成中的功能分化及其与其他表皮蛋白的协同作用打下基础。
1 材料与方法
试验于 2018—2019年在山西大学应用生物学研究所完成。
1.1 材料
供试昆虫:飞蝗卵购于河北沧州飞蝗养殖基地,饲养于养虫室。控制室内温度为(30±2)℃、相对湿度为(40±10)%、光照14 h∶黑暗10 h。孵化后,以新鲜小麦幼苗饲养若虫至3龄后,添加麦麸饲养。
主要试剂:pET-32a质粒;限制性内切酶BamH I和Hind III(New England Biolabs);Taq酶、T4连接酶、RNAiso Plus、Recombinant RNase Inhibitor、Reverse Transcriptase M-MLV(TaKaRa);SYBR Green(TOYOBO);胶回收试剂盒、质粒提取试剂盒(OMEGA);Goat serum(生工生物工程(上海)有限公司);IPTG(索莱宝);Bicinchoninic acid(BCA)(Sigma);IRDye 680 LT goat anti-mouse IgM(LI-COR Biotechnology,Lincoln,NE);Cy3标记驴抗小鼠IgG(Servicebio);蛋白Marker、Trans1-T1感受态细胞、BL21(DE3)感受态细胞、DAPI染液(碧云天);Ni-NTA柱(Promega)。
1.2 LmKnk3-5′特异抗原序列选择
为找到制备 LmKnk3-5′抗体的特异性抗原序列,采用 GeneDoc软件比对 LmKnk家族成员 LmKnk、LmKnk2、LmKnk3-FL和 LmKnk3-5′的氨基酸序列,找出 3段特异序列,之后运用 ExPASy在线软件(http://web.expasy.org/compute_pi/)分别预测3段特异序列分子量大小以及等电点等基本信息。
1.3 原核表达载体的构建
根据所选的特异性抗原序列 R1、R2和 R3及pET-32a原核表达载体的序列特性,分别设计引物,并在引物5′-末端添加BamH I或Hind III酶切位点,引物序列信息如表 1。以课题组前期测序验证的LmKnk3-5′全长 cDNA 序列作为模板,采用上述引物及2×Taq酶进行PCR扩增,扩增产物经胶回收后即为特异的抗原基因片段。将回收的抗原基因片段及pET-32a分别用BamH I和Hind III进行双酶切,酶切产物胶回收后,再采用T4连接酶进行连接,连接产物转化至Trans1-T1细胞,挑斑至液体培养基过夜培养,菌体PCR后凝胶电泳检测,挑选阳性克隆测序验证。
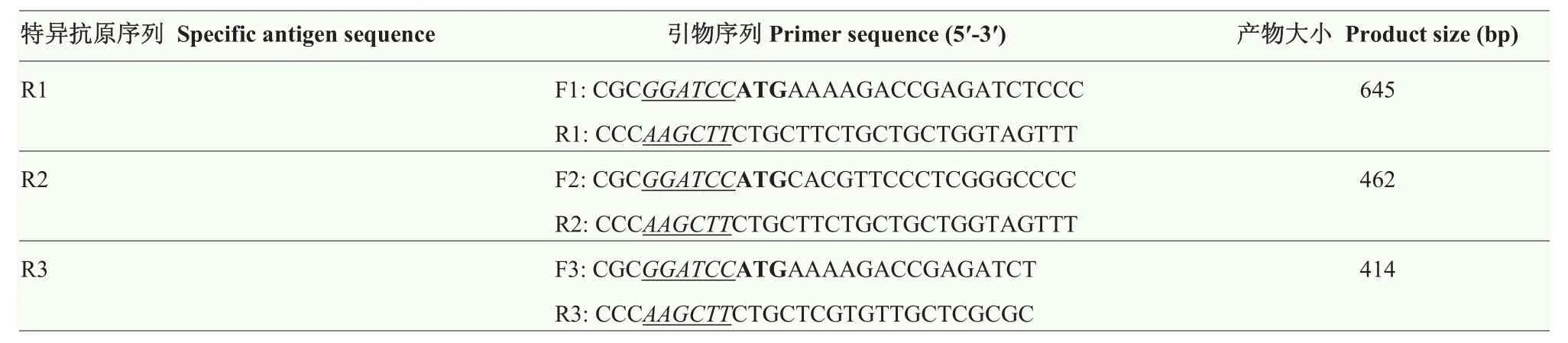
表1 LmKnk3-5′特异抗原序列扩增所需引物Table 1 Primers for specific antigen sequences of LmKnk3-5′
1.4 重组蛋白诱导表达及纯化
1.4.1 重组质粒的转化及蛋白诱导表达检测 将上述测序正确的重组质粒 pET-32a-R1、pET-32a-R2和pET-32a-R3分别转化至BL21(DE3)感受态细胞中。接种单克隆至5 mL LB培养基中(氨苄抗性),恒温摇床培养(37℃,200 r/min)约5 h,直到OD600值升至 0.6—1.0,加入 IPTG(溶液中终浓度为 0.5 mmol·L-1),16℃低温条件下过夜诱导表达约20 h。之后12 000×g离心5 min收集菌体,加入PBS缓冲液重悬菌体,反复冻融3次,再加入PMSF(蛋白酶抑制剂)进行超声破碎约15 min(工作2 s,间歇3 s,功率30%),直至溶液透亮。将上述超声破碎产物在4℃低温条件下12 000×g离心10 min,分离上清和沉淀。最后经12%的SDS-PAGE凝胶电泳检测重组蛋白表达情况。
1.4.2 重组融合蛋白的纯化 将重组蛋白以可溶形式表达的菌株接种至1 L氨苄抗性LB培养基中,按照上述优化条件摇菌,诱导菌株表达产生大量的重组蛋白。离心(4℃,8 000×g,20 min)收集菌体,加入 20 mL 上清提取试剂(20 mmol·L-1pH 8.0 Tris-HCl,5%甘油,100 mmol·L-1NaCl)使菌体悬浮,冻融3次后,加入PMSF蛋白酶抑制剂,超声破碎(工作2 s,间歇3 s,功率40%)50 min至菌液透亮,4℃,12 000×g离心 20 min得上清用于纯化。使用 Ni-NTA Agarose纯化上述上清溶液以获得目的蛋白,依次用ddH2O、8 mol·L-1尿素、ddH2O、上清提取试剂清洗和平衡Ni-柱,再将上清液缓慢上样至Ni-柱中,使目的蛋白与 Ni-柱充分结合,收集流出的液体(FB),再用上清提取液洗脱,收集流出液(BB),之后依次用咪唑梯度液(10、20、50、100、200、500和 1 000 mmol·L-1)洗脱目的蛋白,收集洗脱液。采用 12%SDS-PAGE检测各洗脱液中目的蛋白的纯化情况,并用Image J软件对扫描条带进行灰度分析,计算目的蛋白纯度。
1.5 LmKnk3-5′特异抗体制备以及效价检测
1.5.1 抗体制备 SDS-PAGE检测后,重组蛋白送至生工生物工程(上海)有限公司制备多克隆抗体。方法如下:纯化后的目的蛋白与等体积的弗氏佐剂混合,第1天选取健康的4—6周龄BALB/c小鼠5只进行初免,初免剂量为目的蛋白100 μg/只,第35天及第42天,弗氏不完全佐剂与目的蛋白混合进行两次加强免疫,免疫量每次均为 50 μg/只,第 49天,尾部采血10 μL,ELISA检测抗血清效价。第56天,弗氏不完全佐剂+蛋白抗原混合后再次进行免疫,剂量仍为 50 μg/只,第 63天,眼球摘除采血,离心,收血清即为多克隆抗体。
1.5.2 抗体效价检测 采用ELISA方法检测抗血清效价是否达到要求。将重组蛋白抗原用pH 9.6,0.05 mol·L-1Na2CO3-NaHCO3缓冲液稀释至终浓度为 2 μg·mL-1,阳性血清从1 000倍开始用PBS缓冲液梯度稀释,空白对照为PBS,阴性对照为1 000倍PBS稀释的阴性血清,二抗为HRP-山羊抗小鼠(1∶8 000),加入底物溶液(TMB)反应 15 min后再加 100 μL H2SO4(2 mol·L-1)终止反应;450 nm 波长下测吸光值。阴性血清与阳性血清OD值分别记为N和P,P/N≥2.1为阳性[14-15]。
1.6 LmKnk3-5′抗体特异性检测
1.6.1 dsLmKnk3-5′的合成及注射 参照课题组已有的方法完成 dsLmKnk3-5′和 dsGFP(对照)的合成及注射[12,16-17]。选取飞蝗5龄第1天若虫进行dsRNA注射,20 μg/头。
1.6.2 dsLmKnk3-5′注射后飞蝗体壁 LmKnk3-5′相对表达量 于飞蝗5龄第8天分别选取dsLmKnk3-5′和dsGFP组若虫。解剖取飞蝗腹部第2—3腹节体壁,共设3个生物学重复,3头试虫/重复。参照刘晓健等[18]的方法提取总RNA,反转录为cDNA,RT-qPCR检测注射 dsLmKnk3-5′后,LmKnk3-5′在飞蝗体壁中的mRNA相对表达量,β-actin为内参[19-20]。
1.6.3 Western blot检测抗体特异性 于飞蝗5龄第 8天选取 dsLmKnk3-5′组蜕皮困难致死表型的个体和dsGFP组正在蜕皮的个体。共设3个生物学重复,3头试虫/重复。根据于荣荣等[21]的方法抽提蛋白,即解剖取飞蝗腹部体壁,液氮中研磨后,置于离心管(1.5 mL)中,加入 500 μL 蛋白裂解液及 5 μL 100 mmol·L-1PMSF,超声破碎后,冰上放置30 min,之后4℃ 12 000×g离心20 min,转移上清至新的离心管中,BCA法测定其蛋白浓度。
上述蛋白样品(含 1 000 μg蛋白)经 12%的SDS-PAGE凝胶电泳分离;然后将其湿转到硝酸纤维素膜上[22];再用TBST缓冲液(5% BSA,20 mmol·L-1pH 7.4 的 Tris-HCl, 150 mmol·L-1NaCl, 0.05%Tween-20)25℃封闭2 h;接着分别与 LmKnk3-5′多抗及β-actin单抗在4℃条件下孵育约12 h,用TBST洗膜3次,10 min/次;于37℃条件下将膜与IRDye 680 LT goat anti-mouse IgM(1∶5 000稀释)孵育2 h后,再用TBST洗膜3次,10 min/次,采用双色红外激光成像系统(Odyssey clx)对硝酸纤维素膜进行扫描。采用Image J软件对扫描条带进行灰度分析。
1.7 免疫组化检测LmKnk3-5′在飞蝗腹部体壁中的定位
为明确LmKnk3-5′在飞蝗体壁中的位置,取飞蝗5龄第1天若虫,分别注射dsLmKnk3-5′和dsGFP,于5龄第8天选取dsLmKnk3-5′组蜕皮困难致死表型的个体和dsGFP组正在蜕皮的个体。解剖取飞蝗腹部第三腹节体壁,制备5 μm厚石蜡切片[23],切片经二甲苯、梯度酒精脱蜡处理后,浸入37℃ 3%双氧水中10 min,然后浸泡在EDTA抗原修复缓冲液(pH 8.0)中,微波炉加热至沸腾后室温自然冷却,再用PBS(pH 7.4,含0.025% Triton X-100)洗3次,每次5 min。用10%羊血清室温封闭 2 h,滴加 1∶1 000稀释的自制LmKnk3-5′抗体,4℃过夜孵育。PBS洗涤后滴加1 000倍稀释的Cy3标记驴抗小鼠IgG,避光孵育(37℃,2 h),PBS洗3次,方法同上。使用1 000倍稀释的DAPI染液,黑暗孵育(37℃,10 min),PBS清洗,方法同上。最后滴加抗荧光淬灭剂封片后,在正置荧光显微镜下观察结果。
2 结果
2.1 LmKnk3-5′抗原序列的选择
采用 GeneDoc软件将 LmKnk、LmKnk2、LmKnk3-FL和 LmKnk3-5′的氨基酸序列进行比对,GenBank登录号分别为 KR537807、MT080984、MT080985和MT080986。结果如图1所示。图中蓝色实线框、橘色实线及绿色实线分别为选取的LmKnk3-5′的3段抗原序列区R1、R2和R3,三者所含的氨基酸残基数分别为208、147和131。ExPASy等电点及分子量在线预测软件分析结果表明,三者的理论分子量分别为24.0、17.0和14.8 kD,理论等电点分别为9.29、9.75和6.31。

图1 GeneDoc比对获得LmKnk3-5′特异性抗原序列Fig.1 LmKnk3-5′ specific antigen sequences obtained from GeneDoc alignment
2.2 重组质粒的构建及蛋白诱导表达
重组质粒pET-32a-R1、pET-32a-R2和pET-32a-R3构建成功,转化至表达菌中诱导表达后,采用SDS-PAGE法检测,结果如图2所示,IPTG诱导后pET-32a-R1、pET-32a-R3重组融合蛋白(即LmKnk3-5′的R1、R3的抗原肽段)在菌体裂解液的上清及沉淀中均未表达,只有 pET-32a-R2重组融合蛋白(即LmKnk3-5′的R2的抗原肽段)在菌体裂解液的上清中大量表达(红色箭头所示),且产物分子量大小接近预测的pET-32a-R2蛋白分子量,约33 kD。

图2 SDS-PAGE检测3个重组质粒在BL21(DE3)中的表达Fig.2 Expression of three recombinant plasmids in BL21(DE3) detected by SDS-PAGE
2.3 重组蛋白纯化
含重组质粒pET-32a-R2的菌株经扩大培养、诱导表达、亲和纯化后,SDS-PAGE法对收集到的各种洗脱液进行检测,结果如图3所示,重组目的蛋白在200 mmol·L-1咪唑洗脱液中被大量洗脱下来,将扫描结果图导入 Image J软件,对扫描条带进行灰度分析。得到目标蛋白纯度大于85%,蛋白纯度较高,洗脱蛋白总量达21 mg,可进一步用于抗体制备。
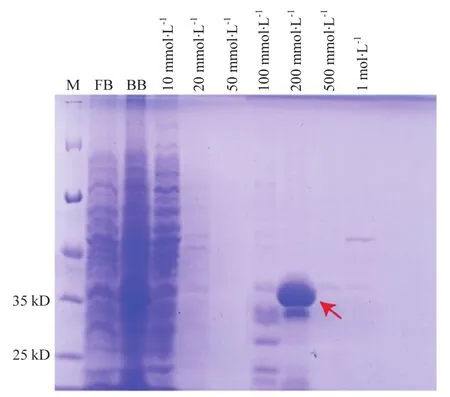
图3 pET-32a-R2纯化后的SDS-PAGE检测Fig.3 SDS-PAGE detection after pET-32a-R2 purification
2.4 抗体效价及特异性检测
将上述200 mmol·L-1咪唑洗脱液送上海生工生物工程有限公司制备 anti-LmKnk3-5′多克隆抗体后,用ELISA法检测其效价,如表2,抗体稀释倍数达512 000时,P/N值仍为阳性,效价高达 1∶512 000,说明anti-LmKnk3-5′多克隆抗体效果较好,可用于Western blot试验。
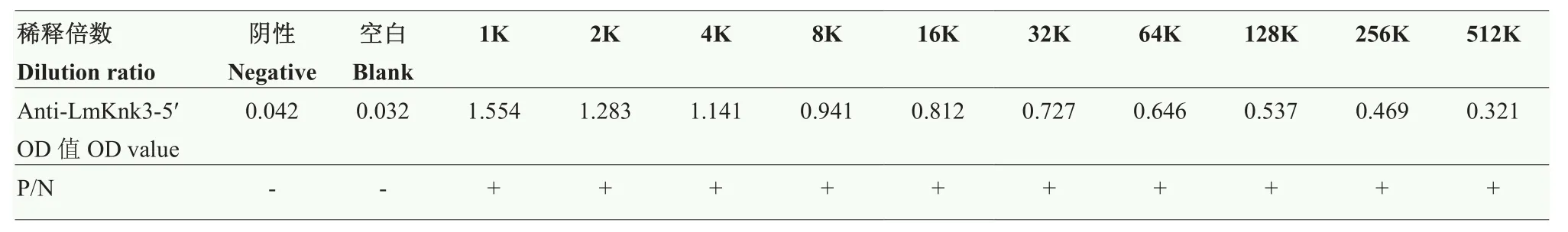
表2 LmKnk3-5′多克隆抗体效价测定Table 2 Titer determination of LmKnk3-5′ polyclonal antibody
使用RNAi结合RT-qPCR及Western blot的方法对抗体特异性进行检测,结果如图4,dsLmKnk3-5′注射后,飞蝗体壁LmKnk3-5′的mRNA相对表达量与对照组相比显著降低(图4-A)。Western blot结果表明,飞蝗体壁β-actin蛋白在dsGFP组与dsLmKnk3-5′组中表达量基本相同,而飞蝗体壁LmKnk3-5′蛋白在dsGFP组中条带明显,在dsLmKnk3-5′组中条带明显减弱(图4-B),将Western blot扫描结果图导入Image J软件,对扫描条带进行灰度分析(图4-C),结果表明dsLmKnk3-5′注射后,飞蝗LmKnk3-5′在蛋白水平的表达显著降低,即anti-LmKnk3-5′多克隆抗体可以识别LmKnk3-5′,特异性良好。

图4 Anti-LmKnk3-5′多克隆抗体特异性检测Fig.4 The detection of anti-LmKnk3-5′ polyclonal antibody specificity
2.5 LmKnk3-5′在飞蝗腹部体壁中的定位
利用免疫组化方法分析LmKnk3-5′在飞蝗腹部体壁中的定位,结果如图5,LmKnk3-5′在飞蝗腹部体壁皮细胞及新表皮中均有分布,在新合成的外表皮顶端信号更强。dsLmKnk3-5′处理后,LmKnk3-5′在飞蝗腹部体壁皮细胞及新表皮中的表达显著下降。
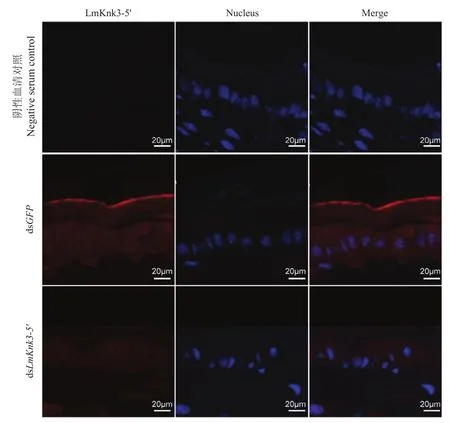
图5 LmKnk3-5′在飞蝗腹部体壁中的定位Fig.5 Localization of LmKnk3-5′ in the integument of abdomen in L.migratoria
3 讨论
3.1 表皮蛋白LmKnk3-5′抗体制备的意义
昆虫表皮由皮细胞分泌,沉积在皮细胞膜表面,呈层状排列,具有弹性。几丁质是昆虫表皮组成成分之一,其有序排列是昆虫表皮层状结构形成的基础。昆虫表皮几丁质有序排列通常是多个基因协同作用的结果[24]。在果蝇胚胎期气管形成中发现Knk和Rtv形成膜复合体参与几丁质的排布[9],对赤拟谷盗的研究发现Rtv特异性转运Knk到原表皮[25],Knk与几丁质酶在新表皮中共定位,保护新表皮几丁质不被降解[11]。在果蝇气管形成中已报道Obst-A与Serp和Knk形成复合体决定几丁质的排列[26]。因此,在通过基因功能解析鉴定了表皮几丁质排列的关键基因后,进一步阐明这些关键基因在表皮发育中的协同作用关系,对于揭示表皮几丁质组装的分子机制具有重要的意义,而这种互作关系的研究亟需制备相关蛋白抗体。
笔者课题组以世界重要农业害虫飞蝗为研究对象,从飞蝗整虫及前胸腺等转录组数据库[27-28]获得并验证了多个参与飞蝗表皮几丁质层状结构形成的关键基因,利用 RNAi方法对其功能进行了研究,结果表明这些基因表达降低会导致飞蝗表皮发育障碍最终引起飞蝗死亡[12,29-30]。氨基酸序列分析发现飞蝗 Knickkopf(Knk)家族成员 LmKnk、LmKnk2和LmKnk3(包括LmKnk3-FL及LmKnk3-5′两种剪切体)均具有信号肽,都属于分泌型蛋白。进而采用RNAi技术沉默上述基因,结果表明只有沉默 LmKnk、LmKnk3-5′可影响飞蝗正常生长发育及表皮形成,因此推测飞蝗Knk家族基因存在功能分化[12-13]。为进一步从蛋白水平研究飞蝗Knk家族的功能分化,深入探究该家族蛋白与其他表皮蛋白在飞蝗表皮发育过程中的协同作用,亟需制备Knk家族蛋白的抗体。目前,仅有果蝇DmKnk完成抗体制备[9,11],尚未报道其他昆虫Knk家族蛋白的抗体。
3.2 LmKnk3-5′抗体制备条件优化
由于抗体制备本身存在一定的难度及风险,为增加可以获得特异性较高的鼠抗的概率,经过序列比对,本文同时设计了 3段 LmKnk3-5′的特异性抗原区段R1、R2和R3,以期获得可在菌体裂解液的上清液表达的重组融合蛋白,结果证明,只有 R2获得了可在菌体裂解液的上清表达的重组融合蛋白,分析 R1和R3的失败可能与抗原肽段的选择、诱导表达温度、IPTG浓度、诱导表达时间及原核表达载体种类等多种因素有关。本研究为获得可在菌体裂解液的上清表达的 LmKnk3-5′抗原蛋白,选择较低浓度的 IPTG(0.5 mmol·L-1)、较低温度(16℃)条件下进行诱导。而低浓度IPTG、低温、较短时间利于诱导可溶性蛋白的表达[31-32]。成功制备鼠源 anti-LmKnk3-5′多抗后,ELISA法检测抗体效价,高达 1∶512 000,说明anti-LmKnk3-5′多抗效果良好。进而通过 RNAi结合RT-qPCR及Western blot证明anti-LmKnk3-5′多抗特异性较好。
3.3 LmKnk3-5′在飞蝗腹部体壁的组织定位
课题组前期围绕飞蝗Knk基因家族分子特性和生物学功能方面的研究结果表明,LmKnk3-5′在蜕皮前表达较高,且在飞蝗体壁组织中表达最高,参与飞蝗表皮发育[12]。因而本文最后利用 anti-LmKnk3-5′多抗,采用免疫组化试验对LmKnk3-5′进行腹部体壁组织定位,发现飞蝗5龄若虫蜕皮前LmKnk3-5′主要定位于新合成的外表皮顶端,这与 LmKnk的表皮分布模式明显不同,LmKnk在飞蝗新表皮各部位均匀分布[13]。上述结果从蛋白水平为 LmKnk和 LmKnk3-5′的功能分化研究提供了新证据。
4 结论
成功制备了飞蝗 LmKnk3-5′的特异性抗体,可用于Western blot和免疫组化试验分析。LmKnk3-5′在飞蝗腹部体壁皮细胞及新表皮中均有表达,在新合成的外表皮顶端信号更强。注射 dsLmKnk3-5′可抑制LmKnk3-5′蛋白表达,减少飞蝗腹部体壁皮细胞和新表皮中LmKnk3-5′的蛋白含量。

