3种粳稻籽粒水分解吸过程中的裂纹变化
邵小龙,徐文,王潇,杨晓静,沈飞,刘琴
南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,南京 210023
0 引言
【研究意义】稻谷是中国乃至亚洲生产、储备、加工和消费的主要粮种之一。在生长、运输、加工和仓储等过程中,稻谷籽粒内部、内部与外界之间在不断地进行湿热交换,导致稻谷水分吸附解吸行为循环发生[1]。水分的吸附解吸是促使稻谷裂纹变化的关键因素,而稻谷裂纹被认为是导致碎米产生的最主要因素[2-5]。据调查,碎米市场价格不到整米的一半[3]。因此,研究水分吸附解吸对稻谷裂纹的影响规律,能为降低碎米率、减少粮食损失提供重要参考依据。【前人研究进展】稻谷裂纹产生的机理有多种说法,主要有应力理论、“楔压力”理论、水合作用力和玻璃化转变理论等[6]。前 3种理论都认为稻谷吸湿过程受力的作用导致裂纹产生,第4种理论认为是干燥过程中温度变化所引起。由于稻谷及其裂纹尺寸微小、受力和温度量化研究受限,稻谷裂纹产生理论学说尚不完善。稻谷籽粒裂纹与自身水分变化密切相关,吸附水分会导致籽粒膨胀变形、内部出现裂缝[7-8];低场核磁共振(LF-NMR)是一项研究稻谷籽粒水分状态及迁移的有效手段,常被用于水稻籽粒灌浆、稻谷干燥及水分吸附解吸等过程中的水分状态及其变化[9-13]。干燥稻谷的初始含水量、水分变化幅度及干燥速率也会影响籽粒裂纹率[14-18]。HOGAN等[19]首次使用X射线成像手段对未脱壳稻谷进行裂纹检测研究,并证实图像上的黑线为稻谷裂纹。该技术随后被用于研究稻谷裂纹率及裂纹与其他品质之间的联系[20-21]。扫描电镜被用于分析稻谷籽粒裂纹断裂面微观结构[2]。【本研究切入点】以往研究集中关注干燥过程中稻谷裂纹率与水分含量之间的关系[17-18],既没有对稻谷裂纹进行分类,又没有对裂纹粒的水分分布进行分析,因此缺乏裂纹变化与不同状态水分间联系的深入研究。【拟解决的关键问题】由于稻谷在田间生长过程中经历过多次以解吸为主的水分解吸吸附循环后,部分裂纹已经产生。因此,本研究着重于探究收割后粳稻籽粒裂纹发展变化过程,而非裂纹产生过程。本试验使用X射线、电子扫描成像和LF-NMR技术测定并比较粳稻籽粒水分解吸过程中水分分布及内部裂纹的变化,深入分析籽粒水分解吸对裂纹变化的影响。
1 材料与方法
1.1 试验材料
本试验采用品种名为‘软玉’‘淮稻5号’和‘南粳5055’3种粳稻。其中‘淮稻5号’为稳产高产品种,‘南粳5055’为稳产较低产量品种,两者在长江中下游地区种植面积广。‘软玉’为近年培育新品种,处于试种阶段,产量暂不稳定,种植面积小,但具有口感软糯的食味特性。‘淮稻5号’通常作为普通大米产品的主要加工原料,而‘南粳5055’和‘软玉’为优质大米产品的主要加工原料。本次选用的3种粳稻是长江中下游地区在种植供给和需求消费上具有一定代表性的品种。试验材料均为常州常金米业种植基地2020年种植生产。该基地位于江苏省常州市新北区孟河镇万绥村,亚热带季风气候。在当年10月中旬,稻谷颖壳90%以上变黄,籽粒坚硬。随机在田块多点用剪刀将带穗稻谷手工取下并收集,当天运送至粮食储运国家工程实验室(稻谷平台)于防潮垫上摊平自然通风。经手工脱粒,去除杂质及霉粒后,用去离子水进行分段加湿,3个品种稻谷的初始湿基含水率分别为20.10%、15.21%和 17.36%。每段加湿结束后置于 4℃人工气候箱中,其间取出摇晃,使水分被均匀吸收,将粳稻调至25.00%目标水分后冷藏备用。
1.2 主要仪器与设备
TP-214型分析天平,丹佛仪器(北京)有限公司;PQX-1000A型分段可编程人工气候箱,宁波东南仪器有限公司;101-34S型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;FW100型高速万能磨粉机,波通瑞华科学仪器有限公司;NMI-20 Analyst型核磁共振分析仪,上海纽迈电子科技有限公司;ZXFLASEE U型微焦点 X光检测仪,丹东市中讯科技有限公司;TM-3000型扫描电子显微镜,日本日立公司。
1.3 试验方法
1.3.1 样品准备 采用电热鼓风干燥箱热风恒温干燥处理样品。干燥温度为60℃,预热时间为20 min。干燥期间将每个品种样品进行24等分划分,每份样品20 g。预热结束后,取其中21份样品,将单份样品平铺于单个托盘中,置于干燥箱中进行薄层干燥。每隔10 min取出3份样品,分别倒入干燥至恒重的称量皿中后称重并记录。计算样品的水分含量,直至3份样品平均水分含量约为22.00%,混合并密封于自封袋中自然冷却24 h后进行后续试验。采用相同处理方法得到目标水分约为20%、18%、15%、12%、10%和8%的样品。
1.3.2 水分含量测定 参考 GB 5009.3—2016中的方法测定籽粒初始水分含量。
1.3.3 裂纹测定 采用 X射线成像设备对粳稻裂纹进行测定。该设备由采集系统和成像系统组成,其中采集系统包括光源、可移动载物台和信号接收板,软件系统为ZXVISPRO V2.0。参考ODEK等[21]的方法,随机抽取300粒外观完整的籽粒样品,使用X射线成像系统进行裂纹率的测定。其中,X射线仪的参数设置为:电压30 kV,电流100 μA,窗宽10712,窗高9919,亮度 5,对比度 5。参考郑华东等[22]的方法,根据X射线图像中籽粒裂纹程度划分为4种:完整粒、轻度裂纹粒、中度裂纹粒和重度裂纹粒,如图1所示。图中无裂纹的籽粒为完整粒(intact kernel,IK)(图1-A),单裂纹的籽粒为轻度裂纹粒(slightly fissure kernel,SL-FK)(图1-B),含双裂纹的籽粒为中度裂纹粒(moderately fissure kernel,MO-FK)(图 1-C),含3条及以上裂纹及龟裂纹(即同时出现横向裂纹和纵向裂纹)的籽粒为重度裂纹粒(severe fissure kernel,SE-FK)(图 1-D)。统计抽样样品中轻度、中度和重度裂纹籽粒的比例,分别记为 SL-PFK、MO-PFK和SE-PFK。

图1 4种裂纹类型的稻谷籽粒X射线成像图Fig.1 Four types of fissure in paddy rice kernels by X-ray images
1.3.4 稻谷裂纹处的微观结构成像 采用扫描电镜对粳稻籽粒裂纹断裂面进行细胞和淀粉粒结构的成像观察。选择检测有裂纹的籽粒,手工剥壳并沿裂纹方向轻轻折断后,放入离子溅射仪喷金室对断裂面进行喷金,溅射电流为1.5 A,加速电压为15 kV,时间 90 s。
1.3.5 水分分布和状态的测定 采用核磁共振分析仪测定粳稻籽粒水分分布和状态。试验前,先用核磁共振波谱分析软件中的FID(free induction decay)脉冲序列校准中心频率;然后称取(1.00±0.01)g带壳的籽粒置于直径 15 mm 的核磁管中,采用 CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的横向弛豫参数,每组5个平行,取平均值。脉冲序列参数设置为:主频 SF1=19 MHz,采样频率 SW=200 kHz,90°硬脉冲射频脉宽P1=13 μs,180°硬脉冲射频脉宽P2=25 μs,信号采样点数 TD=300 150,重复采样等待时间TW=1 500 ms,重复采样次数NS=32,回波个数NECH=7 500。测定结束后将水分含量与单位质量籽粒信号强度进行线性拟合。使用CONTIN算法对核磁数据进行反演得到横向弛豫时间和峰面积。由于稻谷中的脂肪含量极低,仅2%—3%,信号非常弱,此处未作探讨[11]。
1.4 数据分析
用微软Office 2019进行数据整理和图形绘制。使用 SPSS 24.0进行单因素方差分析(One-way ANOVA)和 Pearson相关性检验,均值采用最小显著性差异法(LSD)和邓肯分析(Duncan)进行多重比较(P<0.05)。
2 结果
2.1 粳稻水分解吸过程中的裂纹分析
由图2可知,水分解吸导致3种粳稻的裂纹率总体呈现上升的趋势。‘软玉’(图2-A)裂纹率从14.67%上升至 89.67%,水分含量在 14.96%—25.16%的籽粒裂纹率较少且变化不明显,裂纹率仅增加了 9.66%,水分含量在11.94%—14.96%的籽粒裂纹率差异巨大,总增加量为 55.67%。由于 11.49%的‘软玉’籽粒裂纹率已高达80.00%,因此当水分含量低于11.94%后,籽粒的裂纹率变化明显减小。‘淮稻5号’(图2-B)的裂纹率变化情况与‘软玉’不同,高水 分的籽粒裂纹差异十分明显,在水分含量为19.78%时,其裂纹率就已高达 41.67%;而水分含量在 15.21%— 19.78%的籽粒裂纹率基本没有变化,且稳定在45.00%以下;水分含量低于 15.21%后,裂纹率大量增加至80.00%后趋于稳定。高水分的‘南粳5055’(图2-C)籽粒裂纹率维持在 25.00%以下,当水分含量低于17.84%后,裂纹率随水分的解吸而明显增加。表明不同品种粳稻籽粒水分解吸过程中裂纹率的变化存在差异。
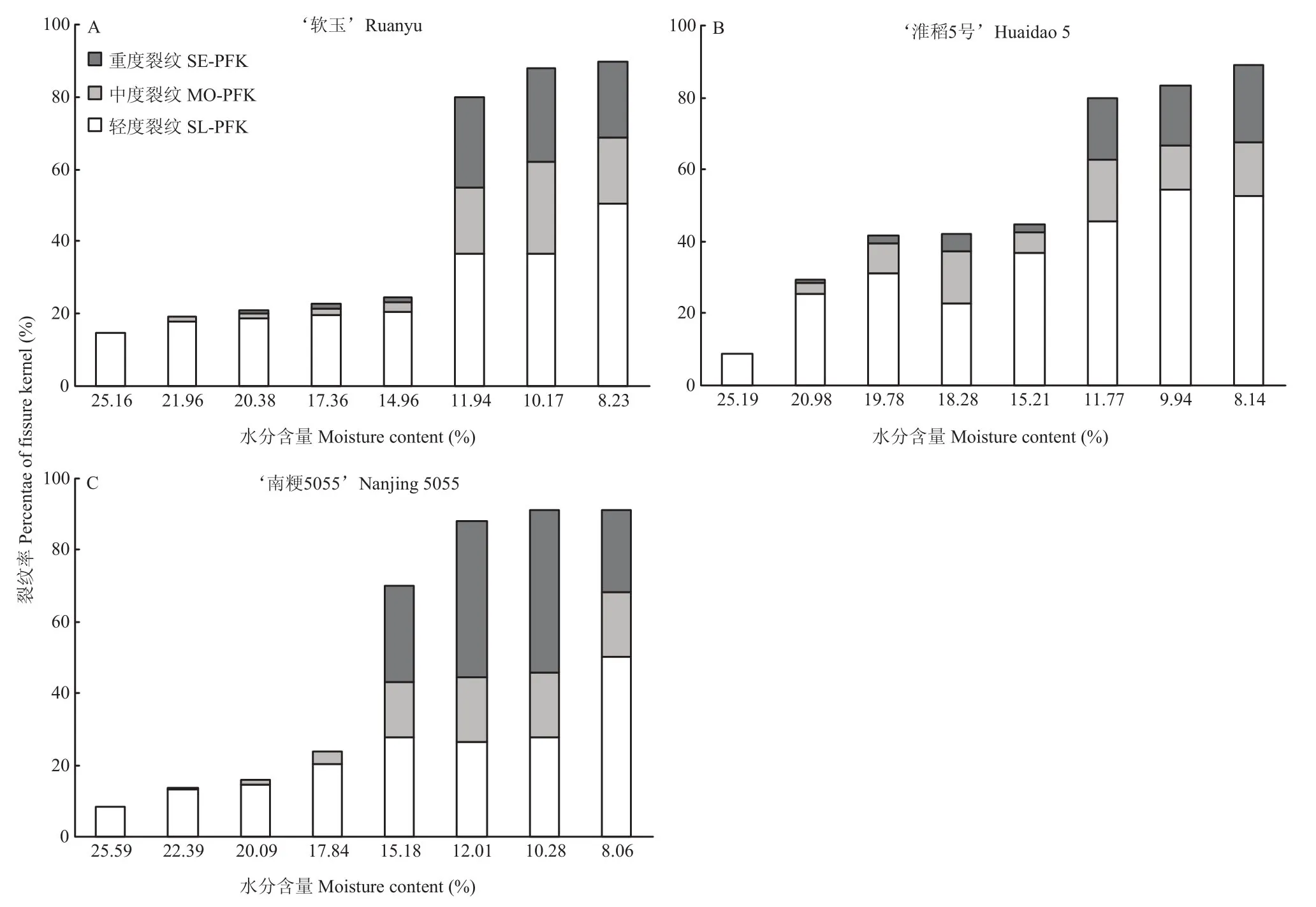
图2 粳稻籽粒水分解吸过程中裂纹变化Fig.2 Changes of fissure in paddy rice kernels during moisture desorption
由图2样品裂纹程度可知,低水分粳稻籽粒不仅裂纹率高于高水分的籽粒,其中度、重度裂纹比例也比高水分籽粒要高。高水分裂纹粒几乎不含重度裂纹粒,且中度裂纹粒的比例也极少。中度裂纹率和重度裂纹率随着水分解吸开始明显增加,特别是当籽粒的总裂纹率大于40.00%后,中度裂纹粒和重度裂纹粒的占比明显增加。‘软玉’‘淮稻5号’和‘南粳5055’籽粒的轻度裂纹粒比例分别从14.67%、8.67%和8.33%上升至50.67%、52.67%和50.33%。‘软玉’‘淮稻5号’和‘南粳5055’籽粒的中度裂纹粒比例从0.00%分别上升至18.00%、14.67%和18.00%。‘淮稻5号’重度裂纹粒比例一直增加,从0.00%上升至21.67%;而‘软玉’和‘南粳5055’重度裂纹粒比例在水分含量为10.00%左右时达到最大值,随后有所下降。‘软玉’和‘南粳5055’在含水率为8%左右时,其中度裂纹率和重度裂纹率下降而轻度裂纹率上升。这可能是由于单次X射线成像仅得到某一角度的二维成像,部分裂纹的轻重程度无法被正确划分所造成。如果调整籽粒放置,进行多次成像并观察,则可以降低这种随机误差。
2.2 粳稻籽粒裂纹断裂面的微观结构分析
由于3种粳稻水分解吸过程中的裂纹变化规律较为一致,因此选择其中一个品种进行微观结构研究。图3为放大60倍的‘南粳5055’裂纹处细胞结构的扫描电镜图像。由图可知,在水分解吸过程中,细胞间界面和细胞断裂面差异明显。在裂纹断裂面存在两个典型的区域:一个是较为“粗糙”的淀粉间断裂面,另一个则是较为“平滑”的细胞间断面。随着水分含量的降低,淀粉间断裂面的比例减小,细胞间断裂面的比例增加。因此,呈现出裂纹处断裂面变光滑的趋势,且由淀粉间断裂面主导变为细胞间断裂面主导,此结果和ZHANG等[2]报道结果十分相似。图4为放大2 000倍的‘南粳5055’籽粒裂纹断裂面淀粉粒结构的扫描电镜图像,不同水分含量的粳稻籽粒裂纹在淀粉粒层次上差异明显。籽粒的横断面微观结构主要由单粒淀粉粒、复合淀粉粒、脂肪滴和蛋白膜等结构组成。籽粒在水分解吸过程中裂纹断裂面的单粒淀粉粒数量增加,复合淀粉粒内部出现间隙,这些间隙逐渐增加,并最终导致复合淀粉粒崩解成单粒淀粉粒。
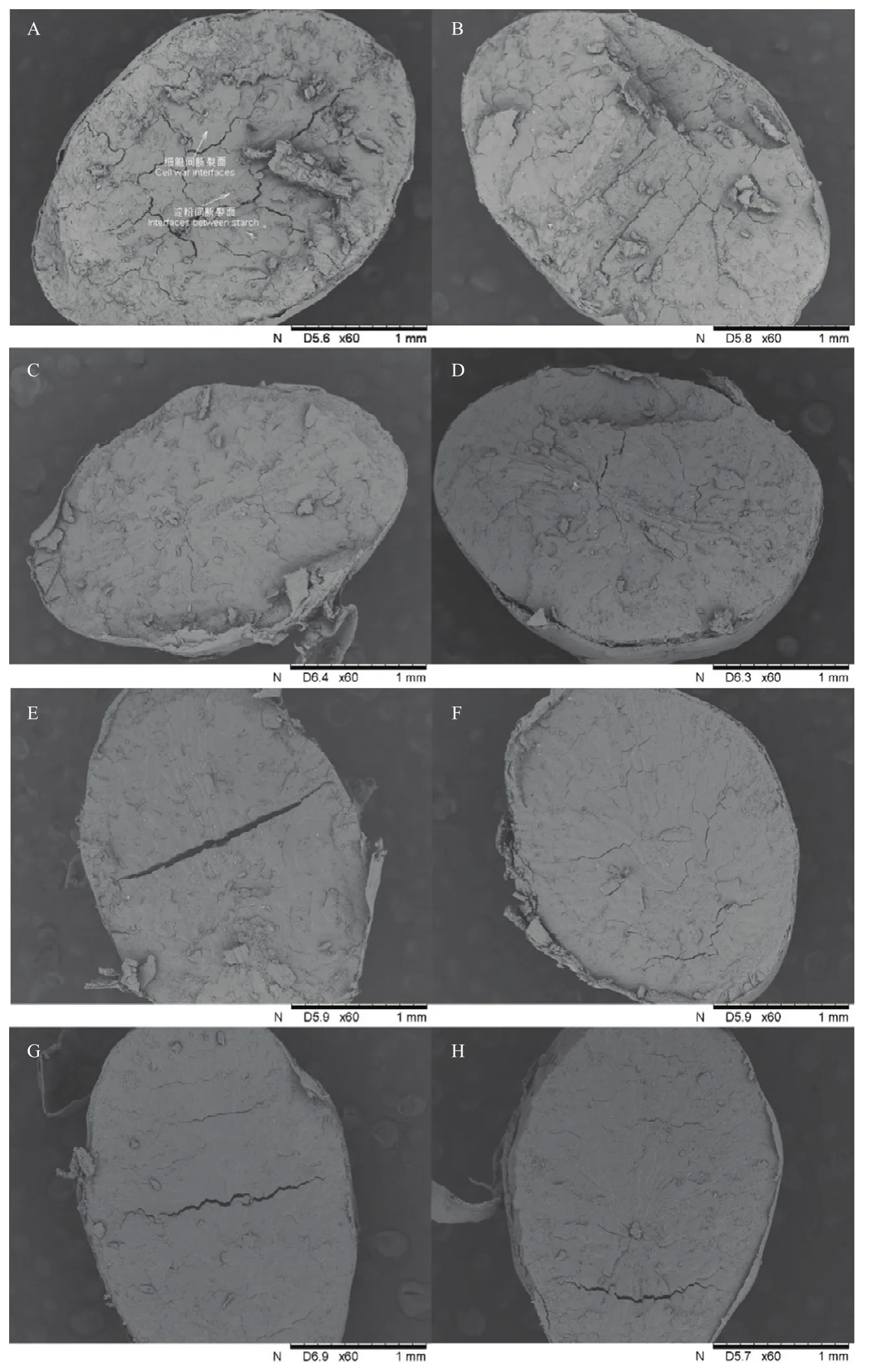
图3 ‘南粳5055’籽粒水分解吸过程中裂纹处细胞层次微观结构Fig.3 Microstructure of fissure in Nanjing 5055 during moisture desorption at the cell level
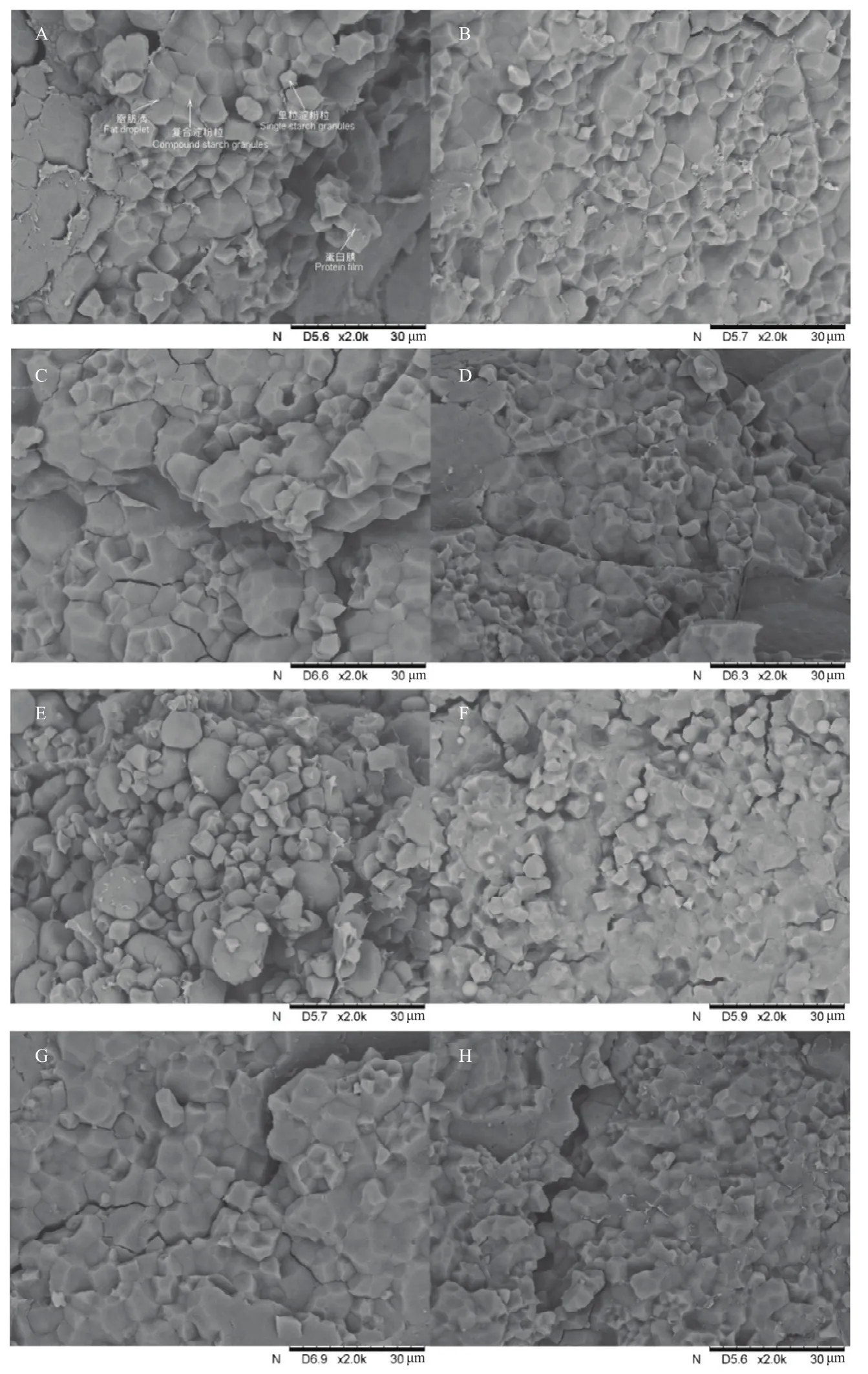
图4 ‘南粳5055’籽粒水分解吸过程中裂纹处淀粉粒层次微观结构Fig.4 Microstructure of fissure in Nanjing 5055 during moisture desorption at the starch granule level
2.3 粳稻籽粒的低场核磁测试分析
将‘软玉’‘淮稻5号’和‘南粳5055’单位质量样品的初始横向弛豫强度分别与水分含量进行线性拟合,决定系数(R2)分别为0.994、0.995和0.995。表明3品种粳稻籽粒初始横向弛豫强度和水分含量之间都存在极显著(P<0.01)的线性关系。图5为所有样品的初始横向弛豫强度与水分含量的线性拟合 R2为0.992。尽管与单一样品线性模型的决定系数相比有所减小,但R2仍大于0.990。因此,可通过初始横向弛豫信号强度来准确地预测不同品种粳稻籽粒中的含水率。另外,3种粳稻水分分布特征一致,在水分解吸过程中没有发生改变。

图5 单位质量粳稻籽粒的初始横向弛豫强度与水分含量线性拟合Fig.5 Weighed initial transverse relaxation strength for paddy rice kernels as a function of moisture content
稻谷籽粒本身是一种非均相体系,LF-NMR技术可以利用氢质子在磁场中的自旋-弛豫特性,分析食品中的水分分布特征及状态的改变[23-25]。通过反演样品的LF-NMR横向弛豫信号,得到粳稻籽粒的弛豫强度分布图(图6)。反演图谱都有2个峰,分别代表2种流动性不同的水分,弛豫时间较短的T21峰(0.1—20 ms)表征籽粒内部被淀粉、蛋白质等大分子包围或与其极性基团作用紧密的“结合水”;弛豫时间较长的T22峰(24—350 ms)表征籽粒的液泡、原生质和细胞间隙中流动性最强的“自由水”。当水与其他成分结合紧密或处于较小缝隙时,氢质子自由度低,弛豫时间T2便会缩短,因此,弛豫时间为T21的水组分自由度小于弛豫时间为T22的水组分。
粳稻籽粒水分含量的降低导致横向弛豫时间 T21和T22缩短,A21峰斜度增大,A22峰斜度减小(图6)。其中,‘软玉’籽粒的横向弛豫时间T21平均由2.42 ms缩短至0.74 ms,横向弛豫时间T22平均由138.49 ms缩短至 96.68 ms(表1);‘淮稻 5号’籽粒的 T21平均由 2.31 ms缩短至 0.66 ms,T22平均由 135.45 ms缩短至 103.08 ms;‘南粳 5055’籽粒的 T21平均由2.36 ms缩短至 0.74 ms,T22平均由 132.41 ms缩短至97.97 ms。由此可知,随着籽粒水分解吸,含水量降低,籽粒中各状态水分整体向左迁移,表明水分解吸使得籽粒内氢质子自由度降低,水分子的流动性显著减弱(P<0.05)。

图6 单位质量粳稻籽粒水分解吸过程中低场核磁信号强度与横向弛豫时间T2反演图谱Fig.6 The inversion spectrum of normalization LF-NMR signal intensity for one gram of paddy rice kernels during moisture desorption and transverse relaxation time T2
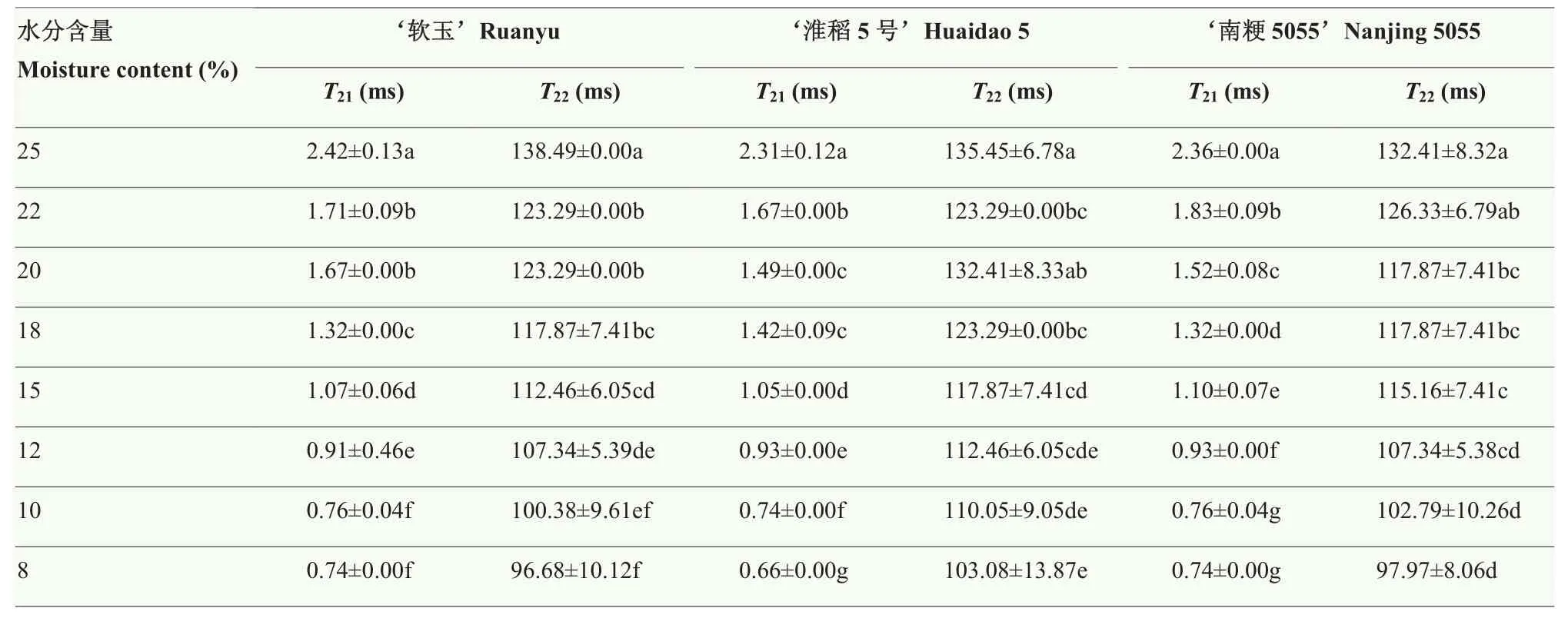
表1 粳稻籽粒水分解吸过程中的横向弛豫时间T2Table 1 Transverse relaxation time T2 for paddy rice kernels during moisture desorption
水分解吸导致籽粒表征“结合水”含量的 A21峰面积显著减小(P<0.05)。其中,‘软玉’的 P21峰比例平均由94.81%降低至77.72%;‘淮稻5号’的P21峰比例平均由95.38%降低至77.31%;‘南粳5055’的P21峰比例平均由94.01%降低至77.08%。而表征“自由水”的A22峰面积呈现先减小后增大的趋势, 但由于高水分粳稻的 A22峰面积变化差异不显著(P>0.05),因此,P22峰比例依然随着水分的解吸而上升。其中,‘软玉’的P22峰比例平均由5.19%上升至22.26%;‘淮稻5号’的P22峰比例平均由4.62%上升至22.22%;‘南粳5055’的P22峰比例平均由5.99%上升至22.91%。因为稻谷籽粒中的弛豫时间较长的“自由水”流动性大于弛豫时间较短的“结合水”,所以部分“自由水”在水分解吸过程中挥发离开籽粒,同时部分“结合水”转化为“自由水”。总体表现为“结合水”面积和相对面积比例随水分解吸过程逐渐减小,而“自由水”的面积有增有减,但相对面积比例是上升趋势。因此,在稻谷水分解吸过程中,除了含水量下降,各组分水分流动性下降,“结合水”含 量降低也是水分变化的重要特征。
2.4 粳稻裂纹与水分分布的关系
粳稻品种与其籽粒的重度裂纹率呈显著相关(P< 0.05),但与裂纹率、轻度裂纹率及中度裂纹率不相关(P>0.05),表明品种与重度裂纹有联系。水分含量与 T21、T22、A21及 P21呈极显著正相关(P<0.01),与P22呈极显著负相关(P<0.01),与A22不相关(P>0.05),表明样品横向弛豫时间 T2随着水分解吸,水分流动性逐渐下降。水分含量与 裂纹率、中度裂纹率和重度裂纹率呈极显著负相关(P<0.01),表明水分解吸使籽粒总裂纹率增加和单颗籽粒中的裂纹数量显著增加。T21、T22、A21及 P22与籽粒的裂纹率、轻度裂纹率、中度裂纹率及重度裂纹率均呈极显著负相关(P<0.01),P21与裂纹数据呈极显著正相关(P<0.01)。这表明籽粒的横向弛豫时间T2与内部“结合水”含量对裂纹变化有极大的影响。裂纹率和裂纹程度呈极显著(P<0.01)正相关(表2)。
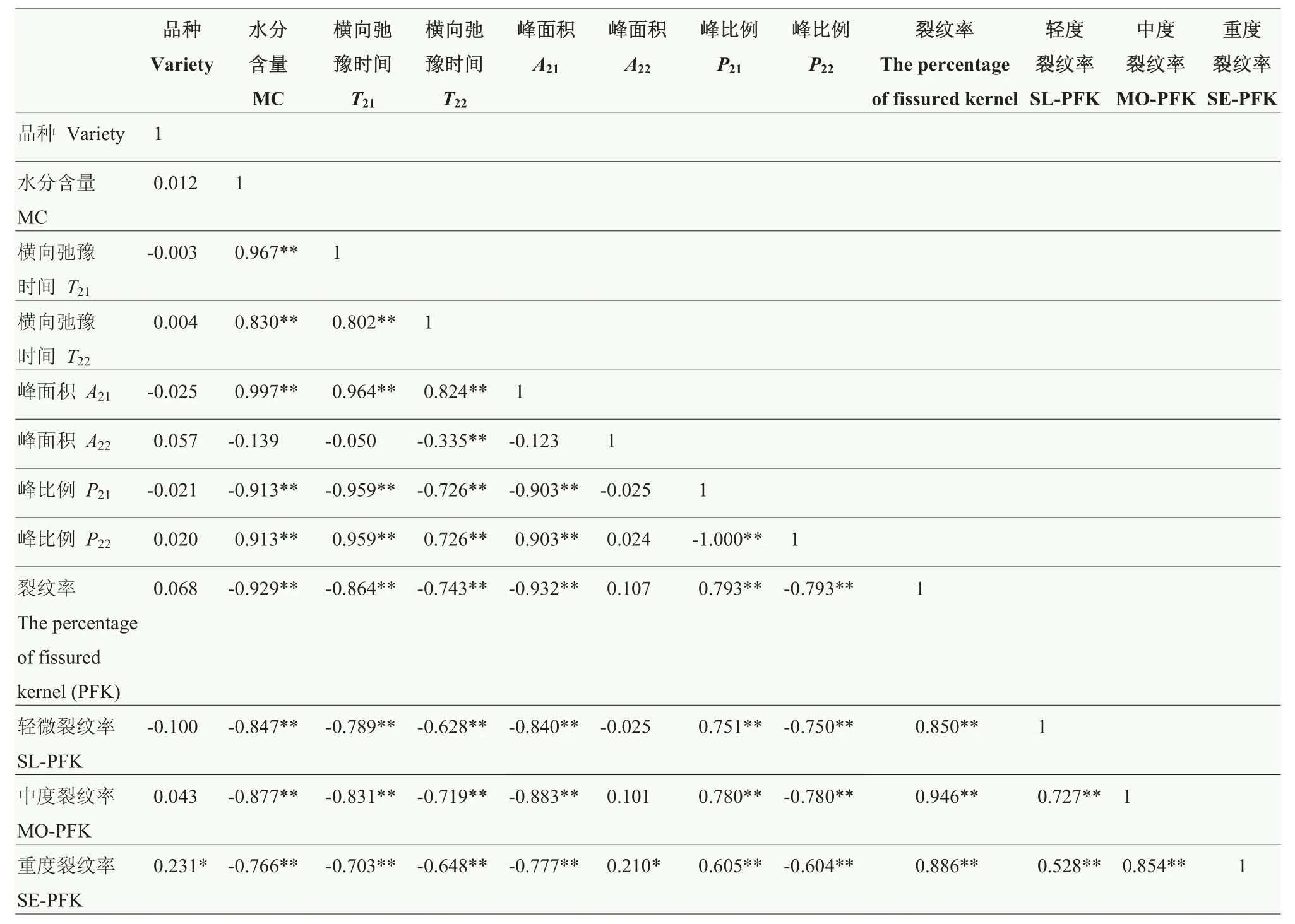
表2 粳稻籽粒裂纹数据与横向弛豫参数相关性分析Table 2 The correlation between fissure data and transverse relaxation parameters of paddy rice kernels
3 讨论
3.1 不同品种粳稻水分分布特征的一致性问题
袁建等[26]和汪楠等[12]利用 LF-NMR技术可以准确地预测单一品种稻谷的水分含量,而本试验基于 3个品种粳稻也可以准确地进行水分测量(图5)。SHAO等[27]使用初始信号强度准确地预测小麦含水率,但是同样模型就不能准确预测混有害虫小麦的含水率,这是由于虫体与小麦水分分布特征差异巨大造成的。而本试验中3种粳稻可以使用同一预测模型,说明3种粳稻的水分分布差异较小,具有一致性。另外,虽然水分的解吸导致籽粒“结合水”和“自由水”的横向弛豫时间、峰面积及比例变化,但样品的水分分布特征并没有发生改变。因此,基于样品单位质量的初始 横向弛豫强度,可以通过同一模型准确预测3种粳稻的水分含量。另有研究使用LF-NMR技术同时测定谷物、油料种子等样品中的水和脂肪含量[28],这是属于同一体系的两类氢质子问题。
3.2 粳稻水分解吸过程中裂纹与水分分布的相关性
本研究提出根据一种 X射线成像的裂纹分类方法,将稻谷按裂纹程度分为4类。根据该法对稻谷裂纹程度进行分类,有利于深入研究裂纹的发展变化。COURTIOS等[29]通过统计分析干燥煮熟大米的可见光图像。按裂纹数量分为3类,即有1条和2条裂纹的认为软裂纹粒,3条及以上裂纹的认为是硬裂纹粒,非贯穿裂纹或无裂纹的认为是无裂纹粒。该分类方法对于透明的煮熟大米具有可行性,但不适合不透明的带壳稻谷、糙米和加工大米等样品。由于X射线能够进行样品内部成像,因此,本分类方法适用于稻谷、糙米和不同加工程度的大米。
随着粳稻水分降低,裂纹籽粒数量比例(裂纹率)和籽粒裂纹类型(裂纹程度)与横向弛豫参数之间的联系被建立。结果表明,稻谷中水分流动性降低,其中弛豫时间较短的“结合水”含量降低与裂纹增加同时发生,因此,“结合水”可能与裂纹密切相关,其含量降低导致裂纹数量的增多。同时表明,低场核磁技术也是检测大米内部裂纹程度及其变化的有效间接手段。
3.3 稻谷裂纹产生与发展的机理
由于裂纹被认为是稻谷加工产生碎米的主要原因,裂纹的产生与发展研究备受关注。稻谷裂纹产生机理主要有应力理论、“楔压力”理论、水合作用力和玻璃化转变理论等[6],分别从力学和温度的角度阐释裂纹产生机理。美国学者 KUNZE等[30-31]认为裂纹形成于稻谷生长后期、收获、运输、干燥和储藏等环节的吸湿作用。稻谷在田间生长过程从抽穗后第 1天稻谷籽粒的水分含量从 55.34%降至后期的20%左右,而其他淀粉、蛋白质和脂肪等组分逐步增加,特别是淀粉后来成为主要成分[11]。水可视为一种粘合剂,将各组分无间隙的粘合在一起,即白色乳浆状物。随着水分的急剧下降,籽粒收缩,稻壳也随籽粒一起收缩。由于淀粉、蛋白质和脂肪不具备水那样的流动性和粘合性,籽粒内部细胞间、淀粉与淀粉颗粒间等由于水分的失去而出现断面。因此,推测早期稻谷裂纹产生源于田间生长后期的籽粒失水,即水分解吸作用,而不是吸湿或水分吸附。
通过水分分布变化可知,淀粉粒“粗糙”断面可能随着“结合水”减少发展成为“光滑”断面。当“光滑”断面增多,裂纹数量增加,裂纹类型也从轻度发展到中度以及重度。因此,推测“粗糙”淀粉间断面是内部结构从完整到裂纹的过渡状态,而“光滑”细胞间断面便是裂纹初期形态。由于过渡和初期裂纹十分微小,很难被除电镜外的检测技术观察到。水分继续解吸会导致细胞间的断面不断增加,从而初期裂纹发展成为可被观察到的裂纹。裂纹数量继续增加,裂纹类型从轻度发展到中度以及重度。由于稻谷籽粒尺寸很小,裂纹处的力学特征和局部温度变化难以量化,因此基于力学和温度的稻谷裂纹产生理论学说难以实证。而低场核磁技术,可量化与稻谷裂纹发生发展密切相关的水分分布及变化。因此,低场核磁技术结合扫描电镜和 X光成像等微观、宏观表征手段,为阐明裂纹产生和发展机理提供一种可能性。
当然,本研究考虑的因素不够全面、样品也较少,具有一定的局限性。如果以此为基础,增加水分解吸温度梯度、解吸速度、湿度差等考察因素,并扩大测试样品范围,如其他地区的粳稻和籼稻等,用以验证稻谷水分解吸过程中“结合水”转化为“自由水”、籽粒内淀粉粒因失去“结合水”逐步结构崩解,直至断面发展成为肉眼可见裂纹的过程,以更好地诠释稻谷裂纹的产生与发展机理。
4 结论
本研究提出一种基于X射线成像手段的稻谷裂纹程度分类方法,根据裂纹数量和种类,将稻谷分为完整粒、轻度、中度和重度裂纹粒等4种类型。粳稻籽粒水分解吸过程中的含水量、水分流动性、“结合水”含量、裂纹程度和裂纹率之间的关系十分密切。水分解吸导致稻谷籽粒的裂纹率增加,以及裂纹程度加深。籽粒水分的迁移和转化,特别是“结合水”下降,是籽粒裂纹发展变化的重要原因。低场核磁技术,结合扫描电镜和X光成像手段,为阐释生物材料的裂纹产生及发展变化机理提供了一种可能性。

