肺癌组织MTA1、VEGF‑C表达变化及与患者临床病理特征、预后关系
赵丽霞,任成波,马峰,李占林,赵峻峰
(河北北方学院附属第一医院1.肿瘤内科;2.放疗科;3.中医科,河北 张家口 075000)
肺癌是世界范围内发病率、死亡率最高的恶性肿瘤,且受空气污染、烟草流行、人口老龄化等因素影响,其发病率、死亡率呈上升趋势[1]。尽管随着当前基础医学及相关学科发展,肺癌诊疗手段取得一定进步,但肺癌患者总体预后仍不理想,探究肺癌发生机制及与肺癌发展、预后相关的生物学标记物是临床研究重要方向[2]。转移相关基因1(metasta‐sis‑associated gene 1,MTA1)蛋白分布于人体多种组织器官,研究认为,MTA1为脱乙酰基复合物的亚单位之一,可通过介导组蛋白去乙酰化、核小体重构过程参与基因表达调控,可能与肿瘤发生和转移有关[3]。血管内皮生长因子C(vascular endothelial growth factor C,VEGF‑C)与血管内皮生长因子同源,可诱导淋巴管内皮细胞增殖、迁移并影响其通透性,还能促进微血管形成,被认为与肿瘤淋巴管、病理性血管生成关联密切[4]。国内外已有研究指出[5‑6],在多种恶性肿瘤如肝癌、乳腺癌、胃癌、鼻咽癌等组织中可检出MTA1、VEGF‑C过表达,二者可能与肿瘤浸润转移有关。不过MTA1、VEGF‑C在肺癌中的研究报道尚不多见,其与肺癌病理类型、预后等关系并无定论。为此,本研究通过免疫组织化学法检测肺癌组织MTA1、VEGF‑C表达情况,并分析其与患者临床病理特征、预后关系,旨在为肺癌临床早期诊疗及预后评估提供新思路。现报道如下。
1 资料与方法
1.1 一般资料
收集河北北方学院附属第一医院2016年1月-2018年9月经病理确诊的200例肺癌组织标本及50例癌旁正常(距肿瘤边缘>5 cm)组织标本。纳入标准:患者均经手术或病理活检明确原发性肺癌诊断,且具有明确的肿瘤分期[7];肿瘤均为单发;组织标本保存完好;年龄35~75岁;均获取完善临床病史及随访信息。排除标准:复发肿瘤病例;合并其他部位原发性肿瘤;无足够可用于免疫组织化学分析的标本;术前已接受放化疗及其他抗肿瘤治疗;存在不明原因异常生化指标;失访。200例患者中男149例,女51例;年龄41~75岁,其中<60岁117例,≥60岁83例;病理类型:腺癌94例,鳞癌79例,小细胞癌27例;分化程度:低分化癌68例,中分化癌73例,高分化癌59例;TNM分期:Ⅰ期29例,Ⅱ期62例,Ⅲ期84例,Ⅳ期25例;淋巴结转移78例,无淋巴结转移122例。本研究经医院伦理委员会批准,患者或家属签署知情同意。
1.2 方法
1.2.1 免疫组化染色步骤 10%(φ)中性福尔马林溶液固定标本,石蜡包埋,以4μm厚度连续切片,烤片机烘烤(58~60℃)60 min;切片经二甲苯脱蜡10 min,于梯度酒精脱苯处理后,以蒸馏水冲洗5 min;切片滴加3%H2O2,于室温下孵育10 min,以阻断内源性过氧化物酶,然后蒸馏水冲洗3次,再于PBS液浸泡5 min;切片置于枸橼酸盐缓冲液(浓度0.01 mmol/L,pH=6),高温高压下修复10 min,冷却后用PBS液冲洗3次;加入封闭用正常血清工作液,室温下封闭15~20 min,倾去,勿洗;滴加稀释(1∶100)的一抗(羊抗人MTA1多克隆抗体、羊抗人VEGF‑C多克隆抗体,均购自美国SANTA CRUZ公司),4℃孵育过夜,PBS液冲洗3次;滴加二抗工作液(生物素标记羊抗兔ⅠgG),室温孵育15~20 min,PBS液冲洗3次;滴加辣根酶标记链酶卵白素工作液,室温孵育15~20 min,PBS液冲洗3次;以DAB显示(显色剂购自福州迈新公司),光镜下控制显色程度,行苏木素复染;梯度酒精脱水,二甲苯透明,中性树胶封片。阴性对照以PBS缓冲液代替一抗。
1.2.2 结果判定 染色结果由2位工作5年以上病理科医师独立判断。MTA1蛋白以细胞核着色为主,部分细胞质着色,阳性显色为棕黄色;VEGF‑C蛋白以细胞质着色为主,呈棕黄色颗粒。每片随机选取5个高倍视野,每视野≥100个细胞。①染色强度:根据染色程度,棕黄色、黄色、浅黄色、无着色分别计3分、2分、1分、0分;②阳性细胞百分比:阳性细胞数>75%、51%~75%、26%~50%、≤25%、阴性分别计4分、3分、2分、1分、0分;总积分取两项乘积,乘积≥3分视为阳性表达。
1.2.3 随访 以患者治疗后出院为随访起点,以肿瘤进展为随访终点,通过电话结合门诊复诊随访形式,参照实体瘤疗效标准[8],统计患者无进展生存期(progression free survival,PFS)(即从治疗结束到肿瘤进展时间)及3年无进展生存率。随访时间截至2021年9月,200例患者随访时长5~49个月,平均(18.66±10.32)个月,中位随访时间16个月。
1.3 统计学分析
应用SPSS 22.0软件,计数数据以[n(%)]描述,采用χ2检验;相关性分析采用Spearman秩相关法;绘制Kaplan‑Meier生存曲线,采用Log‑rank检验比较预后。P<0.05表示差异有统计学意义。
2 结果
2.1 肺癌组织及癌旁组织MTA1、VEGF‑C表达比较
MTA1在肺癌组织表达阳性率70.50%,显著高于癌旁正常组织的26.00%(P<0.05);VEGF‑C在肺癌组织表达阳性率66.00%,显著高于癌旁正常组织的42.00%(P<0.05)。见表1。

表1 肺癌组织及癌旁组织MTA1、VEGF‑C表达比较Table 1 Comparison of MTA1 and VEGF‑Cexpression in lung cancer tissues and adjacent tissues [n(%)]
2.2 不同病理类型肺癌组织MTA1、VEGF‑C表达比较
不同病理类型肺癌组织中MTA1、VEGF‑C表达差异均无统计学意义(P>0.05)。见表2。
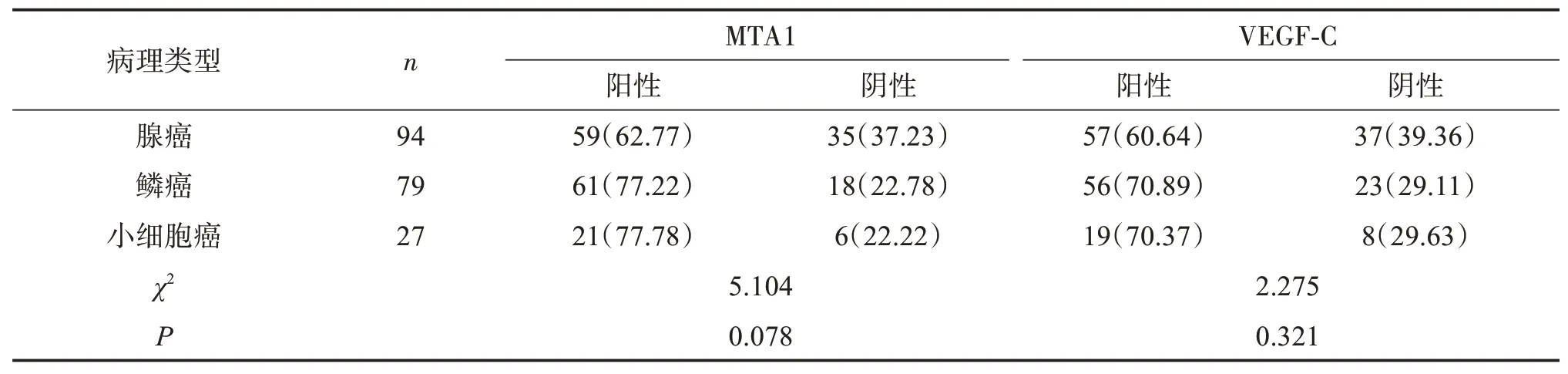
表2 不同病理类型肺癌组织MTA1、VEGF‑C表达比较Table 2 Comparison of MTA1 and VEGF‑Cexpression in different pathological types of lung cancer tissues [n(%)]
2.3 MTA1、VEGF‑C表达与患者临床病理特征关系
肺癌组织MTA1阳性表达与患者肿瘤分化程度低、TNM分期高、淋巴结转移有关(均为P<0.05),与患者性别、年龄、肿瘤部位、肿瘤直径、脉管浸润无关(均为P>0.05);VEGF‑C阳性表达与患者肿瘤分化程度低、TNM分期高、脉管浸润、淋巴结转移有关(均为P<0.05),与患者性别、年龄、肿瘤部位、肿瘤直径无关(均为P>0.05)。见表3。
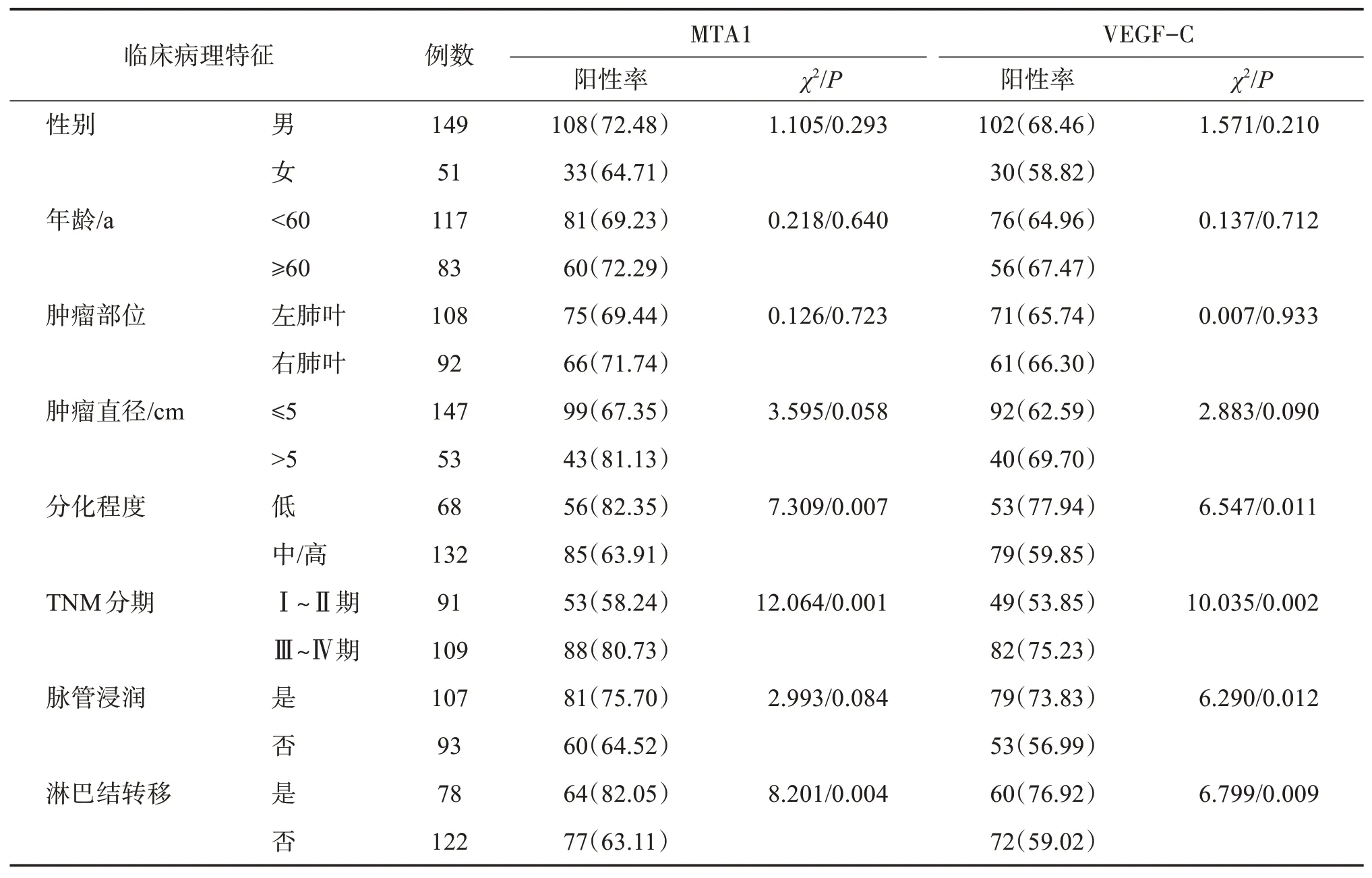
表3 MTA1、VEGF‑C表达与患者临床病理特征关系Table 3 Relationship between the expression of MTA1 and VEGF‑Cand clinicopathological features of patients [n(%)]
2.4 肺癌组织MTA1、VEGF‑C表达相关性
Spearman相关性分析显示,肺癌组织MTA1与VEGF‑C表达呈正相关(P<0.01)。见表4。

表4 肺癌组织MTA1、VEGF‑C表达相关性Table 4 Correlation between the expression of MTA1 and VEGF‑Cin lung cancer tissues
2.5 肺癌组织MTA1、VEGF‑C表达与患者预后关系
随访时间截至2021年9月,肺癌组织MTA1阳性表达者PFS为(16.22±8.87)月,3年无进展生存率为5.67%,均低于阴性者的(24.49±11.25)月、23.73%(Log‑rankχ2=22.522,P<0.001),见图1;肺癌组织VEGF‑C阳性表达者PFS为(16.99±9.58)月,3年无进展生存率为7.09%,均低于阴性者的(21.90±11.00)月、20.34%(Log‑rankχ2=7.762,P=0.005),见图2。
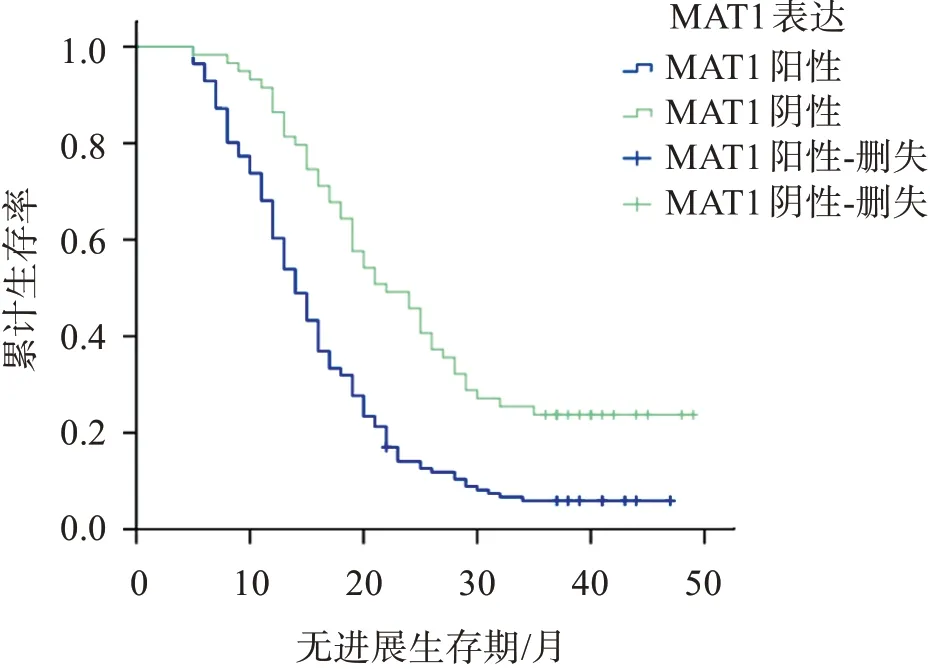
图1 肺癌组织MTA1阳性表达与阴性表达的生存曲线Figure 1 Survival curve of positive and negative expression of MTA1 in lung cancer tissues
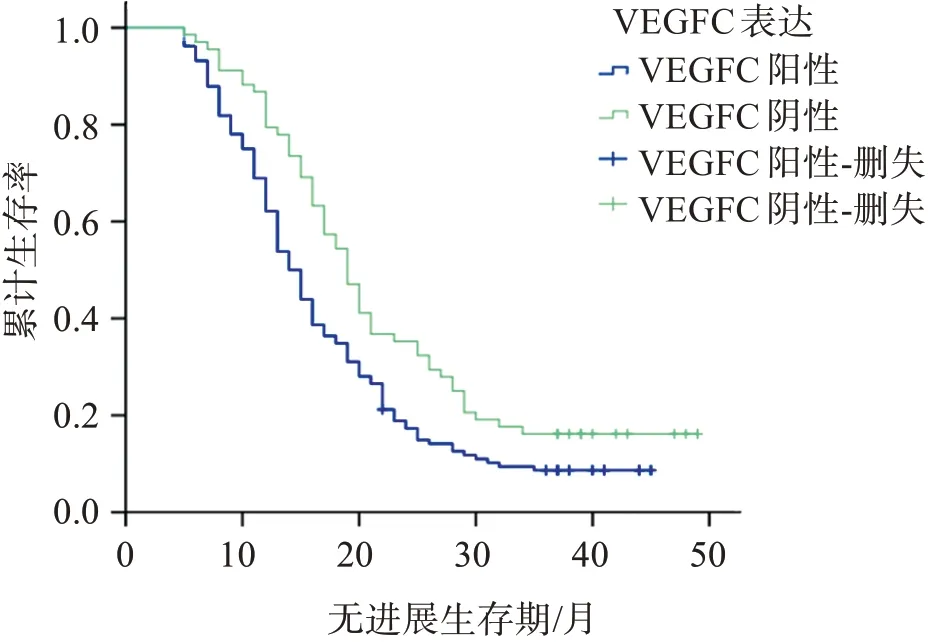
图2 肺癌组织VEGF‑C阳性表达与阴性表达的生存曲线Figure 2 Survival curve of positive and negative expression of VEGF‑Cin lung cancer tissues
3 讨论
肿瘤侵袭和转移是肺癌患者死亡的主要原因之一,而恶性肿瘤的侵袭和转移本身是一个极其复杂、高度选择的非随机过程,可受多基因、多分子调控,探究相关分子生物学机制是提高肺癌诊断及预防的重要前提[9]。一方面,细胞黏度、细胞外基质降解、病理性血管生成等过程是恶性肿瘤侵袭转移的重要生物学基础,另一方面,癌细胞的增殖、凋亡直接影响恶性肿瘤发生发展,因此围绕相关过程探究敏感的生物标记物是肺癌研究的重要方向之一[10]。
MTA1是MTA家族重要成员,该家族能同组蛋白脱乙酰基酶1、组蛋白脱乙酰基酶2相互结合,参与核小体形成组蛋白去乙酰化复合物重塑,与染色质结构变化、核转录调控有关[11]。MTA1基因定位于人染色体14q32.3,编码的MTA1蛋白羧基末端富含脯氨酸,其695~705残基序列同SH3结构域完全配对,而后者可参与信号传导通路中蛋白与蛋白间相互作用,与细胞内信号转导、细胞运动、增殖等多种过程有关[12]。MTA1蛋白还具有2个酪氨酸激酶、7个酪蛋白激酶Ⅱ、9个蛋白激酶的磷酸化位点以及4个N‑糖激化位点,可与信号传导通路中维持细胞正常功能的蛋白发生作用[13]。此外,MTA1蛋白自251残基起有一个亮氨酸反折区、5个SPXX域,自393残基始 有 一个锌指DNA结 合域Cys‑X2‑Cys,与DNA结合蛋白、基因调节蛋白有关;还有一个SANT结构域,同转录因子myb‑相关蛋白的DNA结合域相似,可能参与细胞存活、增殖、分化等调节[14]。MTA1基因首次于老鼠的乳腺癌细胞株分离所得,其表达与乳腺肿瘤转移呈正相关,而近些年来越来越多研究发现,MTA1蛋白高表达还与人类多种肿瘤如喉部鳞状细胞癌、鼻咽癌等侵袭力有关[15‑16]。国内有学者发现,抑制MTA1的表达,能抑制人食管癌Eca109细胞增殖,诱导细胞凋亡[17]。此外,MTA1表达并不局限于肿瘤,在正常组织器官如脑、肝、睾丸等中也可检测出MTA1不同程度表达,其与各种癌肿的相关性报道也不尽相同[18]。本研究采用免疫组化法对肺癌组织中MTA1进行定性检测,发现MTA1在细胞核、细胞质中均可表达,这可能与肿瘤发生发展中MTA1表达及定位紊乱有关。本文结果显示,肺癌组织MTA1阳性表达率明显高于癌旁正常组织,与不同病理类型无关,但与分化程度低、TNM分期高、淋巴结转移有关,提示MTA1可能参与肺癌发生发展。
血管与淋巴管生成既是组织生长、伤口愈合的重要生理过程,也是包括肿瘤在内的多种疾病发生发展的重要病理基础,其中血管内皮生长因子家族是血管生成主要的调控系统,也是参与淋巴管形成的重要因子[19]。VEGF‑C作为血管内皮生长因子家族重要成员,是迄今发现的唯一特异性促淋巴管生长因子,一方面VEGF‑C可通过与VEGFR‑3结合,诱导淋巴管内皮细胞增殖、迁移,同时增加淋巴管通透性,与肿瘤淋巴管形成、癌细胞淋巴血管转移关联密切;另一方面VEGF‑C还可通过与VEGFR‑2结合,参与生理性或病理性血管生成过程启动,与肿瘤血管生成有关。此外,VEGF‑C在癌细胞脱离基质、到达转移部位时抑制其凋亡,可促进肿瘤生长,因此被认为在肿瘤生长、转移的不同阶段均有重要作用[20‑21]。在已研究的人类肿瘤中,有一半肿瘤细胞如胃癌、结肠癌、乳腺癌、前列腺癌等均可表达VEGF‑C[22]。殷文娟等[23]研究指出,VEGF‑C在喉鳞状细胞癌中呈高表达,且与肿瘤淋巴管生成及淋巴结转移有关。本文结果显示,肺癌组织VEGF‑C阳性表达率较癌旁正常组织高,与不同病理类型无关,与分化程度低、TNM分期高、脉管浸润、淋巴结转移有关,提示VEGF‑C可能参与肺癌发生发展。本文结果还显示,肺癌组织MTA1与VEGF‑C表达呈正相关,提示二者可能在肺癌发生发展中有协同作用。有研究[24]指出,VEGF‑C表达可受多个通路影响,其中包括MTA1的调控,其传导通路为缺氧诱导因子‑1α。此外,本文结果显示,肺癌组织MTA1、VEGF‑C阳性表达者PFS缩短、3年无进展生存率下降,说明MTA1、VEGF‑C阳性表达与患者预后有关,二者在肺癌预后判断中展现出一定应用价值,同时提示在临床实践中,对MTA1、VEGF‑C阳性表达或许可通过相关靶向治疗,提高抗肿瘤效果。
综上所述,肺癌组织MTA1、VEGF‑C呈异常高表达,可能与肺癌发展及预后有关,在肺癌预后评估及相关靶向治疗中展现出一定应用前景。本研究不足之处在于缺乏MTA1、VEGF‑C在肺癌作用中具体机制探究,且未对MTA1、VEGF‑C表达进行定量检测,可能结果不够精准,因此尚需其他研究佐证,这也是笔者后期研究关注的方向。

