首次长方案IVF/ICSI-ET失败再次不同促排卵治疗方案临床效果比较
江美燕 杨慧春 陈楠 周燕 张红艳 黄坚 费小阳
在体外受精/卵泡浆内单精子注射-胚胎移植(vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)过程中,对于卵巢储备功能正常的患者,临床通常会选择常规的促排卵方案,如长方案、拮抗剂方案,大部分患者能够获得优质的胚胎并且移植后成功妊娠。但是仍有部分患者长方案治疗1周期后未妊娠。因此,再次超促排卵方案的选择尤其重要,是继续选择促性腺激素释放激素激动剂(gonadotrophin releasinghormone agonist,GnRH-a)长方案,还是选择卵泡期高孕激素状态下促排卵(progestin primed ovarian stimulation,PPOS)方案或微刺激方案,目前临床上还没有统一的标准。PPOS方案主要是通过孕激素负反馈抑制黄体生成素(luteinizing hormone,LH),不会提前出现LH峰[1-2],达到与长方案GnRH-a类似的垂体降调节效果,同时给予外源性促性腺激素(gonadotropin,Gn)促卵泡生长。微刺激方案是指不进行垂体降调节,直接应用克罗米芬、尿促性腺激素等促排卵治疗。目前PPOS方案和微刺激方案主要应用于卵巢储备功能减退或者卵巢低反应的患者,而用于卵巢储备功能正常且长方案失败的患者研究报道鲜见。基于此,本研究观察并比较长方案、PPOS方案和微刺激方案应用于卵巢储备功能正常且首次IVF/ICSI-ET失败患者的临床结局,以期为这些患者实施个体化的助孕方案提供临床参考,现报道如下。
1 对象和方法
1.1 对象 回顾性选取2017年1月1日至2019年12月31日在杭州市妇产科医院治疗的首次长方案IVF/ICSI-ET助孕失败的不孕症患者341例。患者均第1周期采用降调节长方案促排卵,移植后未获活产;第2周期采用长方案促排卵,或者PPOS方案、微刺激方案促排卵后行冷冻胚胎移植(frozen embryo transfer,FET)助孕。纳入标准:(1)卵巢储备功能正常,即基础窦卵泡数(antral follicle count,AFC)>7个,抗苗勒氏管激素(anti-mullerian hormone,AMH)>1.1 ng/ml,基础卵泡刺激素(follicle-stimulating hormone,FSH)<10 mU/ml;(2)经过 1 个长方案治疗后未妊娠;(3)夫妻双方染色体正常;(4)移植日子宫内膜厚度≥8 mm。排除标准:复发性流产、子宫畸形、宫腔粘连。341例患者再次超促排卵方案为长方案168例,PPOS方案75例和微刺激方案98例。3组患者不孕年限、BMI、原发不孕/继发不孕比例、AMH、基础雌激素(estradiol,E2)、LH、FSH 水平比较均无统计学差异(均P>0.05),见表1。本研究经医院医学伦理委员会批准(批件号:[2019]医伦审第(04)号-19),所有患者夫妻均知情同意并签署超促排卵治疗知情同意书。
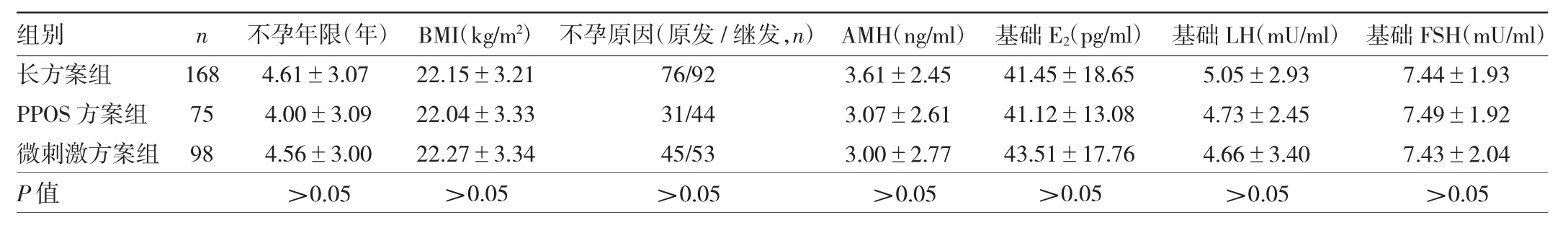
表1 3组患者一般资料比较
1.2 超促排卵方案
1.2.1 长方案组 于患者黄体中期肌肉注射短效GnRH-a(达必佳,辉凌制药有限公司,0.1 mg/支,批号:20100365)0.1 mg,14 d达到降调节标准后,开始皮下注射重组FSH(果纳芬,德国默克雪兰诺,450 U/支,批号:S20160040),根据患者情况给药,150~300 U/d,监测卵泡发育及E2水平并适当调整FSH剂量。当有3个卵泡直径≥18 mm,肌肉注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)(丽珠制药有限公司,5 000 U/瓶,批号:H44020668)4 000~10 000 U,注射后34~36 h取卵。根据男方精液情况行IVF或ICSI授精,胚胎培养,取卵后3 d进行胚胎移植及胚胎冷冻。取卵当天开始肌肉注射黄体酮(浙江仙琚制药有限公司,20 mg/支,批号:H33020828)40 mg/d 及口服地屈孕酮(达芙通,荷兰苏威制药公司,10 mg/片,批号:H20170221)20 mg 2次/d,或者使用黄体酮阴道缓释凝胶(雪诺酮,德国默克雪兰诺制药,90 mg/支,批号:H20140552)90 mg进行黄体支持。移植后第12天检测血β-hCG水平确定生化妊娠,胚胎移植后26 d超声检查证实孕囊存在即诊断为临床妊娠,并追踪随访妊娠情况。
1.2.2 PPOS方案组 于患者月经的第2~3天开始肌肉注射人绝经期促性腺激素(human menopausal gonadotropin,HMG)(丽珠制药有限公司,75 U/支,批号:H44020668),同时每日睡前口服黄体酮胶囊(法国法杏制药有限公司,0.1 g/颗,批号:H20160265)200 mg 1次/d,直至扳机日。监测卵泡发育及E2水平并适当调整HMG剂量。当有3个卵泡直径≥18 mm,肌肉注射hCG 10 000U,注射后34~36 h取卵。根据男方精液情况行IVF或ICSI授精,胚胎培养,胚胎予以全部冷冻。
1.2.3 微刺激方案组 月经的第2~3天开始肌肉注射HMG,同时每天口服克罗米芬(高特制药有限公司,50 mg/片,批号:H20140688)50~100mg 1 次/d,监测卵泡发育及E2水平并适当调整HMG剂量。余同PPOS方案组。
1.3 FET 采用激素替代周期进行内膜准备,患者于月经第2~3天开始口服戊酸雌二醇片(补佳乐,德国拜耳医药保健公司,1 mg/片)3 mg,2次/d,持续 1周;后4 mg,2次/d,持续1周。当子宫内膜厚度≥8 mm后,肌肉注射黄体酮针40 mg 2次/d及口服地屈孕酮20 mg 2次/d进行黄体支持,黄体酮注射第4天行FET。
1.4 卵裂期胚胎、优质胚胎标准 将胚胎分为4级:Ⅰ级,卵裂球大小均匀,胞质清晰,无碎片或碎片比例<10%;Ⅱ级,卵裂球大小均匀,碎片占10%~25%;Ⅲ级,卵裂球大小不均等,碎片占26%~50%;Ⅳ级,卵裂球大小严重不均匀,碎片比例>50%。本研究中评级为Ⅱ级及以上胚胎为可移植胚胎(优质胚胎)[3]。
1.5 观察指标 主要观察指标为:临床妊娠率=(临床妊娠周期数/移植周期数)×100%、流产率=(流产周期数/临床妊娠周期数)×100%、活产率=(临床活产周期数-流产周期数)/移植周期数×100%、周期取消率=(取消周期数/启动治疗的周期数)×100%。次要观察指标为:患者一般情况、Gn天数、Gn总量、获卵数,优质胚胎率=(第3天Ⅱ级及以上胚胎数/双原核卵裂胚胎总数)×100%。并以35岁为界,比较>35岁与≤35岁的3组患者的临床妊娠结局。
1.6 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用SNK检验。计数资料以频数和构成比表示,多组间比较采用χ2检验,组间两两比较采用χ2分割法。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者临床促排卵指标比较 3组患者Gn总量、Gn天数、hCG日E2水平、hCG日LH水平、获卵数比较差异有统计学意义(均P<0.05)。PPOS方案组、微刺激方案组患者Gn总量、Gn天数均小于长方案组,hCG日E2水平均低于长方案组,获卵数均低于长方案组,差异均有统计学意义(均P<0.05)。微刺激方案组患者hCG日LH水平高于长方案组和PPOS方案组,差异有统计学意义(均P<0.05)。见表2。
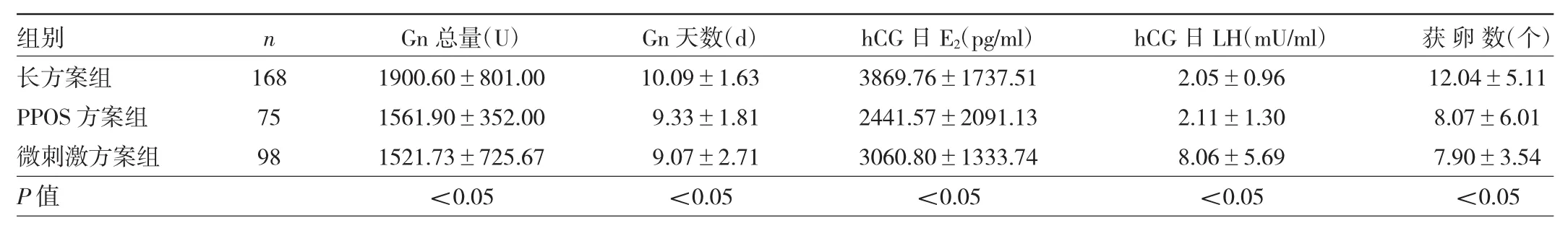
表2 3组患者临床促排卵指标比较
2.2 3组患者临床妊娠结局比较 3组患者优质胚胎率、周期取消率比较差异有统计学意义(均P<0.05)。长方案组和微刺激方案组患者优质胚胎率高于PPOS组(均P<0.05)。微刺激方案组患者周期取消率高于长方案组和PPOS方案组(均P<0.05)。3组患者临床妊娠率、流产率和活产率比较差异均无统计学意义(均 P>0.05),见表 3。
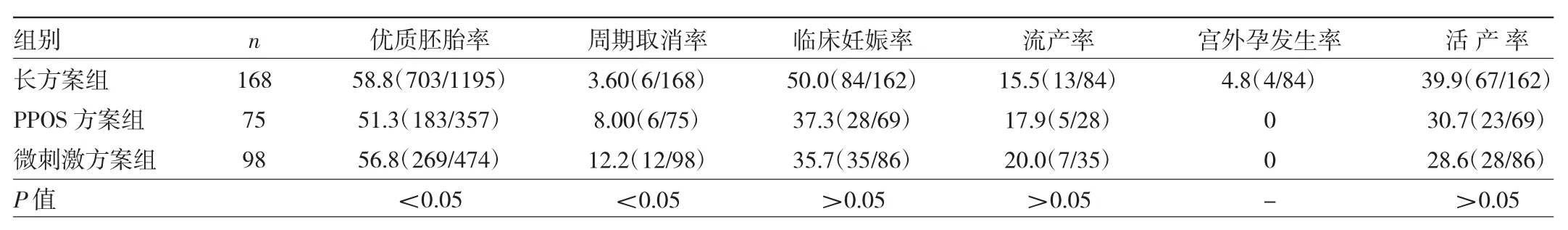
表3 3组患者临床妊娠结局比较(%)
2.3 不同年龄段的3组患者临床妊娠结局比较
2.3.1 年龄<35岁的3组患者临床妊娠结局比较年龄<35岁的3组患者优质胚胎率、临床妊娠率、活产率比较差异均有统计学意义(均P<0.05)。长方案组患者优质胚胎率高于PPOS方案组和微刺激方案组(均P<0.05),长方案组和微刺激方案组患者临床妊娠率、活产率均高于PPOS方案组(均P<0.05)。年龄<35岁的3组患者周期取消率、流产率比较差异均无统计学意义(均P>0.05)。见表4。
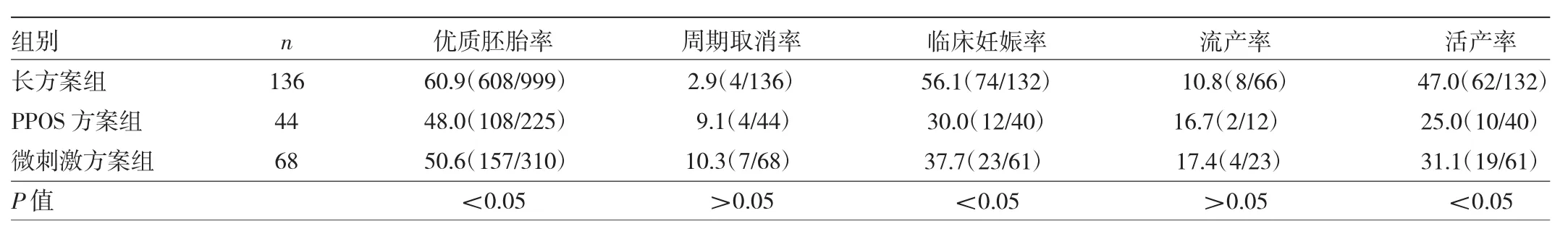
表4 年龄<35岁的3组患者临床妊娠结局比较(%)
2.3.2 年龄≥35岁的3组患者临床妊娠结局比较年龄≥35岁的3组患者优质胚胎率比较差异有统计学意义(P<0.05),微刺激方案组患者优质胚胎率高于长方案组和PPOS方案组(均P<0.05)。年龄≥35岁的3组患者周期取消率、临床妊娠率、流产率、活产率比较差异均无统计学意义(均P>0.05)。见表5。
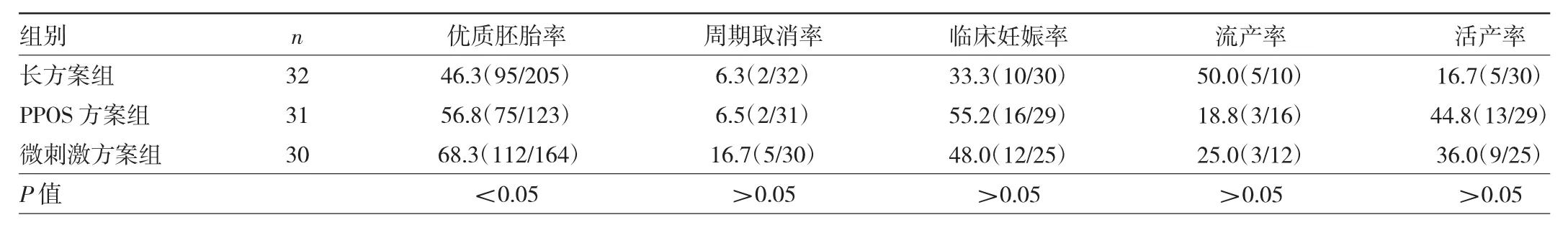
表5 年龄≥35岁的3组患者临床妊娠结局比较(%)
3 讨论
对于卵巢储备功能正常的患者,临床通常会选择标准长方案,目标是获得一定数量(8~15个)的高质量卵母细胞,从而获得最高的临床妊娠率[4]。GnRH-a长方案的优点是通过降调节抑制早发LH峰,获卵数多,周期取消率低,临床妊娠率高[5]。因此笔者团队对于卵巢储备功能正常患者首选GnRH-a降调节长方案,临床妊娠率可达50%~60%,大多数患者能够成功妊娠至活产分娩。
但是部分患者通过标准长方案治疗后,胚胎质量差甚至无可移植胚胎。如何选择再次超促排卵方案,目前没有统一的标准或者共识。临床目前可以再次尝试GnRH-a长方案,或改用其它促排卵方案,如PPOS方案[6]、微刺激方案[7],最终目标是获得优质胚胎,移植后获得妊娠。PPOS方案主要是通过孕激素负反馈抑制LH,不会提前出现LH峰,达到与GnRH-a长方案类似的降调节效果,同时给予外源性Gn促卵泡生长。微刺激方案是指不进行垂体降调节,直接应用克罗米芬、尿促性腺激素等促排卵治疗。
本研究对卵巢储备功能正常且首次常规促排卵方案后未获得妊娠的患者再次促排卵治疗进行回顾性分析,发现PPOS方案组、微刺激方案组获卵数和优质胚胎率均低于长方案组。但是3组患者临床妊娠率、流产率和活产率比较差异无统计学意义。这表明PPOS方案和微刺激方案不是通过增加卵细胞和胚胎的数量来改善妊娠结局,而是通过提高卵细胞和胚胎的利用率来提高临床妊娠率和活产率,Chen等[8]也得到了相似的结论。但是本研究数据显示PPOS方案组和微刺激方案组的Gn量和Gn天数均低于长方案组,且hCG日的E2明显低于长方案组,结果表明PPOS方案和微刺激方案降低了高剂量雌激素损伤卵母细胞的可能性,增加了卵母细胞的利用率,获得接近长方案的临床妊娠结局,还降低了患者的治疗费用,孔娜等[7]研究也得到了相似的结论。本研究表明PPOS方案和长方案hCG日LH值明显低于微刺激方案。PPOS方案对于LH峰的抑制类似于GnRH-a长方案,明显高于微刺激方案,这也是微刺激方案的周期取消率偏高的原因。
随着年龄的增长,女性卵细胞的质量会相应下降,主要包括染色体线粒体功能减退、超微结构改变、非整倍体率增加、端粒酶变短和活性下降等[9],从而导致促排卵过程中获卵数、可利用胚胎数、种植率和临床妊娠率显著降低,周期取消率增加,胚胎染色体异常率及流产率增加[10]。本研究将患者按照年龄进行分组比较,发现年龄<35岁患者中,长方案组优质胚胎率、临床妊娠率、活产率均高于PPOS方案组和微刺激方案组。GnRH-a长方案的优点是通过降调节抑制早发LH峰,获卵数多,周期取消率低,临床妊娠率高[5]。本研究数据表明对于年龄<35岁的患者,仍然推荐长方案进行促排卵治疗,但是在这个过程中应该结合前次促排卵情况,例如Gn起始剂量、Gn天数、卵细胞成熟情况及受精情况进行调整用药。而年龄≥35岁患者中,微刺激方案组优质胚胎率高于PPOS方案组和长方案组;长方案组临床妊娠率和活产率均低于PPOS方案组和微刺激方案组,但差异无统计学意义。有研究指出,对于高龄卵巢储备功能正常的患者,当AMH≤2.0 ng/ml时,长方案出现卵巢低反应的概率增加,此部分患者在长方案中的获益将显著减少,因为长方案会出现抑制过深,从而通过延长Gn天数来改善卵巢反应性,出现Gn总量增加,费用相应增加[11]。然而有多项研究表明,高孕激素水平其实是通过影响子宫内膜的容受性从而影响了最终的妊娠结局,但并不影响卵泡发育以及卵子和胚胎质量[12-13]。微刺激方案减少了促性腺激素类药物的使用剂量,缩短了药物对卵泡发育的干预时间,使卵泡更好地经过自然选择,从而获得高质量的卵母细胞[14],本研究得到了相同的结论。
综上所述,在临床实际工作中,对于卵巢储备功能正常患者首次长方案IVF/ICSI失败再次促排卵治疗时,应该选择个体化的治疗方案。对于年龄<35岁患者,长方案促排卵治疗仍然是一种理想的促排卵方案;但是要结合前次促排卵情况、卵细胞成熟情况及受精情况。而对于年龄≥35岁患者,PPOS方案或者微刺激方案也能获得较好的临床结局,不仅降低了治疗费用,还能够获得较理想的妊娠结局。由于本研究为回顾性研究,而且样本量小,结果可能有偏倚。笔者后期或开展多中心的大样本前瞻性研究,为卵巢储备功能正常患者首次常规方案失败后寻找更优的个体化治疗方案。

