山茱萸环烯醚萜苷对小鼠血管内皮细胞的作用
张 扬,杨 靖,高建萍,陈 毅,孔英俊,夏磊磊,张贵锋,李勇超
(1.河南科技学院 生命科技学院, 新乡 453003;2.中国科学院过程工程研究所生化工程国家重点实验室, 北京 100190;3.北京博辉瑞进生物科技有限公司, 北京 100026)
山茱萸为山茱萸科山茱萸属植物山茱萸(CornusofficinalisSieb.etZucc.)的干燥成熟果肉,始载于《神农本草经》,为我国传统珍贵中药材,主产于我国河南、山西、陕西和浙江地区[1-2]。山茱萸主要成分由环烯醚萜苷、黄酮、鞣质、有机酸、多糖和蛋白质等组成。环烯醚萜类(Cornusiridoid glycosides, CIG)化合物是山茱萸的特征性成分,在山茱萸中含量较高并具有多种生物活性。CIG具有提高免疫力、抗氧化、抗肿瘤、神经保护和心肌保护等作用。随着心脑血管疾病的高发,其抑制血栓形成的作用也越来越受到重视[3-8]。
CIG作为山茱萸主要药效成分,其提取、分离纯化和活性验证等研究愈来愈多。CIG易溶于甲醇和水,可溶于乙醇,因此甲醇回流提取法、超声提取法等被广泛应用于提取CIG[9-10]。D101大孔树脂、SP825型大孔树脂等可用于富集山茱萸提取液中的CIG[10-11]。HPLC指纹图谱的建立是鉴定CIG最常用的方法,此外还有HPLC-MS、核磁共振等方法。有研究[12-15]通过大鼠灌胃、体外血栓形成、细胞培养等多种方法探究某种或多种环烯醚萜苷类成分对血栓形成的抑制作用。张丽等[16]发现CIG总提取液可显著抑制大鼠体内血栓形成,减小体外血栓的直径,并影响凝血酶原时间和凝血酶时间。Yao等[12]将不同剂量CIG灌胃给大鼠,通过使用免疫荧光染色发现CIG可促进大鼠缺血后神经发生和血管生成。沈红胜等[17]发现山茱萸环烯醚萜苷类特征成分马钱苷、莫诺苷对晚期糖基化终末产物(AGEs)导致的人脐静脉内皮细胞损伤具有明显的保护作用。CIG对血管的作用在细胞水平上的研究较少。本研究通过超声提取法对山茱萸果实进行提取,利用D101大孔树脂富集CIG,并通过HPLC、HPLC-MS对CIG提取物进行鉴定,同时探究CIG对小鼠血管内皮细胞增殖、凋亡及形态的影响。该研究为山茱萸用于血栓相关疾病的防治工作提供理论依据。
1 材料与方法
1.1 材料及试剂
山茱萸果实由河南仲景宛西制药股份有限公司提供;血管内皮细胞b.end.3购自中国医学科学院基础医学研究所细胞资源中心;DMEM培养液、胎牛血清和青链霉素双抗均购自以色列BI公司;CCK-8检测试剂盒购自上海东仁科技有限公司;DAPI溶液购自北京Solarbio科技有限公司;Actin-Tracker Green购自上海碧云天生物技术有限公司;AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购自北京富百科生物技术有限公司。
1.2 仪器
高效液相色谱-质谱联用系统(HPLC-MS)由美国Agilent公司1100液相色谱和美国Thermo Fisher公司LCQ DecaXP电喷雾质谱组成,数据采集与处理软件为Xcalibur 3.1;超分辨共聚焦显微镜(Leica SP8 STED 3X),德国Leica公司;流式细胞仪(CytoFLEX LX),美国Beckman Coulter公司;LGJ-100F真空冷冻干燥机,北京松源华兴科技发展有限公司。
1.3 试剂配制
PBS溶液:分别称取8 g NaCl、0.2 g KCl、0.2 g KH2PO4和2.9 g Na2HPO4·12 H2O(或1.44 g Na2HPO4),用去离子水定容至1 L,磁力搅拌混匀,溶液pH值调至7.4后过0.45 μm水系滤膜去除杂质,将过滤后的PBS溶液进行高压蒸汽灭菌。
完全培养基(DMEM):吸取50 mL胎牛血清加到450 mL DMEM培养液中,并加入5 mL青链霉素双抗,用移液枪吹打均匀,分装使用。
1.4 方法
1.4.1 山茱萸CIG提取物制备
将山茱萸果实进行真空干燥,经粉碎机粉碎后置于干燥器中保存;称取20 g山茱萸粉碎物,加入10倍体积80%甲醇,超声提取90 min,过滤后弃去滤渣,滤液经旋转蒸发仪浓缩后加水定容至20 mL。将该提取液通过D101大孔树脂,超纯水淋洗后用体积分数为50%乙醇洗脱,收集洗脱液,干燥。
1.4.2 山茱萸CIG提取物鉴定
称取5~10 mg CIG冻干粉和4种环烯醚萜苷标准品,用体积分数为50%甲醇复溶后离心取上清液,HPLC-MS负离子模式检测。
质谱条件:色谱柱为Zorbax SB C18[150×2.1 mm(I.D.),5 μm];流动相A(超纯水),流动相B(纯乙腈);梯度0~25 min,5%~30% B;25~35 min,30%~50% B;进样量10 μL;流速0.2 mL/min。离子源喷雾电压3.0 kV,毛细管温度300 ℃,扫描范围150~1 500 m/z,精确质量数扫描和二级质谱扫描均为数据依赖型扫描,碰撞能量为35%。
1.4.3 血管内皮细胞增殖系数检测
将处于对数生长期的细胞解离,配成1×104~2×104mL-1细胞悬液;96孔板中每个孔接种约103个细胞,每组设置5个平行;将细胞在37 ℃、5% CO2条件下培养24 h后,将原培养液分别换成100 μL普通培养液和添加不同剂量CIG的培养液(0.5~50 μg/mL),培养24 h后每孔加入10 μL CCK-8试剂,培养1~2 h,通过酶标仪在450 nm波长处检测各孔的吸光度。通过OD值比较各组之间细胞增殖的差异并作显著性差异分析。
1.4.4 高糖条件下血管内皮细胞增殖系数检测
细胞接种及检测方法同1.4.3节,将原培养液分别换成100 μL普通培养液、100 mmol/L高糖培养液及添加不同剂量CIG的高糖培养液(0.5、5和50 μg/mL)。通过OD值比较各组之间细胞增殖的差异并作显著性差异分析。
1.4.5 血管内皮细胞形态观察
将处于对数生长期的细胞解离,配成1×104~2×104mL-1细胞悬液;每个共聚焦小皿中接种约103个细胞,在37 ℃、5% CO2条件下培养24 h后,将培养液置换成不同的新鲜培养液;分别设置对照组、高糖组、DMSO组和低、中、高质量浓度CIG加药组(0.5、5和50 μg/mL)。
培养箱孵育24 h后倒掉培养液,PBS清洗3次,通过质量分数为4%的多聚甲醛固定液固定10 min;用体积分数为0.1% Triton X-100的PBS洗涤2~3次,每次5 min;用含1% BSA和0.1% Triton X-100的PBS按照1∶50的比例稀释Actin-Tracker Green染色液(激发波长496 nm,发射波长516 nm),每个样品滴加200 μL,室温孵育20~60 min;用含0.1%Triton X-100的PBS洗涤2~3次;加入少量DAPI染色液(激发波长340 nm,发射波长488 nm)孵育2~3 min;PBS清洗2~3次,在激光共聚焦显微镜下观察并拍摄。
1.4.6 血管内皮细胞凋亡检测
将处于对数生长期的细胞解离,配成1×105~2×105mL-1细胞悬液;6孔板中每孔接种约105个细胞,振荡均匀后静置10 min,在37 ℃、5% CO2条件下培养12 h。将培养液置换成不同组的新鲜培养液;分别设置对照组、高糖组、DMSO组和低、中、高质量浓度CIG加药组;继续培养24 h后,使用不含EDTA的Trypsin将细胞解离;2 000 r/min离心弃上清液,加2 mL预冷PBS继续离心弃上清液,该步骤重复2次;用去离子水稀释Binding Buffer,取250 μL重新悬浮细胞;取100 μL细胞悬液,加入5 μL AnnexinⅤ-FITC轻轻混匀,室温避光孵育10 min;上机前5 min加入10 μL碘化丙啶溶液和400 μL PBS,轻轻混匀后避光保存;随即进行流式细胞仪(FACS)检测。
1.4.7 统计学分析

2 结果与讨论
2.1 山茱萸提取与分析
将山茱萸果实提取液浓缩后得到深红色提取液,静置后有米黄色沉淀,冻干后极易吸潮黏稠。该沉淀易溶于乙醇,可溶于甲醇但难溶于水,推测沉淀含较多非环烯醚萜苷类成分。将提取液通过D101大孔树脂纯化,用超纯水淋洗后以50%乙醇洗脱,洗脱液浓缩后红色变浅,静置后发现少量沉淀,冻干后样品呈粉末状。在提取过程中,高浓度甲醇可除去大部分的蛋白质和糖,大孔树脂除去的部分可能是色素、酯类和部分残留的糖,洗脱部分通过HPLC-MS检测。
图1为CIG总提取物的总离子流图,根据文献报道的山茱萸环烯醚萜苷类化合物质荷比进行提取,对提取离子流图和一级质谱图分析和比对,结果表明,提取物中主要有4种环烯醚萜苷类成分。图2中A是莫诺苷在负离子模式下存在或者以结合甲酸或Cl-形式存在的质谱图,提取离子为m/z 405.15、441.05和451.15,但发现有莫诺苷以二聚体结合甲酸的形式存在,这可能是出现两个峰的原因;图2中B是獐牙菜苷在负离子模式下以结合甲酸形式存在的质谱图,提取离子为m/z 403.15,但也发现其以二聚体形式存在的m/z 760.83;图2中C是马钱苷在负离子模式下存在或以结合甲酸形式存在的质谱图,提取离子为m/z 389.38和435.15,发现其以二聚体形式存在的m/z 824.38;图2中D是山茱萸新苷在负离子模式下存在或以结合甲酸形式存在的质谱图,提取离子为m/z 541.15和586.15,但也发现其二聚体形式存在的m/z 1 083.12。此外,还发现马钱苷以马钱苷酸二聚体形式存在,莫诺苷以脱氢莫诺苷糖苷元二聚体形式存在以及7-O甲基莫诺苷存在。

图1 山茱萸CIG提取液总离子流图
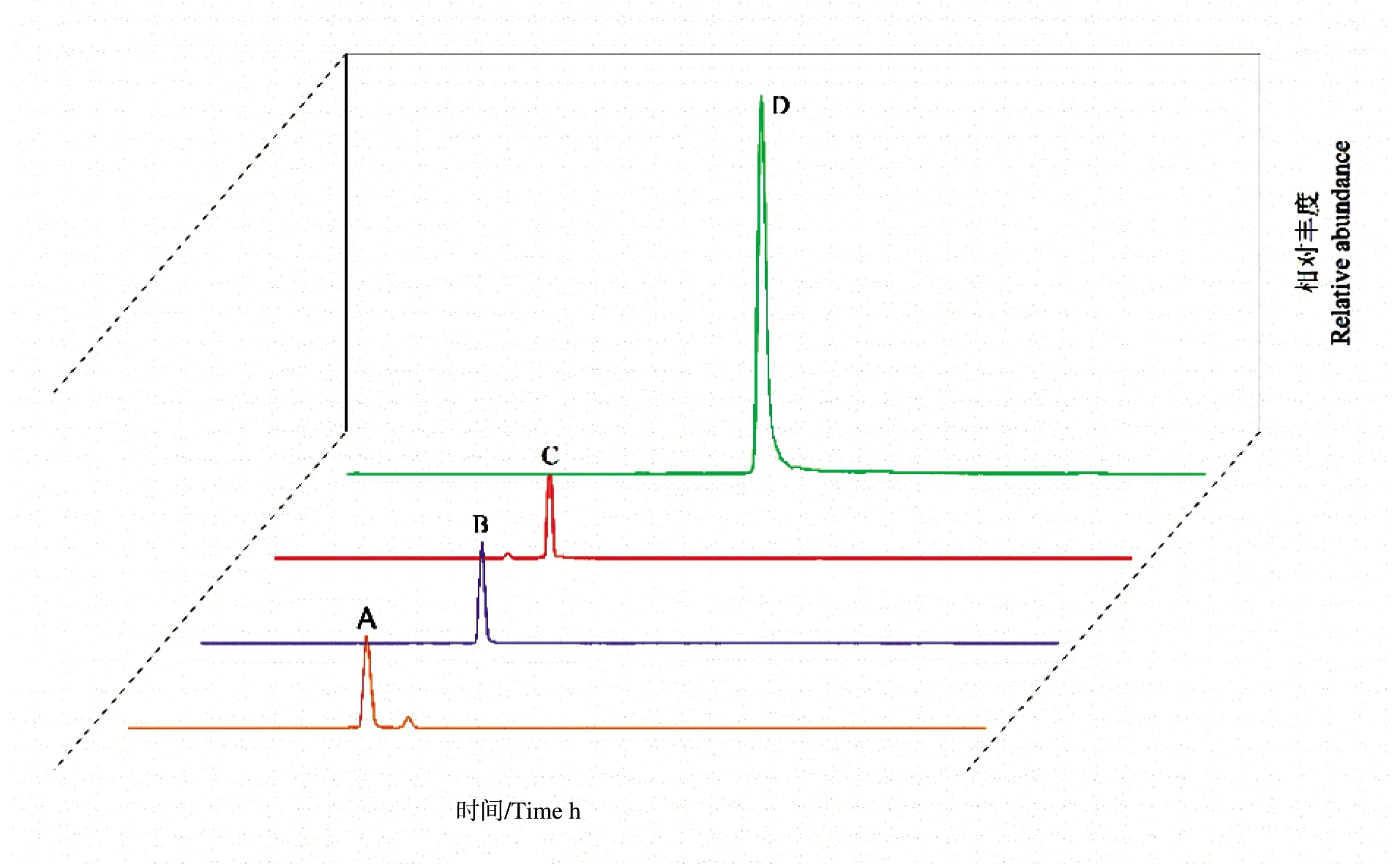
A为莫诺苷;B为獐牙菜苷;C为马钱苷;D为山茱萸新苷。
本试验初步断定该提取物中有大量环烯醚萜苷类成分存在,但不排除有少量黄酮类及其他成分存在。环烯醚萜苷类中莫诺苷、马钱苷和山茱萸新苷丰度较高,獐牙菜苷丰度相对较低。通过标准物质对4种环烯醚萜苷类成分进行进一步鉴别和定量,将标准样品与CIG提取物的液相色谱和质谱数据比对,样品中各化合物的保留时间与标准品相同,其二级离子与标准品的二级质谱图匹配度较高,因此可确定CIG提取物检测到的化合物为上述4种环烯醚萜苷类成分。通过对不同浓度的标准样品检测来确定其浓度与峰面积的线性回归曲线,4种化合物的标准曲线线性关系良好。通过线性关系得到CIG提取物的含量,其中:莫诺苷28.5%,马钱苷20.4%,山茱萸新苷4.5%,獐牙菜苷约2%,总含量超过55%。CIG提取物中其他成分可能为色素或者少量糖类,因此其冻干物呈红色。
2.2 山茱萸果实提取物对血管内皮细胞的作用
2.2.1 CIG提取物对血管内皮细胞增殖的影响
通过CCK-8细胞增殖试验探究不同浓度CIG对血管内皮细胞增殖活性的影响。将试验组1~6分别与对照组作显著性差异分析,相较于对照组,加入CIG后细胞增殖更快。但试验组6细胞与对照组并无明显差异,可能是CIG浓度超出了其最适范围,对细胞的积极作用反而降低。结果表明适当浓度的CIG可在一定程度上促进血管内皮细胞的增殖。

Control group为正常DMEM培养液培养;Group 1~6为DMEM培养液分别加入CIG(0.5、1、5、10、20和50 μg/mL), *表示P<0.05,**表示P<0.01。
2.2.2 CIG提取物对血管内皮细胞凋亡的影响
通过添加最适浓度的CIG探究其对高糖引起的血管内皮细胞凋亡的影响。将各组分别与试验组1作显著性差异分析,试验组1细胞增殖率明显低于对照组,证明在高糖条件下细胞增殖受到较大影响;试验组2~4与试验组1相比,细胞增殖率显著升高。结果表明高糖培养液可抑制血管内皮细胞增殖,但适当浓度的CIG可改善此抑制效果。

Control group为正常DMEM培养液培养;Group 1为含100 mmol/L葡萄糖的DMEM-H培养液;Group 2~4为100 mmol/L葡萄糖DMEM培养液分别加入CIG(0.5、5和50 μg/mL), *表示P<0.05,**表示P<0.01。
2.2.3 CIG提取物对血管内皮细胞形态的影响
图5为Actin-Tracker Green和DAPI双染色及明场条件下合成的图片,绿色荧光为细胞骨架染色,蓝色荧光为细胞核染色,双染色的方法可在激光共聚焦显微镜下明显观察到各组细胞形态差异。图5(a)为在正常培养条件下生长的细胞,细胞间紧密相连,细胞饱满呈铺路石状,符合血管内皮细胞的正常形态;图5(b)为阴性对照组,细胞数量较少且萎缩严重,可见10% DMSO可显著诱导细胞凋亡;图5(c)为高糖组,细胞间隙较大,与图5(a)相比细胞明显萎缩,证明高浓度葡萄糖会影响血管内皮细胞正常生长,与糖尿病、高血糖引起的血管疾病相关。图5(d)和(e)为0.5、5 μg/mL的CIG组,相较于图5(c),细胞间隙较小,且细胞更加饱满,几乎恢复到图5(a)水平,证明0.5~5 μg/mL 的CIG可显著抑制高糖引起的细胞萎缩及凋亡。图5(f)的细胞状态虽达不到图5(d)和(e)的效果,但细胞间隙及萎缩程度与图5(c)相比有所改善。结果表明,添加适当质量浓度CIG可在一定程度上缓解因高糖引起的血管内皮细胞萎缩和凋亡,改善细胞活性,不仅可以防止血管内皮细胞衰老或脱落,还可以抑制对血液环境有害的代谢物的分泌,保护单层血管内皮细胞的健康和完整性,避免细胞外基质中胶原和不溶性纤维蛋白等凝血因子裸露引起的血小板凝集和血栓形成,从而起到保护血管的作用[18]。

(a)对照组为正常DMEM培养液培养;(b)阴性对照组为10% DMSO培养液;(c)含100 mmol/L葡萄糖的DMEM-H培养液;(d)~(f)低、中、高质量浓度CIG组,即100 mmol/L葡萄糖DMEM培养液分别加入CIG 0.5、5和50 μg/mL。
2.2.4 CIG提取物对血管内皮细胞凋亡早、晚期的影响
图6所示,左上、左下、右上及右下象限分别为机械性损伤细胞、活细胞、晚期凋亡及坏死细胞和早期凋亡细胞。在机械性损伤不计的情况下,发现100、200 mmol/L葡萄糖均可不同程度地诱导细胞凋亡。在100 mmol/L高糖诱导条件下,50 μg/mL CIG[图6(d)]抑制凋亡的作用并不明显,但0.5、5 μg/mL的CIG[图6(b)和(c)]可减轻细胞凋亡的程度,晚期凋亡和坏死细胞比例向早期凋亡细胞转移。200 mmol/L高糖[图6(f)]诱导细胞凋亡的效果比100 mmol/L[图6(a)]更明显,3种质量浓度CIG均可抑制该凋亡效果,但5 μg/mL质量浓度[图6(g)]条件下抑制效果最为明显,50 μg/mL的CIG[图6(h)]抑制效果强于0.5 μg/mL的CIG[图6(f)]。该结果与100 mmol/L高糖条件下相反,可能是葡萄糖浓度升高,细胞损伤和凋亡更严重,需药量增加的原因。从细胞凋亡比例、细胞凋亡早、晚期比例可以看出,CIG抑制高糖引起的血管内皮细胞凋亡属于剂量依赖性,其可减轻细胞损伤或凋亡的严重程度,改善细胞活性。适当浓度的CIG可促进血管内皮细胞的活性,抑制高糖引起的细胞凋亡。血管内皮细胞的健康是预防血栓形成的重要措施,是血管内壁内皮化的重要因素,提高内皮细胞活性可改善高血糖对血管内皮化的破坏。
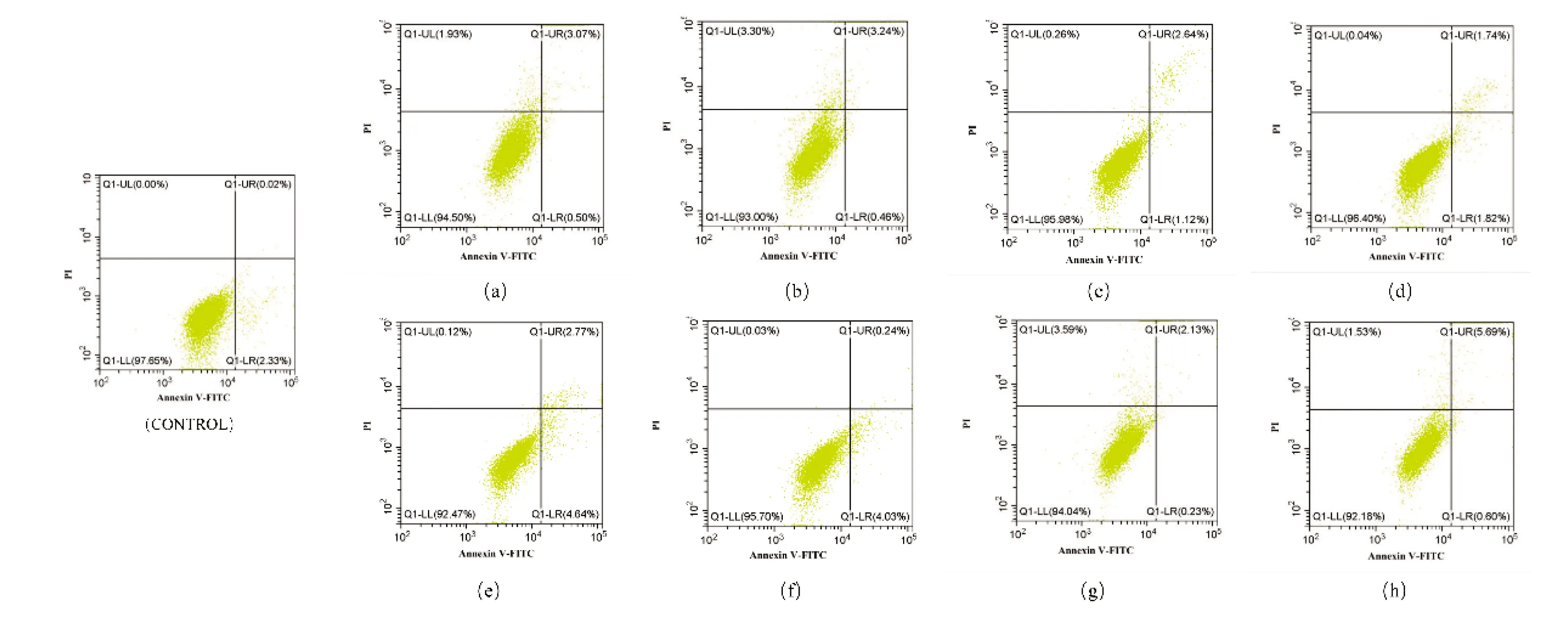
Control为普通DMEM培养液培养。(a)100 mmol/L高糖培养液组;(b)~(d)分别在高糖培养液中加入CIG 50、5和0.5 μg/mL;(e)200 mmol/L高糖培养液组;(f)~(h)分别在高糖培养液中加入CIG(50、5和0.5 μg/mL)。
3 结论
通过提取、富集等步骤得到CIG提取物,利用HPLC-MS对其进行鉴定和定量;将该提取物加入细胞培养液中干预细胞生长,发现0.5~50 μg/mL的CIG提取物可显著提高血管内皮细胞增殖活性,减轻高糖条件下细胞的萎缩,抑制高糖引起的细胞凋亡。综上所述,CIG对高糖环境中的血管内皮细胞具有保护作用。
血管内皮细胞衰亡是血栓形成的重要原因,增强细胞活性、保护单层细胞完整性可促进血管内皮化,防止血管内壁损伤。为进一步佐证CIG具有保护血管的作用,后续研究还可对血管内皮细胞蛋白表达进行检测,通过蛋白差异性表达阐述CIG保护血管内皮细胞的作用。

