乌拉尔甘草CIPK基因家族鉴定与表达分析
仙亚杰,王 斐,谢双全,陈喜凤,沈海涛,李鸿彬
(石河子大学 生命科学学院 新疆植物药资源利用教育部重点实验室,石河子 832003)
乌拉尔甘草(Glycyrrhizauralensis)是一种重要的药用植物,其根和根茎中含有的次生代谢物质是主要的药用成分[1-2]。甘草抗逆性以及逆境环境与次生代谢物合成与积累的相关研究已开展了一些工作[3-4]。在水分亏缺的生长环境中,甘草侧根可以延长生长到几十米外去寻求水分[5]。乌拉尔甘草幼苗具有离子区隔化及平衡能力,在盐胁迫条件下幼苗能促进K+,抑制Na+向上部叶的运输,维持较高的K+/Na+比值,从而减少盐害作用[6]。使用一定浓度的盐溶液处理可以提高甘草产量及甘草中甘草酸的含量[7]。适当的干旱胁迫刺激不仅能促进甘草体内的糖代谢,加速物质分解,还能促进甘草酸的形成并在植物体内大量积累[8-9]。
CIPK为植物所特有的一类丝氨酸/苏氨酸蛋白激酶,属第3类SnRK3激酶(SNF-1 related protein kinase 3, SnRK3),具有N-端的激酶域和C-端的调节域[10-11]。目前在拟南芥(Arabidopisisthaliana)、水稻(Oryzasativa)、杨树(Populuspoplars)、玉米(Zeamays)、油菜(Brassicanapus)和高粱(Sorghumbicolor)中已分别克隆鉴定出多个CIPK基因[12-15]。大量研究表明,CIPK基因的表达与逆境胁迫密切相关:水稻作物中OsCIPK3经低温诱导后其表达量上调,过表达OsCIPK12可增强水稻的耐旱性[16];小麦TaCIPK7、TaCIPK15、TaCIP24、TaCIPK32基因参与诱导植物低温胁迫应答[17]。关于乌拉尔甘草GuCIPK基因信息及其参与逆境胁迫的表达与潜在功能的相关研究未见报道。
利用生物信息学方法从乌拉尔甘草全基因组中鉴定获到22个GuCIPK基因,并对这些基因的染色体分布、基因结构和基序、进化关系和顺式作用元件进行系统分析,研究GuCIPK在非生物胁迫下的表达特征,为解析GuCIPK基因在非生物胁迫应答和生长发育中的功能和调控机制奠定基础。
1 材料与方法
1.1 材料
甘草品种为石河子大学甘草研究所保存的野生药用乌拉尔甘草(Glycyrrhizauralensis),凭证标本为李学禹(880124)。将甘草种子用98% H2SO4浸泡处理 25 min,无菌水冲洗3次,0.1% HgCl2消毒7 min后播种至基质盆钵内,温度28 ℃/25 ℃(白天/黑夜),光照周期16 h/8 h(光照/黑暗)进行蛭石培养45 d。收集同一时期乌拉尔甘草的根、茎和叶片组织,置于-80 ℃备用。选择长势一致的幼苗移至300 mL的水培瓶中,用1×Hoagland(去除Na+)营养液水培3 d后进行非生物胁迫处理。
1.2 方法
1.2.1 乌拉尔甘草CIPK基因家族成员鉴定与生物信息学分析
以拟南芥(25个)和大豆(52个)的CIPK氨基酸序列作为参考序列,使用Blastp比对乌拉尔甘草的蛋白数据库(筛选条件:E-value<1e-10, identity>55%),去除重复后根据CIPK蛋白的保守结构域筛选甘草GuCIPK候选基因,并根据相应的软件进行生物信息分析[18-19]。GuCIPK蛋白的等电点、分子质量、亚细胞定位等分析由在线网站获得(http:∥expasy.org/)。使用MEGA软件采用邻接法(Neighbor-Joining)分析将乌拉尔甘草、拟南芥、大豆CIPK基因家族的系统进化,校验参数1 000次重复。基因结构和保守基序分别使用GSDS(http:∥gsds.cbi.pku.edu.cn/)和MEME(http:∥meme-suite.org/index.html)在线分析,多序列比对使用Bioedit软件进行。染色体的分布和基因间的复制关系分析使用TBtool软件(https:∥github.com/CJ-Chen/TBtools)完成。非同义突变Ka和同义突变Ks通过DnaSP 5.0软件计算;共线性关系图通过Graphics工具分析并绘制。提取GuCIPK基因上游约1 500 bp的启动子序列并通过PlantCARE(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/)分析存在的顺式作用元件。
1.2.2 材料处理
分别使用包含300 mmol/L NaCl、100 g/L PEG6000、2% H2O2的Hoagland营养液水培甘草进行盐、干旱以及超氧胁迫处理;将甘草苗放置于4 ℃和42 ℃的光照培养箱中进行低温和高温胁迫处理。分别收集处理0、6、12、24 h的根组织材料进行液氮速冻并冻存于-80 ℃待用。
1.2.3 RNA提取与基因表达分析
使用天根公司(中国北京)的多糖多酚植物总RNA提取试剂盒提取不同甘草材料的总RNA,利用宝生物公司(中国北京)的ScriptTM RT试剂盒进行反转录获得cDNA。使用Primer Premier 5.0软件[20]设计特异性引物(表1),并由生工生物工程(中国上海)股份有限公司合成。甘草肌动蛋白基因GuActin作为内参基因。使用实时荧光定量PCR(qRT-PCR)分析GuCIPK基因的表达特征,每个反应设置3个重复,相对表达值使用2-ΔΔCt法。热图制作及聚类分析使用MultiExperiment Viever软件[21]。
2 结果与分析
2.1 乌拉尔甘草GuCIPK家族基因鉴定与系统发育分析
从乌拉尔甘草基因组数据库中初步鉴定到22个CIPK基因家族成员(GuCIPK1~GuCIPK22),相关信息见表2。其中GuCIPK17为拼接错误序列,对该序列设计引物(表1)并经PCR扩增和测序验证后获得完整序列。结果显示:所有GuCIPK基因家族成员分布在19个不同的染色体位置(图1)。22个GuCIPK基因之间共检测到GuCIPK1/GuCIPK17、GuCIPK9/GuCIPK21、GuCIPK5/GuCIPK15、GuCIPK6/GuCIPK19和GuCIPK4/GuCIPK22这5个片段重复事件基因对。22个GuCIPK的开放阅读框的列长度分布在1 200~1 695 bp之间,编码的蛋白质序列长度在393~564个氨基酸之间,理论分子质量为44.23~64.15 ku,等电点分布为5.82~9.43。亚细胞定位预测显示GuCIPK均定位在细胞外基质(表2)。乌拉尔甘草与拟南芥和大豆CIPK之间的进化分析显示:CIPK聚类为Ⅰ~Ⅴ 5个组(图2),其中Ⅰ和Ⅴ组的成员最多,各有8个成员,Ⅱ组和Ⅲ组分别有2个和3个成员,Ⅳ组只有1个成员。

黑线代表片段重复基因对;支架以不同颜色显示为圆形。
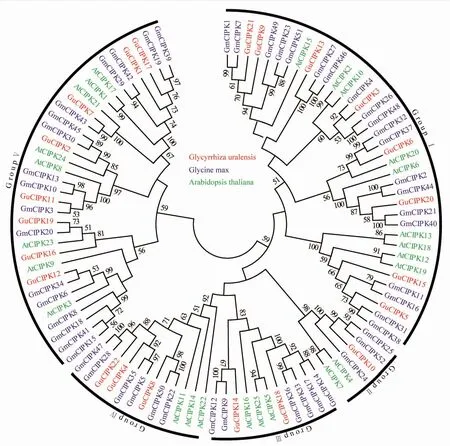
红色、绿色和蓝色分别表示乌拉尔甘草、拟南芥和大豆的CIPK蛋白。

表1 用于GuCIPK基因扩增和表达分析的引物

表2 GuCIPK的详细信息
2.2 乌拉尔甘草CIPK基因结构及保守结构域分析
为进一步探究乌拉尔甘草CIPK的结构特征,对CIPK的CDS序列和蛋白序列分别进行基因结构和保守结构域分析(图3)。GuCIPK家族成员可分为两大类:内含子富集的分支和内含子缺失的分支。内含子丰富的GuCIPK基因聚类在Ⅴ组中,而聚类在Ⅰ~Ⅳ组的GuCIPK成员包含内含子较少[图3(a)]。蛋白 motif分析结果显示:GuCIPK共包含18个motif,其中 motif 9是CIPK蛋白NAF功能结构域,广泛分布于所有的GuCIPK蛋白中;另外,除GuCIPK7外的其他21个GuCIPK成员都含有1个ATP连接结构域(motif 4)。所有GuCIPK都包含1个N端催化激酶结构域和1个C端调节结构域,说明这些结构域对蛋白质-蛋白质相互作用非常重要。本研究的所有GuCIPK的N端序列中含有1个激活域,C端序列中含有1个可与CBL蛋白结合的NAF结构域及一段相对保守的可能与磷酸酶相结合的PPI结构域(图4)。
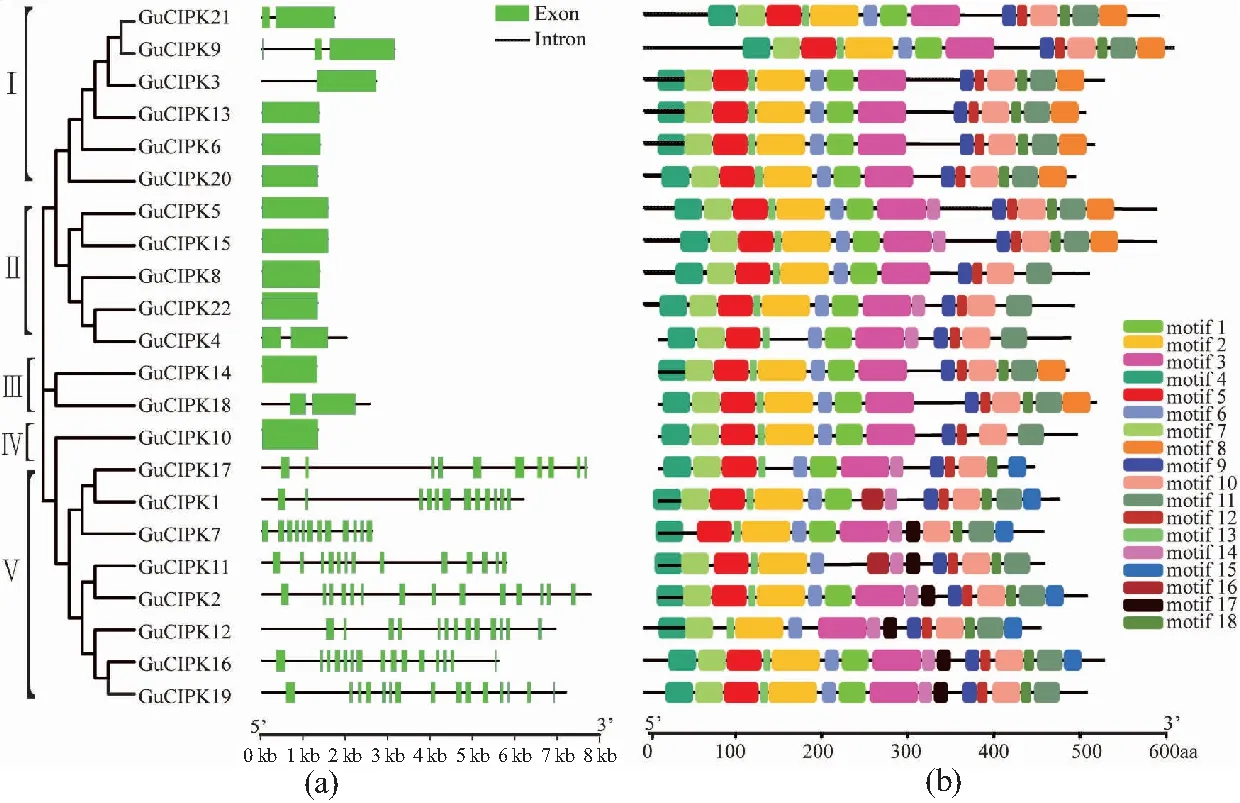
(a)CIPK基因外显子/内含子结构(墨绿色框和黑色线条分别代表外显子和内含子);(b)CIPK蛋白保守基序分布(不同颜色的图形表示不同的motif,基因组长度显示在底部)。
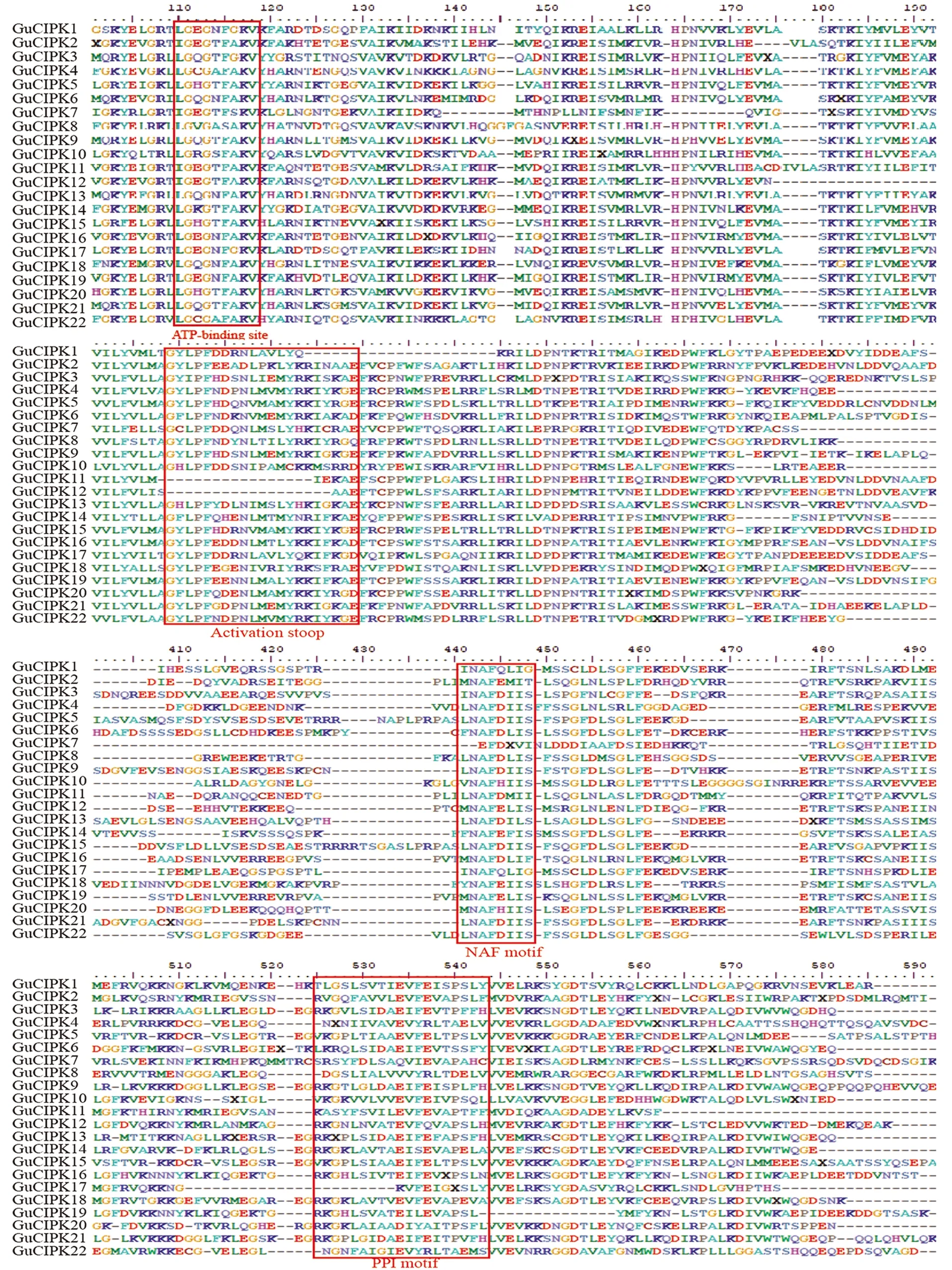
图4 GuCIPK的多序列比对及保守结构域分析
2.3 乌拉尔甘草CIPK基因家族顺式作用元件分析
为了解乌拉尔甘草GuCIPK基因家族成员所包含的顺式作用元件及可能的受调控情况,调取了22个GuCIPK家族成员上游1 500 bp的核酸序列进行启动子元件预测分析(图5)。结果显示:4个成员具有TC-richment元件,说明这4个成员可能与防卫和逆境应答相关;15个成员具有HSE元件,说明这些成员的表达可能与响应热胁迫相关;8个成员具有LTR元件,说明它们可能与冷胁迫应答相关;10个成员存在MBS元件,暗示它们的表达可能与干旱胁迫相关。在激素调控中,9个成员具有茉莉酸甲酯应答元件,13个成员具有ABRE元件,6个基因具有TCA元件,说明这些成员可能与茉莉酸、脱落酸、水杨酸等激素响应密切相关。

表示转录起始作用元件;▷表示植物激素响应元件;表示与环境胁迫相关的响应元件;▽表示与植物生长发育调控相关的顺式作用元件。
2.4 乌拉尔甘草GuCIPK组织特异性表达分析
乌拉尔甘草GuCIPK基因在不同组织中的表达分析显示:按照表达特征聚类分析,GuCIPK成员可分为4个组(图6)。Ⅰ 组中GuCIPK基因家族成员在根中表达较低,在茎和叶中也有少量表达;Ⅱ 组中除GuCIPK8外的其他GuCIPK成员在根中表达较高;Ⅲ组中GuCIPK1、GuCIPK18和GuCIPK19这3个成员在根中表达较高,GuCIPK5和GuCIPK17在叶片组织中的表达最高;Ⅳ组中的GuCIPK家族成员在根、茎、叶中均有表达,但总体表达水平不高。这些结果表明GuCIPK成员可能在不同组织的发育过程中发挥着不同的作用。

图6 乌拉尔甘草GuCIPK的组织特异性表达分析
2.5 GuCIPK响应逆境胁迫的表达分析
为研究GuCIPK在不同逆境胁迫中的潜在功能,利用NaCl、PEG6000、H2O2,4 ℃和42 ℃分别对甘草进行胁迫处理,并利用qRT-PCR分析GuCIPK的表达特征。结果显示:在逆境胁迫处理下,不同GuCIPK成员表现出不同的表达特征,按照表达特征分类可分为4组,暗示它们在响应胁迫中可能具有不同的功能(图7)。在300 mmol/L NaCl处理下,Ⅰ组和Ⅱ组的GuCIPK成员在处理6 h表达量最高,Ⅲ组中各GuCIPK成员在处理24 h表达量最高,Ⅳ组GuCIPK成员分别在处理6 h和12 h均有较高表达。H2O2胁迫处理结果显示,Ⅰ组的GuCIPK成员在处理6 h时表达量达到最高,Ⅱ组GuCIPK成员分别在处理6 h和12 h均有较高表达,Ⅲ组成员在处理6~24 h过程中均持续高表达,Ⅳ组GuCIPK成员受胁迫处理后其表达量都受同等程度的下调。经15% PEG6000处理后,Ⅰ组的GuCIPK成员在处理6~24 h过程中均受到显著上调表达,Ⅱ组、Ⅲ组、Ⅳ组这3组中的GuCIPK成员仅在处理的某个时间点具有较高表达。经4 ℃冷胁迫处理后,Ⅲ组成员在处理6 h和24 h具有较高表达,Ⅳ组成员在处理6 h和12 h表达量较高。42 ℃热胁迫处理后,Ⅳ组的GuCIPK成员在6 h表达量显著升高且达到最高。这些结果暗示GuCIPK可能在不同逆境胁迫响应过程中发挥着不同的重要作用。

图7 GuCIPK基因响应NaCl、PEG、H2O2、冷和热胁迫的表达特征分析
3 讨论
关于CIPK家族功能的研究主要集中在模式植物和主要作物上,如拟南芥、水稻、大豆、番茄、杨树等[22-24]。CIPK蛋白包括N-末端催化激酶结构域和C-末端调节结构域,N-末端催化激酶域有一个ATP结合位点和一个活化环,C-末端调控域包含一个Asn-Ala-Phe(NAF)基序和PPI基序。NAF基序通过PPI基序介导CIPK和CBL之间的结合作用,以及CIPK和2C型蛋白磷酸盐(PP2C)之间的相互作用[25-26]。研究鉴定到乌拉尔甘草基因组中有22个CIPK基因(图1)。所有的GuCIPK在N端序列中含有一个激活域,在C端序列中含有一个NAF域(图4),这两个保守结构域可能与GuCIPK功能的发挥至关重要。
基因结构如内含子、外显子分布和内含子类型等是一些基因家族进化的典型标志[11]。拟南芥、水稻、玉米、杨树和大豆的同一亚组CIPK基因的结构都具有一定程度的相似性[23-24,27]。研究中同组GuCIPK的基因结构具有较高的一致性,且Ⅰ~Ⅳ组成员与Ⅴ组成员相比内含子较少或缺失(图3),表明内含子的增加和缺失事件在CIPK家族的进化过程中可能发挥着重要作用。
CIPK基因在调节植物生长发育和适应环境胁迫方面发挥着关键作用[28]。研究发现AtCIPK3参与植物调节ABA和冷信号转导等过程。非生物胁迫(低温、干旱、高盐、氧化、糖、强碱和低钾等)可诱导多个拟南芥AtCIPK基因显著上调表达[29]。在水稻和玉米等其他物种中也发现,CIPK基因能够响应低温、高温、干旱和高盐等胁迫的应答[16, 27]。研究表明,CIPK的过表达可以显著增强植物的抗逆性,这种抗逆性的获得与Na+的转运调控、脯氨酸和糖等生理代谢物质累积紧密相关[28]。CIPK可与CBL之间形成CBL-CIPK复合物,受膜上Na+信号及其调控的细胞质内Ca+浓度变化的影响,进而参与植物对非生物胁迫的响应[12-13]。GuCIPK受到不同非生物胁迫的诱导表达(图7),暗示GuCIPK的表达与离子转运平衡和细胞内代谢物产生之间的密切联系。另外,激素在植物响应非生物胁迫过程中也发挥重要作用;ABA在非生物胁迫下可以显著累积[30];而拟南芥CIPK3受ABA信号调控参与盐胁迫应答[31];CIPK与CBL形成复合体能够调节植物对干旱胁迫的响应,并与ABA调控的气孔变化和K+平衡紧密相关[32]。GuCIPK基因的启动子区含有ABA等多个激素响应元件(图5),表明GuCIPK的表达可能受植物激素调控并进一步参与非生物胁迫响应。GuCIPK基因在植物生长发育及响应逆境胁迫中可能的功能调控机制需要进一步深入研究和验证。
4 结论
从乌拉尔甘草基因组中共鉴定获得22个GuCIPK基因成员,它们具有典型的植物CIPK的特性,并在不同组织中具有不同的表达特征;GuCIPK启动子中含有多个响应逆境胁迫的顺式作用元件,GuCIPK成员受到不同逆境胁迫的显著诱导表达。

