肿瘤标志物TAP、CEA、CA19-9检测在食管癌诊断中的应用价值
张 喆,汪 阔
空军军医大学第二附属医院唐都医院检验科,陕西西安 710038
食管癌是临床常见的消化道恶性肿瘤之一,病死率极高,位居第4,发病年龄多大于40岁,男性多于女性,且近年来发病率呈上升趋势,对人类健康构成了严重的威胁[1-2]。临床上,食管癌患者多采用食管镜、内窥镜、组织病理学检查等发现,但有操作复杂、检测时间长、灵敏度低等缺点,给临床诊疗工作和患者造成诸多不便[3]。血清肿瘤标志物具有简便、经济、易行、创伤小等特点,成为辅助诊断肿瘤的主要手段[4-5]。因此,寻找灵敏度高、特异性好的肿瘤标志物成为近年来食管癌研究的热点。本文主要探讨异常糖链糖蛋白(TAP)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)3种肿瘤标志物在食管癌诊断中的应用价值。
1 资料与方法
1.1一般资料 选取2020年8月至2021年4月在本院就诊的食管癌患者60例作为食管癌组,均经CT检查或穿刺活检、组织病理学检查确诊为食管癌,其中男50例,女10例,年龄(63.75±6.55)岁。排除标准:(1)哺乳期或妊娠期女性;(2)合并肝、肾、颅脑、心脏等器官病变者;(3)合并食管病变以外的其他脏器炎症、自身免疫性疾病、传染性疾病患者;(4)应用生物素制剂治疗者。另选取同期在本院临床诊断为食管良性肿瘤患者60例作为食管良性肿瘤组,其中男47例,女13例,年龄(62.12±8.43)岁;体检健康者60例作为健康对照组,其中男30例,女30例,年龄(57.46±5.43)岁。食管良性肿瘤组及健康对照组均经体检、影像学检查、胸部X光透视排除其他恶性肿瘤。本研究符合医学伦理学规定。3组年龄、性别等一般资料比较,差异均无统计学意义(P>0.05)。
1.2仪器与试剂 TAP检测使用浙江瑞生TAP集成阅片仪、肿瘤异常蛋白检测系统图像分析仪或生物显微镜,试剂为异常糖链糖蛋白检测试剂盒(凝集法),由凝聚素分散蓝CR-E、蒸馏水、氢氧化钠组成,购自浙江瑞生医疗科技有限公司;血清CEA、CA19-9检测使用德国罗氏Cobas e 602型全自动电化学发光免疫分析仪,检测试剂为肿瘤抗原定量测定试剂盒,主要组成成分包括M(包被链霉亲和素的磁珠微粒)、R1(生物素化的抗癌胚抗原抗体)、R2(钌标记的抗癌胚抗原抗体),肿瘤抗原定量测定试剂盒、校准品、质控品均购自罗氏诊断产品(上海)有限公司。
1.3方法
1.3.1标本采集 采用乙二胺四乙酸二钾(EDTA-K2)抗凝管及含有分离胶的促凝管采集3组研究对象清晨空腹静脉血,各1管。EDTA-K2抗凝管采血2 mL,用于TAP检测,促凝管采血3~4 mL,3 000 r/min离心10 min后分离血清,用于肿瘤标志物CEA、CA19-9检测。所有标本无溶血、脂血、凝血、黄疸现象,2 h内完成检测。
1.3.2检测方法 TAP检测方法为凝集法。取静脉抗凝全血25 μL,在载玻片上推制薄厚均匀的血片,共2张,静置待干。血片干燥后,在2张血涂片分别均匀垂直滴下摇匀后的TAP检测试剂3滴(每滴约50 μL),形成3个圆形斑点,平放静置1.5~2.0 h。质控品选取前1天任意2例患者标本,偏倚控制在10%以内。TAP的凝聚物面积≥125 μm2为阳性,晶体颗粒呈深褐色浅黄色或浅绿色,为边缘不整的圆形、卵圆形或多边形,中间有屈光性,四周较深呈棕黑色或墨绿色;凝聚物面积≥225 μm2为强阳性,凝聚物面积较大;凝聚物面积<125 μm2为阴性,无上述颗粒检出。血清CEA、CA19-9检测方法为电化学发光法,每天应进行质控或每次定标后进行质控,检测高、中、低3个检测值,各值应在正常参考范围内。血清CEA正常参考范围为0~5 ng/mL,血清CA19-9正常参考范围为0~27 U/mL,高于正常参考范围为阳性。
2 结 果
2.13组TAP的凝聚物面积及CEA、CA19-9水平比较 食管癌组TAP的凝聚物面积及CEA、CA19-9水平高于食管良性肿瘤组和健康对照组,食管良性肿瘤组TAP的凝聚物面积及CEA、CA19-9水平高于对照组,差异均有统计学意义(P<0.05),见表1。

表1 3组TAP的凝聚物面积及CEA、CA19-9水平比较[M(P25,P75)]
2.23组TAP、CEA、CA19-9单独及联合检测的阳性率比较 食管癌组TAP、CEA、CA19-9单独及3项联合检测的阳性率高于食管良性肿瘤组和健康对照组,食管良性肿瘤组高于对照组,差异均有统计学意义(P<0.05),见表2。
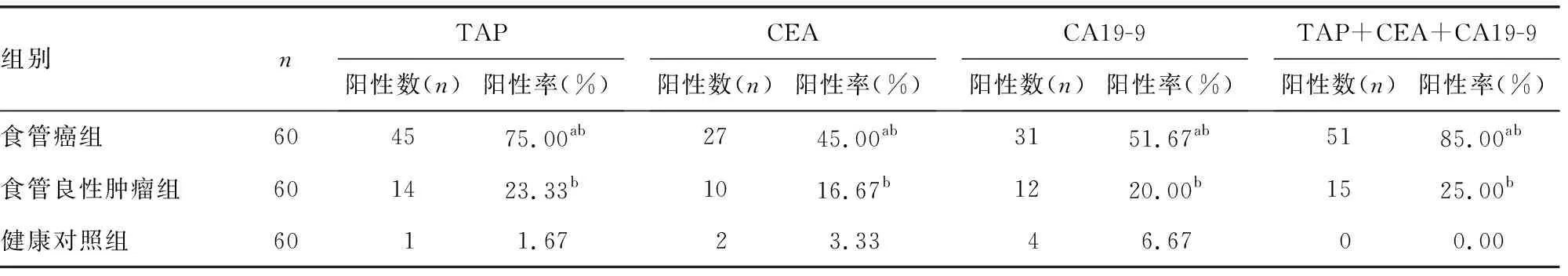
表2 3组TAP、CEA、CA19-9单独及联合检测的阳性率比较(%)
2.33项指标单独及联合检测食管癌的灵敏度、特异度 TAP、CEA、CA19-9 3项联合检测食管癌的灵敏度为85.00%,特异度为75.00%,约登指数高于单项指标检测,见表3。
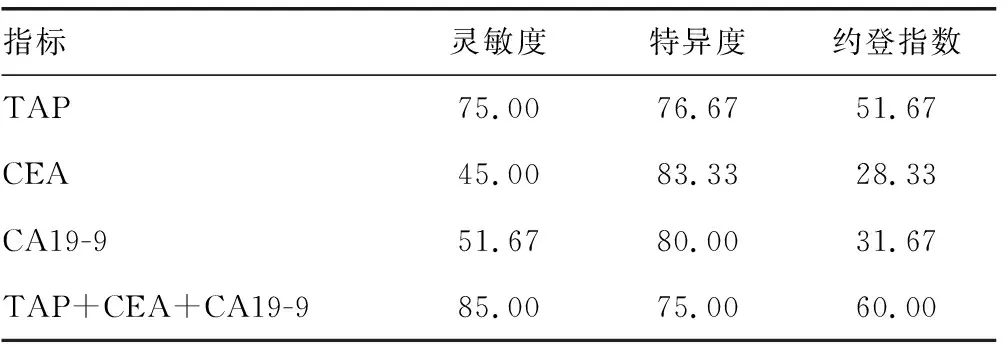
表3 3项指标单独及联合检测食管癌的灵敏度、特异度、约登指数(%)
3 讨 论
2015年国家癌症中心统计发现,我国食管癌的发病人数约为477 900例,发病人数占全部恶性肿瘤的11.1%,死亡人数估计为375 000例,死亡人数占全部恶性肿瘤的13.3%[6]。据调查研究显示,食管癌的高发与多种因素有关,如饮食习惯、肿瘤家族史、经济状况、生活节奏的加快和环境的恶化[7-8]。
TAP又称肿瘤异常蛋白,是肿瘤细胞在新陈代谢过程中释放的糖蛋白和钙-组蛋白复合物[9]。本研究结果显示,食管癌组TAP的阳性率高于对照组,与文献报道一致[10],提示TAP是检测食管癌的一个较好的指标。TAP是细胞中的癌基因、抑癌基因等发生基因突变后所表达的产物,在食管癌发生、发展的过程中分泌增多,到达一定水平后,向血液中排放,并较多地存在于外周血[11]。本研究结果发现,TAP检测食管癌的灵敏度为75.00%,特异度为76.67%,TAP单项检测的灵敏度高于血清CEA、CA19-9单项检测。CEA是一种复杂的可溶性糖蛋白,主要存在于成人肿瘤细胞及胎儿的胃肠道中。在成人消化道肿瘤中,肿瘤细胞会重新表达CEA,并释放入血[12]。有研究显示,CEA是提示食管癌疾病的最早指标,与食管癌的发生、发展密切相关[13]。本研究结果显示,CEA单独检测食管癌的诊断特异度(83.33%)较好,但阳性率(45.00%)较低,漏诊率较高。所以CEA单项检测临床意义不大,通常采用多项指标联合检测。CA19-9是一种黏蛋白型的糖类肿瘤相关抗原。据文献报道,CA19-9可作为食管癌发生的首选标志物,在食管癌中的阳性率为20%~50%,特异度为70%~90%[14]。本研究结果显示,CA19-9的阳性率为51.67%,特异度为80.00%,与文献[14]研究结果一致。
本研究结果显示,TAP、CEA、CA19-9联合检测的灵敏度高于任一单项检测,提示单项检测肿瘤标志物对食管癌的诊断具有一定的局限性,所以临床上应建立有效的多参数、多指标联合检测以提高对食管癌的灵敏度。有文献报道,CEA、CA19-9联合检测食管癌的灵敏度为53.33%,CA19-9、CEA、糖类抗原125(CA125)联合检测灵敏度为41.20%[15-16]。本研究发现,TAP、CEA、CA19-9联合检测的灵敏度达到了85.00%。这是由于TAP运用多级偶联技术,用数十种凝集素,一次性组合检测20多种异常糖链结构[17-18],提高了检测的灵敏度和准确性,所以TAP在食管癌的筛查和检测中起到了很好的辅助作用,在食管癌的发生、发展、转移及预后等方面有一定的临床应用价值。
综上所述,肿瘤标志物TAP、CEA、CA19-9联合检测对食管癌的诊断具有重要的价值,而对于其他消化道肿瘤的诊断有待进一步研究。

