新生期小鼠多次氯胺酮麻醉对远期认知功能的影响及其机制研究*
殷艺娜,马敏,常俊晓,孔玉芳,芮琳琳,褚国强
(1.南京医科大学附属常州妇幼保健院 麻醉科,江苏 常州213003;2.南通大学附属医院麻醉科,江苏 南通226001;3.南京医科大学附属常州妇幼保健院 保健科,江苏 常州213003)
氯胺酮作为N-甲基-D-天冬氨酸受体的非竞争性拮抗剂,因其独特的麻醉特性,被广泛应用于产科和小儿外科的手术麻醉[1]。婴幼儿神经系统发育期是神经系统最脆弱、最容易受到损害的时期,全身麻醉药物是否影响患儿的大脑发育及学习记忆功能一直是临床及科研工作者关注的热点[2]。以往对于氯胺酮致发育期神经毒性的研究主要集中在神经元凋亡、神经炎症等方面[3],对小胶质细胞在其中发挥的作用研究较少。因此,本研究旨在进一步探究氯胺酮致发育期神经毒性作用机制是否与小胶质细胞发育及功能改变有关,以期为氯胺酮致发育期神经毒性作用机制研究提供新思路。
1 材料与方法
1.1 实验动物
成年昆明小鼠置于室温(25±1)℃、湿度20%~30%的动物房中分笼饲养,12 h 昼/夜循环照明,自由摄食、摄水。适应性饲养1周,每天下午4:00~6:00 按照雌雄比例2∶1~3∶1 合笼交配,使母鼠受孕,合笼后第2~6 天上午检查阴道栓子有无脱落。母鼠受孕后阴道口可见乳白色阴道栓,此时记为孕0.5(E0.5)。孕鼠自然分娩即新生小鼠出生当日记为P0,新生小鼠断奶前(出生后21~24 d)母鼠喂养,断奶后普通饲料喂养。实验动物生产许可证号:SCXK(苏)2017-0007,实验动物使用许可证号SYXK(苏)2017-0044。本动物实验经南京医科大学实验动物伦理委员会审批通过。
1.2 实验分组
将出生后6 d(P6)的同窝昆明小鼠按随机数字表法分为对照组和氯胺酮组,每组36只。两组采用腹腔注射给药方式,氯胺酮单次给药剂量为80 mg/kg,对照组每次注射与氯胺酮组等体积的生理盐水。两组每天下午2:00 注射1 次,连续注射5 d。两组动物每次注射完毕后,分别放入单独鼠笼中,各项操作轻柔,密切注意小鼠皮肤颜色变化,防止发生低氧血症,待小鼠翻正反射恢复后放回原来的鼠笼。
1.3 主要试剂与仪器
盐酸氯胺酮注射液(福建古田药业有限公司),0.9%氯化钠注射液(石家庄四药有限公司),羊Iba1多克隆抗体(美国Abcam 公司),Alexa Flour 546 驴抗山羊IgG(美国Invitrogen 公司),兔CX3CR1 单克隆抗体(美国Abcam 公司),鼠β-actin 多克隆抗体(美国Santa Cruz 公司)。Morris 水迷宫(上海吉量软件科技公司),ChemiDocTM XRS + 凝胶成像仪(美国Bio-Rad 公司),冷冻切片机(德国Leica 公司),显微照相系统(日本Olympus公司)。
1.4 方法
1.4.1 水迷宫测试 两组小鼠给药1 个月和2 个月后分别取20 只行Morris 水迷宫实验。实验在直径100 cm、水深40 cm 的圆形水池中进行,水温维持在(20±1)℃。将直径6 cm 的圆形平台放入目标象限,并隐匿于水面下1 cm 处。实验前1 d,将小鼠放入迷宫水池中自由游行1 min,使其适应水池及周围环境。前期训练共持续5 d,自第1 天起,每天下午2:00 开始训练,将小鼠头朝向水池壁,从第一象限开始,依次从4 个象限的入水点放入水中,记录小鼠入水至爬上平台所需时间,即逃避潜伏期;若小鼠60 s 未爬上平台统一按照60 s 计算,并由实验者将其引导上平台并停留15 s,反映被测小鼠的学习能力。第6 天进行定向航行实验,将小鼠于平台对侧象限入水点放入水中,记录小鼠入水到爬上平台所需时间;若小鼠60 s 内未爬上平台则统一按照60 s 计算。然后撤去平台,将小鼠于平台对侧象限入水点放入水中,记录小鼠在60 s内搜索平台的路线图、目的象限停留时间及穿台次数,反映小鼠学会寻找平台后,对平台的空间位置记忆能力。
1.4.2 免疫荧光染色 选取P11、P16、P21、P35、P67 小鼠各8 只,腹腔注射水合氯醛350 mg/kg 麻醉,固定四肢,开胸暴露心脏,由左心室心尖部插入头皮针至升主动脉,剪开右心耳,快速灌注肝素、生理盐水,直至肝脏变白,右心耳流出的液体透明,再以4%多聚甲醛灌注,直至下肢、鼠尾变硬,随即断头、取脑。将全部脑组织置于4℃、4%多聚甲醛固定24 h 后取出,置于30%蔗糖脱水,直至组织沉底。用滤纸吸干脑组织表面水分,放入包埋剂内,置于-20℃冷冻切片机中速冻60 min,调整切片厚度为40 μm,采取冠状位连续切片,以海马前联合为标记点,采用Iba1 对小鼠海马齿状回小胶质细胞进行标记。顺序选取其后第6~15 张含海马区切片,置于0.01 mol/L PBS 液内备用。将脑组织切片用0.01 mol/L PBS 摇床洗涤3 次,5 min/次;3%BSA 常温封闭1 h。一抗孵育:羊源DCX(1∶200,0.4 % PBST 稀释)4℃摇床孵育24 h;0.01 mol/L PBS摇床洗涤3 次,5 min/次;二抗孵育:Alexa Flour 546 标记的驴抗山羊IgG(1∶200,0.4%PBST 稀释)室温避光孵育2 h;0.01 mol/L PBS 摇床洗涤3 次,5 min/次,进行贴片并晾干切片,全程避光;每张载玻片上均匀滴入DAPI 染液100 μl,染色10 min后PBS 冲洗并晾干,全程避光;防淬灭封片剂封片,置于FV1000 激光共聚焦显微镜下,用Olympus Fluoview Ver.4.2a 软件观察和拍片,在Image-Pro Plus 软件下手动计数细胞,计算每个20 倍物镜视野下(620 μm×620 μm)海马齿状回区域Iba1 阳性细胞数,并计算每平方毫米Iba1 阳性细胞数。计数过程中采用盲法,图像分析软件的分析参数一致。
1.4.3 Western blotting检测CX3CR1蛋白 小胶质细胞发育、成熟过程中受许多因素影响,CX3CR1是小胶质细胞发育、成熟过程中的“特征”因子[4-5]。选取P11、P16、P21、P35、P67 小鼠各8只,直接断头后置于冰上取脑,迅速分离出双侧海马组织,分别取RIPA 蛋白裂解液和100 mmol/L PMSF蛋白酶抑制剂,按照100∶1 比例混合。称取组织重量,按照每100 mg 组织加入100 μl 蛋白裂解液的比例加入适量裂解液,在冰上进行组织匀浆。4℃、12 000 r/min 离心15 min,取上清液。BCA 法测定样本蛋白浓度后,各组用裂解液配平。加入5×上样缓冲液,沸水变性5 min。各组取等量样本蛋白在12% SDS-PAGE 凝胶系统上样,先恒压80 V至溴酚蓝跑到浓缩胶与分离胶分界处,再恒压120 V使溴酚蓝跑至底部。跑完电泳后,进行半干转,转膜结束后,摇床上温和振荡,3% BSA 常温封闭2 h,加入一抗4 ℃孵育过夜。复温后Washing Buffer 洗涤3 次,5 min/次,加入辣根过氧化物酶标记二抗,摇床上温和振荡,常温孵育2 h。Washing Buffer 洗涤3 次,5 min/次。膜上滴适量ECL 发光液,将膜放入凝胶成像仪,采用化学发光法检测并采集图像。用Image J 图像分析软件对所得条带进行光密度扫描,各组CX3CR1 蛋白条带光密度值与内参蛋白光密度值的比值为CX3CR1 蛋白相对表达量。
1.5 统计学方法
数据分析采用SPSS 16.0 和Graph Pad Prism 6 统计软件。计量资料以均数±标准差(±s)表示,用t检验或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组学龄期小鼠水迷宫行为学变化
氯胺酮组与对照组学龄期小鼠训练前第1 天、第2 天、第3 天、第4 天、第5 天逃避潜伏期比较,采用重复测量设计的方差分析,结果:①不同时间点学龄期小鼠逃避潜伏期有差异(F=34.213,P=0.000)。②氯胺酮组与对照组学龄期小鼠逃避潜伏期有差异(F=19.856,P=0.000);氯胺酮组与对照组相比逃避潜伏期较长(P<0.05),多次氯胺酮麻醉可能导致学龄期小鼠学习记忆功能障碍。③两组学龄期小鼠逃避潜伏期变化趋势有差异(F=12.436,P=0.000)。见表1。
表1 两组学龄期小鼠不同时间点的逃避潜伏期变化(n=20,s,±s)
组别对照组氯胺酮组t 值P 值第1天41.7±7.8 43.9±5.4 1.037 0.304第2天33.4±10.3 39.9±7.7 2.260 0.030第3天29.5±8.8 38.2±7.4 3.384 0.002第4天24.5±8.8 33.2±7.4 3.384 0.002第5天20.7±7.4 30.7±10.1 3.572 0.001
在第6 天的空间探索实验中,氯胺酮组与对照组学龄期小鼠60 s 内穿台次数、目的象限活动时间占比比较,经t检验,差异有统计学意义(P<0.05),对照组高于氯胺酮组。见表2。
表2 两组学龄期小鼠60 s内穿台次数和目的象限活动时间比较 (n=20,±s)
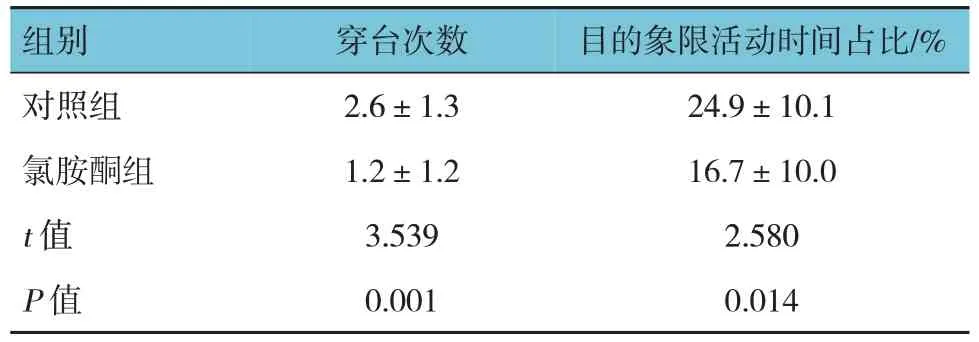
表2 两组学龄期小鼠60 s内穿台次数和目的象限活动时间比较 (n=20,±s)
?
2.2 两组成年小鼠水迷宫行为学变化
氯胺酮组与对照组成年小鼠训练前第1 天、第2 天、第3 天、第4 天、第5 天逃避潜伏期比较,采用重复测量设计的方差分析,结果:①不同时间点成年小鼠逃避潜伏期有差异(F=41.527,P=0.000)。②氯胺酮组与对照组成年小鼠逃避潜伏期有差异(F=21.365,P=0.000);氯胺酮组与对照组相比逃避潜伏期较长(P<0.05),多次氯胺酮麻醉可能导致学习记忆功能障碍。③两组成年小鼠逃避潜伏期变化趋势有差异(F=17.548,P=0.000)。见表3。
表3 两组成年小鼠不同时间点的逃避潜伏期变化 (n=20,s,±s)

表3 两组成年小鼠不同时间点的逃避潜伏期变化 (n=20,s,±s)
组别对照组氯胺酮组t 值P 值第1天43.1±7.1 45.2±9.3 0.803 0.440第2天34.6±10.1 38.9±10.1 1.346 0.190第3天26.5±10.0 34.4±6.9 2.908 0.006第4天24.8±6.4 33.4±9.1 3.457 0.001第5天18.6±7.0 30.4±12.5 3.683 0.001
在第6 天的空间探索实验中,氯胺酮组与对照组成年小鼠60 s 内穿台次数、目的象限活动时间占比比较,经t检验,差异有统计学意义(P<0.05),对照组高于氯胺酮组。见表4。
表4 两组成年小鼠60 s内穿台次数和目的象限活动时间占比比较 (n=20,±s)
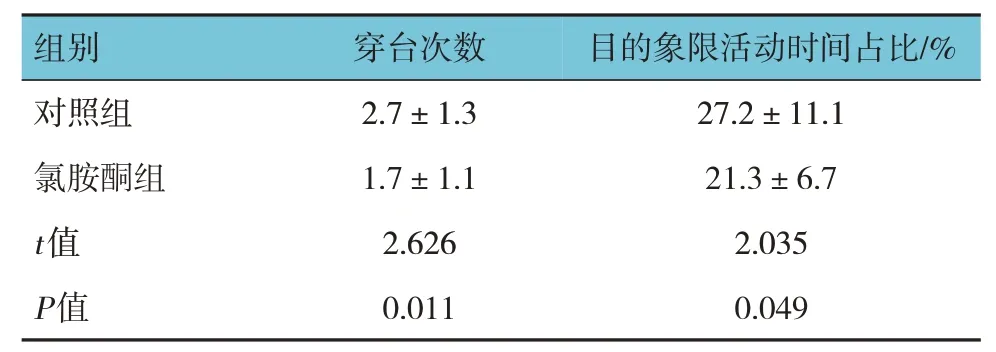
表4 两组成年小鼠60 s内穿台次数和目的象限活动时间占比比较 (n=20,±s)
组别对照组氯胺酮组t值P值穿台次数2.7±1.3 1.7±1.1 2.626 0.011目的象限活动时间占比/%27.2±11.1 21.3±6.7 2.035 0.049
2.3 两组小鼠海马齿状回小胶质细胞数变化
氯胺酮组与对照组P11、P16、P21、P35、P67小鼠海马齿状回小胶质细胞数比较,经t检验,差异有统计学意义(P<0.05),对照组均多于氯胺酮组。见表5 和图1。

图1 两组不同阶段小鼠海马齿状回小胶质细胞 (免疫荧光染色×20)
表5 两组不同阶段小鼠海马齿状回小胶质细胞数比较 (n=8,个/mm2,±s)
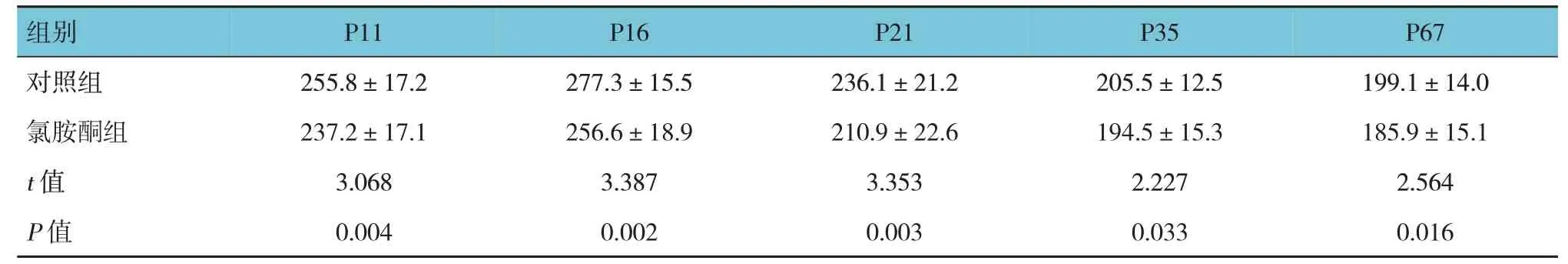
表5 两组不同阶段小鼠海马齿状回小胶质细胞数比较 (n=8,个/mm2,±s)
组别对照组氯胺酮组t 值P 值P11 255.8±17.2 237.2±17.1 3.068 0.004 P16 277.3±15.5 256.6±18.9 3.387 0.002 P21 236.1±21.2 210.9±22.6 3.353 0.003 P35 205.5±12.5 194.5±15.3 2.227 0.033 P67 199.1±14.0 185.9±15.1 2.564 0.016
2.4 两组小鼠双侧海马组织CX3CR1蛋白相对表达量变化
氯胺酮组与对照组P11、P16、P21、P35、P67小鼠双侧海马组织CX3CR1 蛋白相对表达量比较,经t检验,差异有统计学意义(P<0.05),对照组高于氯胺酮组。见表6 和图2。
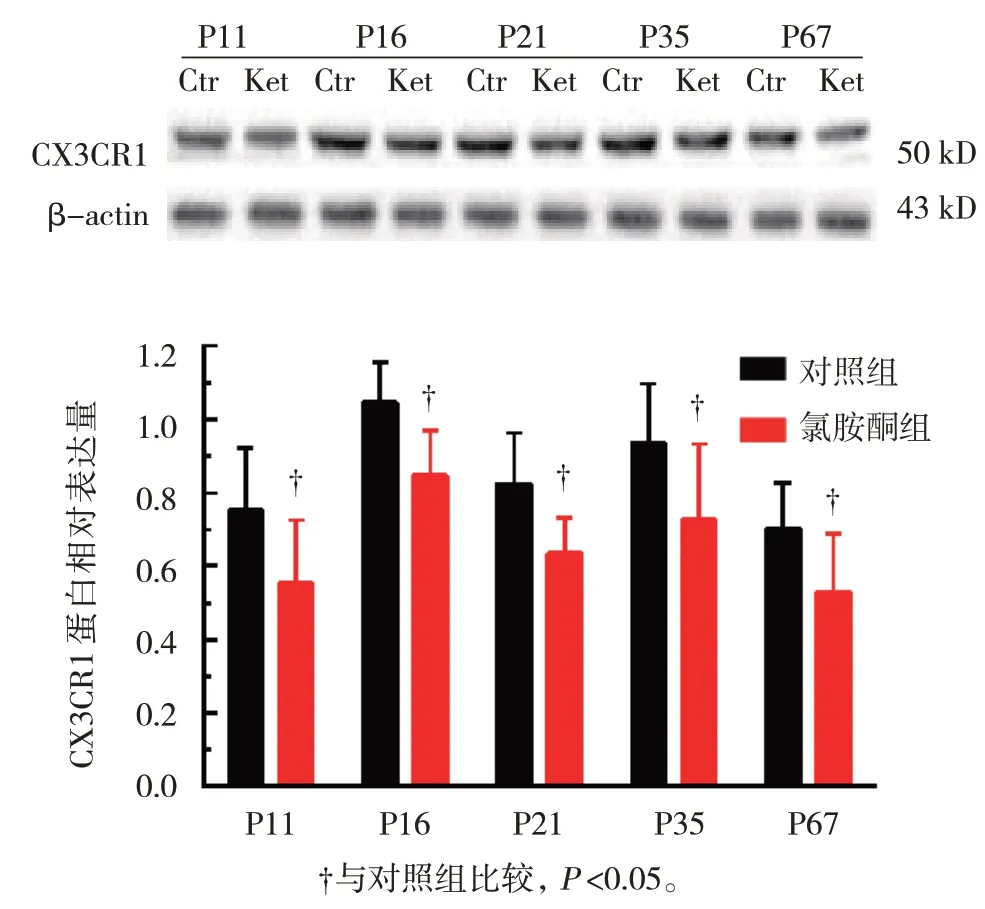
图2 两组不同阶段小鼠双侧海马组织CX3CR1蛋白相对表达量变化 (n=8,±s)
表6 两组不同阶段小鼠双侧海马组织CX3CR1蛋白相对表达量比较 (n=8,±s)
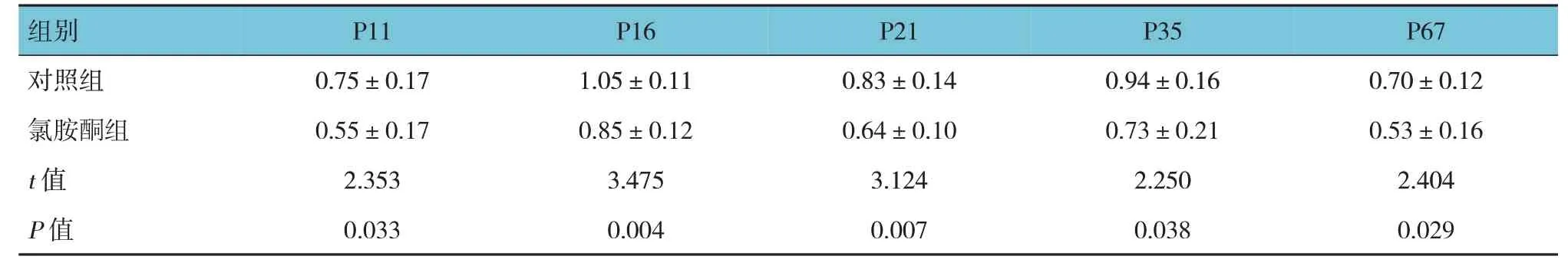
表6 两组不同阶段小鼠双侧海马组织CX3CR1蛋白相对表达量比较 (n=8,±s)
组别对照组氯胺酮组t 值P 值P11 0.75±0.17 0.55±0.17 2.353 0.033 P16 1.05±0.11 0.85±0.12 3.475 0.004 P21 0.83±0.14 0.64±0.10 3.124 0.007 P35 0.94±0.16 0.73±0.21 2.250 0.038 P67 0.70±0.12 0.53±0.16 2.404 0.029
3 讨论
婴幼儿阶段是神经系统发育的高峰期和敏感期,与成人相比更易受到麻醉药物的损害[6]。啮齿类动物与灵长类动物的研究表明,氯胺酮的大剂量使用或者持续暴露可以诱导发育期大脑神经细胞变性和凋亡,导致认知功能障碍[7-8]。因此,有人认为氯胺酮只有在作用时间足够长,浓度足够大时才会引起神经元结构和认知功能损害[7]。
有研究显示,小鼠氯胺酮产生麻醉状态的半数有效量是80 mg/kg[9-10],据此笔者进行了预实验,最终确定氯胺酮腹腔注射麻醉剂量为80 mg/kg。婴幼儿神经系统发育期是神经系统最脆弱、最容易受到损害的时期,故本研究中氯胺酮的给药时段设在大脑发育高峰期及小胶质细胞增殖、发育高峰时期,约出生后2 周左右[11]。前期预实验选择出生后6 d 小鼠腹腔注射氯胺酮80 mg/(kg·d)或同等体积生理盐水,并分设连续给药1 次、3 次和5 次实验组,以确定腹腔注射氯胺酮80 mg/(kg·d)剂量下,给药次数对小鼠远期认知功能的影响。选取出生后6 d 小鼠1 次或连续3 次给药,1 个月后Morris 水迷宫实验检测两组小鼠逃避潜伏期、穿台次数、目的象限活动时间占比等无差异,说明新生期小鼠氯胺酮1 次或连续3 次暴露不足以造成长期空间学习记忆功能改变。由此本研究最终确定采用新生期小鼠连续5 次氯胺酮麻醉这一实验剂量。
小胶质细胞是中枢神经系统中重要的免疫效应细胞,对于维持大脑内环境稳定发挥了不可替代的作用[12],如参与调节神经系统发育、促进神经环路形成、影响神经元活动、清除病原体及吞噬凋亡的神经元[13]等。关于全身麻醉药物对小胶质细胞数量、形态及功能的影响目前还没有明确结论。有研究显示,中枢神经系统损伤后,脑组织内炎症因子明显增加,小胶质细胞持续活化,促使小胶质细胞吞噬增加,加快了突触退化和过度萎缩,导致小鼠认知障碍[14]。有趣的是,景胜等[15]的研究表明,出生后7 d 小鼠腹腔注射丙泊酚后海马齿状回小胶质细胞数减少并且抑制了小胶质细胞活化,这与SHEN 等[16]的结果相反。笔者猜测这些研究结果相反可能与药物、剂量、实验模型不同有关。本研究结果显示,新生期小鼠5 次氯胺酮麻醉后,P11、P16、P21、P35、P67 小鼠海马齿状回Iba1 阳性标记的小胶质细胞数明显减少,推测氯胺酮神经毒性可能抑制了小胶质细胞增殖。
CX3CR1 是趋化因子CX3CL1 的受体,在脑内的特异性由小胶质细胞表达[4-5]。CX3CR1 不仅影响发育期小胶质细胞的分化成熟,对小胶质细胞的形态及功能的维持也具有重要作用[17]。此外,CX3CL1/CX3CR1 也是神经元与小胶质细胞之间重要的信号传导通路,参与调节机体许多生理过程,包括维持神经元存活、突触连接的成熟、突触传递及可塑性调节等[18-19]。有研究表明,成年小鼠敲除CX3CR1基因后,海马区小胶质细胞数量减少,突触修剪被推迟,这种突触修剪作用的缺陷会造成树突棘增多,认知功能受损,提示小胶质细胞减少可能通过CX3CL1/CX3CR1 信号通路导致突触发育异常及认知功能障碍[20]。本研究发现,P6 小鼠多次氯胺酮麻醉后海马齿状回区域Iba1 标记的小胶质细胞数减少,且海马区CX3CR1 蛋白相对表达量减少。笔者推测小胶质细胞发育抑制,导致CX3CR1 蛋白相对表达量减少,相关信号通路异常,最终影响认知功能。
综上所述,新生期小鼠多次氯胺酮麻醉致其学龄期及成年后认知功能障碍,海马齿状回小胶质细胞和海马区CX3CR1 蛋白相对表达量减少对其有促进作用。这为下一步麻醉药的神经毒性研究提供了新方向,也为麻醉药物在发育期的安全应用提供一些指导。

