雄激素对良性前列腺增生患者基质细胞炎症反应的影响
任 超 易发现 黄 勇 朱小军 李建宏
内蒙古医科大学附属医院泌尿外科,内蒙古呼和浩特 010050
良性前列腺增生(benign prostatic hyperplasia,BPH)是中老年男性发病率最高的慢性疾病之一,通常伴有组织学炎症,使前列腺结构变化和症状发生[1]。无临床表现的组织学慢性炎症使前列腺组织不断破坏和再生,造成前列腺结节增生性增大,同时引起前列腺基质重塑,可增加排尿阻力,致病情由无症状BPH 变为有症状BPH[2]。临床上常表现为尿频、尿急、尿无力等。这种炎症不但导致下尿路症状(lower urinary tract symptoms,LUTs),还可升高前列腺特异性抗原(prostate specific antigen,PSA)[3-4]。本研究拟通过体外培养人前列腺原代间质细胞,通过肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)刺激,检测基质细胞炎症反应情况,再加入双氢睾酮(dihydrotestosterone,DHT),再检测炎症反应,探索双氢睾酮对前列腺间质细胞的炎症影响作用。
1 资料与方法
1.1 一般资料
收集2016 年1 月至2017 年5 月就诊于内蒙古医科大学附属医院泌尿外科20 例行经尿道前列腺电切术(transurethral resection prostate,TURP)患者资料。患者平均年龄(65.2±8.2)岁。本研究通过医院医学伦理委员会审批,注册号为2017(008)。
纳入标准:因前列腺增生拟行TURP 术。排除标准:前列腺恶性肿瘤、膀胱恶性肿瘤及泌尿系感染;前列腺组织经病理诊断伴有炎症;术前3 个月有抑雄或抗炎等药物治疗[5-6]。
1.2 组织块法体外培养人前列腺基质细胞
取行TURP 患者移行区组织,剪碎至1 mm3,以间距5 mm 进行接种。细胞培养液采用高糖DMEM(Hyclone,USA)+10%FBS(Gibco,USA)+1%链霉素完全培养基[5,7]。
1.3 观察指标
相差显微镜(Olympus,Japan)观察细胞生长状况和形态。第3 代前列腺基质细胞通过免疫组织细胞化学染色法进行鉴定。传代后生长占80%~90%时进行染色[7]。
1.4 实验分组、留取上清液
将第3 代前列腺间质细胞分别传代于75 mm 培养皿,依次命名为空白组、对照组、实验组,加入相同浓度、剂量的培养液培养2 d 后,空白组行细胞换液,对照组和实验组分别加入TNF-α(Peprotech,USA)10 ng/ml,5 h 后在实验组加入DHT(MCE,USA)30 nmol/L,再共同培养24 h 后分别取三个组的上清液各100 μl,每组4 个复孔[8]。
1.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测各细胞因子浓度水平
提前取出试剂盒(欣博盛,深圳,Lot.H3071-6C),平衡至室温;空白孔加入通用稀释液,其他孔中加入各组所取上清液(100 μl/孔);经5 次洗板,空白孔加入抗体稀释液,其余孔加工作液;再经酶结合物稀释液和5 次洗板后加入显色底物、终止液,即刻分别测量三组白细胞介素(interleukin,IL)-6、IL-8、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)细胞因子浓度水平。
1.6 统计学方法
采用SPSS 13.0 统计软件进行数据处理。计量资料采用均数±标准差()表示,组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 显微镜观察前列腺基质细胞
培养5~6 d 后组织块边缘可观察到少量细胞开始爬出,第1 代细胞大多为形态多样的上皮细胞和长纤维状的基质细胞;第2 代细胞经胰酶等作用大部分为前列腺基质细胞;第3 代细胞为梭形或长纤维状的间质细胞。
2.2 免疫组织化学法鉴定细胞
波形蛋白、α-平滑肌肌动蛋白有棕黄色颗粒沉淀着色;角蛋白、结蛋白未见棕黄色颗粒沉淀着色。见图1。
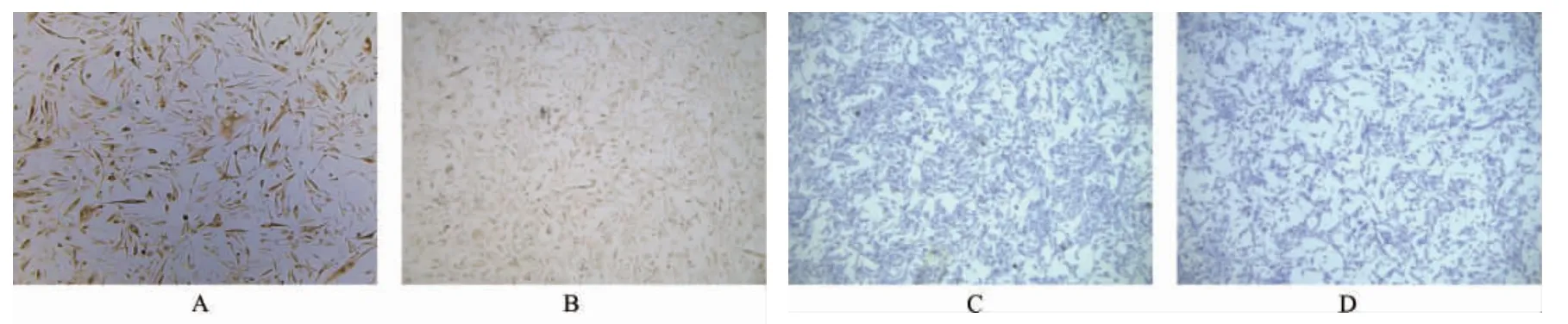
图1 免疫组化法鉴定的第3 代前列腺间质细胞(200×)
2.3 三组细胞因子的浓度比较
对照组IL-6、IL-8、MCP-1、bFGF 浓度高于空白组,差异均有统计学意义(P <0.05)。实验组IL-6、IL-8、MCP-1、bFGF 浓度低于对照组,差异均有统计学意义(P <0.05)。见表1。
表1 三组IL-6、IL-8、MCP-1、bFGF 浓度比较()

表1 三组IL-6、IL-8、MCP-1、bFGF 浓度比较()
注 与空白组比较,aP <0.05;与对照组比较,bP <0.05。IL:白细胞介素;MCP-1:单核细胞趋化蛋白-1;bFGF:碱性成纤维细胞生长因子
3 讨论
中老年男性良性BPH 患者多数同时合并有组织学炎症,造成潜在隐患。Zlotta 等[9]尸检发现,超过70%前列腺组织中存在慢性炎症。前列腺组织学炎症不仅促进前列腺炎症的发展,导致LUTs 的发生、PSA 的升高[10],还促使BPH 发展为前列腺癌[11]。因而,雄激素对前列腺组织学炎症的早期干预治疗,不仅可减少或缓解下尿路症状,而且对减少前列腺癌的发生具有重要意义。
研究显示,炎症增加与睾酮缺乏有关[12]。高脂饮食引起的睾酮缺乏导致前列腺炎症,可以通过补充睾酮来逆转[13]。158 例接受TURP 治疗的BPH 患者雄激素水平与LUTs 的关系研究显示,总IPSS 与总睾酮水平呈负相关(r=-0.21,P=0.01),雄激素的补充可缓解LUTs 症状[14-15]。为了探究DHT 是否具有抗炎作用,本研究通过体外培养人前列腺间质原代细胞,使用DHT 激活雄激素受体(androgen receptor,AR)的试验,结果显示:实验组的炎症不同程度下降,提示雄激素直接发挥抗炎作用,这种抗炎作用也降低了相关炎性细胞因子浓度水平,在细胞因子层面表面其抗炎作用。所以在维持前列腺内环境的稳态中DHT 和基质细胞AR 受体有着重要作用[16-18]。这与小鼠敲除AR 受体基因,造成前列腺增生和组织学炎症的研究相一致[19-20]。
前列腺内环境的稳态受恒定浓度的促炎细胞因子调控,浓度升高则造成炎症[21]。而恰恰在本研究中的细胞因子层面证实:雄激素使促炎细胞因子IL-6、IL-8、MCP-1、bFGF 浓度水平不同程度下降。Saad 等[22]研究发现,迟发型性腺功能减退患者较无迟发型性腺功能减退的前列腺炎症状重,这可能与雄激素缺乏有关。另有研究显示,DHT 替代治疗戒断后,间质细胞中促炎因子浓度升高,补充雄激素后其浓度水平则又下降[23-24]。
本研究证实雄激素能抑制老年男性BPH 患者前列腺基质细胞的炎症反应。需进一步的研究来探索DHT 抑制基质细胞炎症反应的准确机制,以便更好地临床治疗。

