实体器官移植受者新型冠状病毒疫苗接种临床研究进展
郑宜翔,李春辉,黄 燕
(中南大学湘雅医院 1. 感染病科; 2. 医院感染控制中心,湖南 长沙 410008)
疫苗接种是预防新型冠状病毒(SARS-CoV-2)感染和新型冠状病毒肺炎(COVID -19)的重要措施,截至2021年9月26日,全球累计接种新型冠状病毒疫苗(简称新冠疫苗)58.7亿剂次,我国也超过21.9亿剂次[1]。大量临床研究已证实,接种新冠疫苗可有效降低SARS-CoV-2感染率,以及感染后的重症化率。移植患者,包括实体器官移植(SOT)和骨髓移植(HSCT)是感染SARS-CoV-2的高风险人群,且感染后重症化率和病死率均高于普通人群[2],此类患者应该优先接种新冠疫苗。然而,免疫缺陷患者,特别是SOT或HSCT受者被排除在III期试验之外。在此类人群中,关于新冠疫苗的有效性和预防效果数据非常有限,本文对SOT受者接种新冠疫苗的相关临床研究或病例报道进行综述,并对该人群的疫苗接种提出建议。
1 移植患者感染SARS-CoV-2的临床预后
由于长期的免疫抑制治疗和其他医学合并症,SOT受者可能处于COVID -19的不良预后高风险。一项Meta分析结果提示, SOT受者COVID -19全病死率为18.6%,另据其他文献综述报道病死率也在13%~30%[3]。在疫情暴发初期,处于疫情中心的欧洲国家如意大利、西班牙和法国等国的研究报道,肾移植患者COVID -19病死率高达19%~50%[4]。美国36例肾移植患者感染SARS-CoV-2后的病死率为28%,高于普通人群的1%~5%和70岁以上老人的8%~15%[5]。来自TANGO(post-transplant glomerular diseases) 国际联盟的12家医学中心报道144例肾移植受者,呼吸衰竭插管率为29%, 病死率为32%[6]。法国一项全国登记显示,279例肾移植受者,87%的患者需住院治疗,36%需入住ICU,30天的病死率为23%[7]。来自西班牙的多中心临床研究结果显示,104例肾移植受者,47例(54.8%)发生急性呼吸窘迫综合征(ARDS),28例(27%)死亡[8]。华盛顿大学注册中心的研究显示,318例肾或肾-胰腺移植接受者,73例肝移植受者、57例心脏移植和30例肺移植受者罹患COVID -19后总体病死率为18.7%,其中住院患者病死率为20.5%[9]。目前报道的肝、心脏或肺移植后罹患COVID -19的患者较少,Webb等[10]报道来自18个国家151例肝移植受者COVID -19患病预后情况,28%的患者需入住ICU治疗,病死率为19%。来自美国、西班牙等欧洲国家的小样本病例报道肝移植患者的病死率一般低于肾移植患者,为12%~19%[11-12]。而心脏移植受者COVID -19的病死率可达25%~33.3%,高于肾移植和肝移植[13-14]。最近,一项Meta纳入15篇文献265 839例参与者,包括1 485例SOT受者,结果显示,COVID -19患者中SOT受者,有着更高的入住ICU的风险(OR=1.57)和病死率(OR=1.4)。调整后的结果汇总分析显示,SOT状态使COVID -19的死亡风险增加1.54倍[15]。
相较于普通人群,SOT受者罹患COVID -19有着更高重症化率和病死率。但重症化的原因是由于免疫抑制剂的使用还是其他合并症因素,有待更多的研究明确。近期美国西弗吉尼亚州的一项多中心联合研究,纳入2 307例SOT患者与23 1047例非移植患者,采用倾向-匹配队列比较2 289对患者COVID -19的临床结局,结果显示,与非移植组相比,移植患者的年龄更大,身体质量指数(BMI)高,更多患者伴有高血压、糖尿病、尼古丁依赖、心力衰竭和缺血性心脏病。30天和60天的病死率,机械通气和急性肾损伤的比例SOT患者均高于非SOT患者。对上述混杂因素和性别进行匹配后发现,无论是在30天还是在60天的观察时间点上,两组患者插管或机械通气的综合结局(RR分别为1.04、1.03),以及病死率的主要结局方面差异均无统计学意义。与非移植组相比,SOT组住院率更高(30.97% VS 25.47%;RR1.22),发生急性肾损伤的患者更多(24.73% VS 14.29%;RR1.73)。研究认为,虽然SOT受者COVID -19相关病死率高,但这种增加的风险是于由于SOT受者有更高的共病负担导致。SOT状态独立地增加住院和急性肾损伤的风险[16]。另一项来自美国纽约州的病例对照研究,结果有所不同。研究纳入多种SOT受者82例(包括肾、肝、心脏、胰腺和肺移植)和1 625例对照病例,结果显示,SOT受者患COVID -19后,与对照组相比,有着更高的有创通气风险(34.2% VS 24.6%)、肾替代治疗需求(18.3% VS 8.5%)和病死率(31.7% VS 24.1%),多因素分析结果显示高龄、男性、BMI≥30、糖尿病、心力衰竭、慢性阻塞性肺疾病(COPD)、西班牙裔、入院时肾小球滤过率(GFR)<60 mL/(min·1.73 m2)是导致COVID -19患者机械通气或死亡的独立危险因素。在校正调整上述风险因素后,SOT组患者有着更高的死亡或机械通气的综合风险(OR:1.34)[17]。
2 移植患者接种新冠疫苗的有效性
2.1 接种新冠疫苗后抗体应答情况 鉴于SOT受者是感染SARS-CoV-2的高危人群,且感染后预后更差,疫苗接种至关重要。但由于SOT受者具有潜在的慢性疾病以及移植后免疫抑制剂的使用,可能会降低该类患者对疫苗的免疫应答。
目前关于新冠疫苗在SOT受者中的免疫应答数据仍然有限。法国一项101例移植受者(包括78名肾移植患者,12例肝移植患者,8例肺移植或心脏移植患者,3例胰腺移植)接种新冠疫苗的研究[18]表明,接种第二剂疫苗后,仅40%的受者抗体转阳。以色列一项纳入80例肝移植受者的研究[19]表明,在接种第二剂BNT162b2 (BioNTech/Pfizer)疫苗后10~20 d,仅38例(47.5%)S1/S2 IgG抗体阳性,而对照组100%阳性。且产生血清学免疫应答的肝移植受者SARS-CoV-2 S1/S2 IgG滴度均低于对照组(95.41 VS 200.5 AU/mL,P<0.001)。美国一项纳入161例肝移植受者接种mRNA疫苗的研究[20]表明,接种第一剂疫苗后21 d,抗体阳性率34%,接种第二针疫苗后30 d,抗体阳性率为81%。19%的患者无应答。另一项较大样本的前瞻性队列研究[21]表明,658例移植患者(包括168例肾移植,26例肝移植,42例心脏移植,43例肺移植,4例胰腺移植以及15例联合器官移植等),接种2剂mRNA疫苗后抗体应答率为54%(357/658)。上述数据表明,移植患者接种新冠疫苗的免疫应答能力低于普通人群。免疫抑制剂的使用影响抗体应答情况,473例接受抗代谢药治疗的患者,43%(205/473)的受者产生抗体,57%(268/473)无应答。而185例未接受抗代谢药治疗的患者,无应答率为18%(33/185)。免疫应答能力与疫苗类型也有关,美国一项小样本前瞻性队列研究,比较12例接受Janssen腺病毒载体疫苗和725例接受mRNA疫苗的SOT受者抗-RBD抗体的滴度情况,结果腺病毒疫苗组仅2例RBD-IgG阳性,应答率仅17%,远低于mRAN疫苗组的59%(430/725)[22]。关于移植受者疫苗接种效果的临床研究见表1。
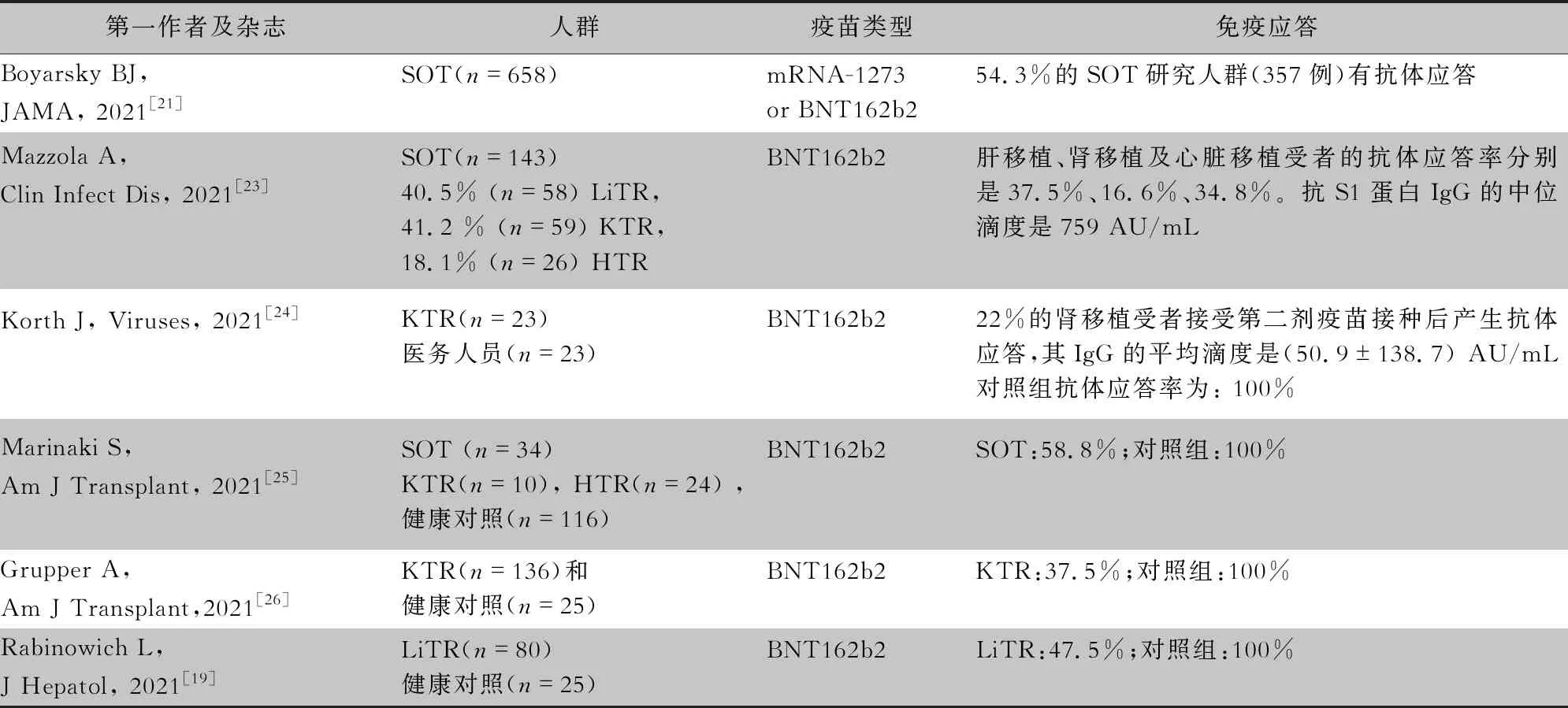
表1 SOT受者接种新冠疫苗后抗体应答相关临床研究
2.2 免疫应答不佳的机制研究 目前关于SOT受者和免疫抑制药物的使用如何影响疫苗诱导的免疫应答仍不明确。体液免疫反应的缺失并不代表无细胞免疫。Cucchiari等[27]分析117例无SARS-CoV-2感染史的SOT受者(肾移植或肾-胰联合移植)接种2剂mRNA疫苗后的细胞和体液免疫,体液免疫通过检测刺突蛋白IgM/IgG,细胞免疫通过ELISpot技术检测活性细胞,结果显示接种疫苗后刺突蛋白IgG或IgM阳性者占29.9%,S-ELISpot阳性者占35.0%,进一步分析与疫苗无反应的相关因素是糖尿病和抗胸腺细胞球蛋白治疗。Sattler等[28]分析肾移植受者在标准的接种第二剂疫苗后的体液和细胞免疫反应。39例移植患者中在接种后的第8天,只有4例检测到IgA抗体,1例检测到IgG抗体,第25天抗体的血清学阳转换率无明显提高。尽管大多数移植患者出现了刺突特异性T辅助细胞反应,但与对照组和透析患者相比,这种免疫细胞反应率显著降低,并伴有效应细胞因子产生、记忆分化和激活相关信号的广泛损伤,IFN-γ的产生明显降低。而在心脏移植或肺移植患者相关研究中,90%移植患者在完成两剂BNT162b2疫苗接种三周后均未出现可检测到的体液或T细胞应答[29]。另一项前瞻性研究比较58例肝移植受者和46例心脏移植受者接种两剂mRNA-1273疫苗后的免疫反应,发现90%的患者对mRNA-1273疫苗产生了体液或细胞免疫反应。与疫苗无应答相关的因素是低γ球蛋白血症和移植后一年内的疫苗接种,提示对于此类人群加强保护策略的重要性[30]。
3 移植患者的强化免疫策略
3.1 移植患者强化免疫的临床研究 加拿大一项随机对照临床研究[31]中,120例SOT受者(包括肺移植、心脏移植、肾移植、胰腺移植和肝移植)1∶1分别接种第三针mRNA-1273疫苗或安慰剂,结果显示第三针加强疫苗可提高患者的RBD抗体水平(增加75倍),且血清中和抗体的阳性率也明显增高(60.0% VS 24.6%)。针对SARS-CoV-2的特异性T细胞计数提高了6.45倍。加强疫苗未增加患者的不良反应,也未出现排异反应,说明加强疫苗能提高器官移植受者的免疫效果,安全性良好。法国也进行了类似的研究[32],157例常规接种两针mRNA-1273疫苗后未产生有效免疫(IgG<50 AU/mL)的肾移植受者接受了第三针加强免疫,接种后的28 d,49.7%(78/157)的肾移植受者产生了较高水平的IgG(中位数586 AU/mL)。使用他克莫司、霉酚酸酯和糖皮质激素会影响抗体的产生,尤其是同时使用3种免疫抑制剂的患者。疫苗加强免疫对变异株同样有效,2021年8月发表在medRxiv预印本上的一项小样本临床研究表明:第三针加强疫苗可提高移植受者的RBD IgG和抗刺突IgG水平,提高抗体对病毒的中和活性,包括德尔塔病毒等突变株[33]。但即使进行了第三针免疫接种,仍有约50%的SOT受者不能产生有效的免疫,研究观察18例SOT受者接种第4针疫苗后抗体产生水平,在第四针疫苗接种前,6例患者的抗体阴性,2例低水平,接种第四针疫苗后,5例产生了高滴度的IgG抗体,其余10例抗体阳性患者经第4针强化接种后抗体水平亦得到进一步提高。3例使用他克莫司联合吗替麦考酚酯和糖皮质激素治疗患者抗体始终阴性,据此推测免疫抑制剂的联合使用是影响疫苗免疫效果的影响因素[34-35]。
3.2 加强针疫苗的选择 虽然不同类型的新冠疫苗接种后都能产生有效的抗体,但对比研究数据发现,mRNA核酸疫苗和蛋白亚单位疫苗产生的中和抗体活性较高,而腺病毒载体和灭活疫苗的中和抗体活性稍低。来自正常免疫人群的研究[35]发现,序贯接种腺病毒-mRNA核酸疫苗者S特异性和RBD特异性IgG抗体水平更高,提示混合接种能激发更强的免疫反应。Werbel等[36]研究显示, 30例肾移植受者接种2剂mRNA疫苗后,使用第三针疫苗强化免疫时,15例选择腺病毒载体疫苗(Ad26.COV2.S ),另15例继续选择mRNA疫苗,结果在接种第3剂疫苗后的15 d,腺病毒载体疫苗组由接种前的1例抗体阳性转为3例抗体阳性;mRNA疫苗组由接种前的5例抗体阳性转为9例抗体阳性,mRNA疫苗组的抗体阳转率高于腺病毒疫苗组。目前缺乏移植患者选用不同类型加强针疫苗的随机对照,在疫苗推荐选择上优先推荐使用原类型的疫苗,若同类型疫苗短缺,亦可选择不同类型疫苗。
4 结语
SOT受者是感染新冠的高风险人群,尽管存在免疫反应低下,抗体滴度低等问题,该类人群仍然可以从新冠疫苗接种中获得显著益处,在疫苗接种策略方面可以通过增加接种剂次来提高免疫应答。目前来自医学协会的国内外指南或专家共识均推荐在SOT受者中推行接种新冠疫苗,并建议对家庭接触者和护理人员进行免疫接种以形成外围免疫屏障,从而降低感染SARS-CoV-2的风险。未来还需要更多关于新冠疫苗在SOT移植人群中的安全性和有效性的数据,以制定最佳的疫苗接种策略。此外,常规的疫情防控手段,如与移植受者互动时保持社交距离、洗手和戴口罩等仍然至关重要。
利益冲突:所有作者均声明不存在利益冲突。

