乳源低聚糖及其代谢的研究进展
高舒曼,潘雨琦,张力中,董奕岑,刘小鸣,赵建新,张 灏,陈 卫
(江南大学食品学院,江苏 无锡 214122)
母乳中含有许多对新生儿有益的物质,其中在乳腺中由乳糖合成而来的母乳低聚糖(human milk oligosaccharides,HMO)是母乳中第三丰富的固体成分,其含量仅次于乳糖和脂质。HMO具有复杂的结构,目前被鉴定出超过200 种HMO,它们在消化道中不被胃酸和消化酶分解,可以完整地到达大肠,被共生在肠道中的菌群代谢。HMO通过作用于肠道生物群影响人体免疫系统及新生儿发育,因此,通常被视作益生元的一种。
除了人乳,其他哺乳动物的乳汁中也含有不同组成与含量的低聚糖,这些低聚糖中,有的与HMO的核心成分结构一致,可以作为HMO的替代品添加到配方乳粉中。近年来许多文献报道,不同结构的乳源低聚糖可以被肠道菌群代谢,并起到影响肠道菌群组成与丰度的作用。本文针对乳源低聚糖的最新研究进展予以综述,着重关注肠道菌群分解代谢低聚糖,提出关于乳源低聚糖调节肠道菌群的合理猜想。
1 乳源低聚糖
HMO可以刺激胃肠道中双歧杆菌的生长,同时可能具有抗黏附作用,减少病原菌与肠道细胞的结合,对肠道相关淋巴组织水平的免疫过程也有调节作用。大量研究从体外发酵、动物与人体实验的角度证明了HMO中的代表性结构具有“双歧效应”,即能促进以双歧杆菌为代表的益生菌生长。到目前为止,母乳中种类繁多的低聚糖还不能成功地被大规模复制,以添加在婴儿配方乳粉中。因此,类似HMO的产品可能作为婴儿甚至成人调节肠道菌群的补充剂,不同哺乳动物的低聚糖组成以及与HMO的相似性值得被研究。
低聚糖在哺乳动物的乳汁中含量与组成不一,且在不同泌乳阶段有较大差异。母乳中低聚糖含量约为10~15 g/L,有文献报道人初乳的低聚糖含量可以达到20 g/L以上,是牛乳的40 倍;山羊乳初乳的低聚糖含量为1.11~1.35 g/L,常乳中为250~300 mg/L,大约是牛乳的5 倍[1]。与人乳中超过200 种HMO不同,牛乳低聚糖(bovine milk oligosaccharides,BMO)被报道67 种不同结构,山羊乳低聚糖(caprine milk oligosaccharides,CMO)则为40 种[2]。其中,至少有10 种BMO和9 种CMO与某些HMO具有相同结构。
HMO一般由3~22 个单糖单元组成,包括D-葡萄糖(D-glucose,Glc)、D-半乳糖(D-galactose,Gal)、N-乙酰-D-氨基葡萄糖(N-acetyl-D-glucosamine,GlcNAc)、L-岩藻糖(L-fucose,Fuc)和N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac),它们通过多种键连接在一起[3]。每个HMO结构开始于末端的乳糖单元Gal-β-1,4-Glc与Gal-β-1,3-GlcNAc,并分别通过β-1,3和β-1,6糖苷键在乳糖单元的基础上延伸。到目前为止,已描述了19 种不同的HMO核心结构[4]。这些核心结构可以是线性或分支的,并且可以进一步通过岩藻糖基化或唾液酸化延长。BMO和CMO中除了组成HMO的5 种单糖外,还含有N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)和N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)[5]。
HMO与其他哺乳动物低聚糖的主要区别在于,人乳中含有高水平的岩藻糖化低聚糖,含量约占母乳中低聚糖的70%,其中检测到的2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)含量可达到4.65 g/L[6],但是在其他哺乳动物中这类低聚糖的比例较低,CMO中含3.8%,BMO则几乎没有。而唾液酸化的低聚糖在BMO中含量非常丰富,约占70%,在HMO中这一比例为10%~20%[7],CMO中为40%~50%[2]。随着泌乳阶段变化,乳中的低聚糖含量和成分也会改变,哺乳动物初乳中的低聚糖和免疫球蛋白含量最高,成熟乳中的低聚糖含量逐渐降低。BMO中唾液酸化的低聚糖在初乳中相对丰度超过70%,但在成熟乳中逐渐下降到50%左右[8]。山羊乳初乳中,6’-唾液酸乳糖(6’-sialyllactose,6’-SL)与3’-唾液酸乳糖(3’-sialyllactose,3’-SL)含量最高,并且含量与品种、泌乳时间、产量密切相关[9]。因此,在比较乳源低聚糖的成分及作用时,不同泌乳阶段的潜在影响也值得关注。
2 肠道菌群对乳源低聚糖的代谢
并非所有的肠道微生物均可利用乳源低聚糖。Marcobal等[10]对肠道菌群中10 个属、共16 种菌的HMO代谢能力进行探究,结果发现,仅长双歧杆菌婴儿亚种、脆弱拟杆菌、普通拟杆菌能够高效代谢HMO,而肠球菌、链球菌、韦永氏球菌、真细菌、梭菌和大肠杆菌菌株在以HMO为唯一碳源的培养基中生长情况不佳或根本没有生长。大量其他研究也证实,双歧杆菌可以较好地利用乳源低聚糖,所涉及的代谢途径也逐渐清晰。此外,Bidart等[11]对13 种肠道相关乳杆菌进行HMO核心结构半乳糖-N-二糖(galacto-N-biose,GNB)/乳糖-N-二糖(lacto-N-biose,LNB)(GNB/LNB)利用能力探究,发现仅干酪乳杆菌、鼠李糖乳杆菌、玉米乳杆菌、格氏乳杆菌和约氏乳杆菌能进行GNB/LNB的体外发酵。其后续研究揭示了干酪乳杆菌对GNB/LNB的代谢途径,且该途径与迄今为止描述的双歧杆菌所采用的代谢途径完全不同[12]。
2.1 双歧杆菌对乳源低聚糖的代谢
研究发现,双歧杆菌已经进化出2 种乳源低聚糖代谢模式,一种是转运蛋白依赖型,即胞内代谢模式,另一种是胞外糖苷酶依赖型,即胞外代谢模式。如图1所示,两歧双歧杆菌和部分长双歧杆菌菌株是采用胞外代谢模式的典型菌株,它们利用细胞外糖苷酶从细胞外的HMO中释放单糖和/或二糖,释放的HMO降解物随后被细胞导入并在细胞质中进一步降解;而其他采用胞内代谢模式的双歧杆菌,如长双歧杆菌长亚种和假小链双歧杆菌等,则通过特定的转运蛋白内化HMO,并在细胞内将之降解[13-14]。
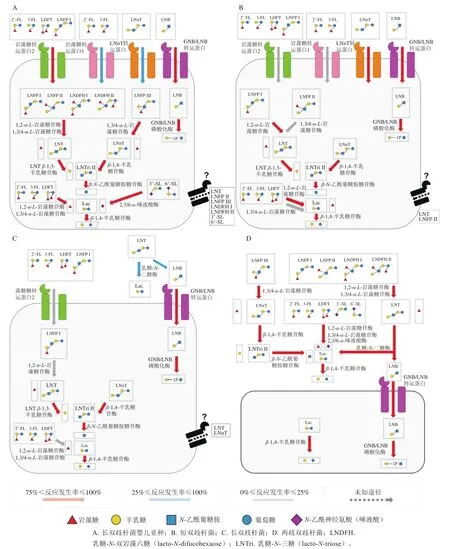
图1 4 种主要的婴儿肠道相关双歧杆菌的乳源低聚糖利用途径Fig. 1 Pathways for utilization of milk oligosaccharides by four infant intestinal bifidobacteria
2.1.1 转运系统
目前,对乳源低聚糖代谢相关转运蛋白的研究还相对较少,仅GNB/LNB、FL和乳糖-N-新四糖(lacto-N-neotetraose,LNnT)的转运蛋白得到了一定的生理表征。深入研究发现,长双歧杆菌婴儿亚种和短双歧杆菌中存在2 种岩藻糖乳糖转运蛋白(fucosyllactose-binding protein,FL-BP),即FL1-BP和FL2-BP。FL1-BP仅转运2’-FL和3-FL,而FL2-BP还可以转运乳糖二岩藻四糖(lactodifucotetraose,LDFT)和乳酰-N-岩藻五糖(lacto-N-fucopentaose,LNFPI),且当同时存在FL1-BP和FL2-BP时,2’-FL的转运效率取决于FL1-BP[15]。
2.1.2 糖苷酶和磷酸化酶
如前文所述,乳源低聚糖的核心结构由半乳糖、葡萄糖和N-乙酰基葡萄糖组成,且常缀有岩藻糖、唾液酸和Neu5Ac等。这些复杂的低聚糖必须逐步分解后被双歧杆菌利用,因而双歧杆菌已经进化出了几种高特异性糖苷酶和磷酸化酶,具体见表1。

表1 双歧杆菌乳源低聚糖代谢相关酶Table 1 Summary of enzyme related to the metabolism of milk oligosaccharides in bifidobacteria
2.2 干酪乳杆菌对乳源低聚糖的代谢
研究表明,二糖α-L-岩藻糖-(1,3)-N-乙酰-D-氨基葡萄糖(α-L-fucosyl-(1,3)-N-acetyl-D-glucosamine,3FN)经alfEFG编码的甘露糖磷酸转移酶系统(phosphotransferase system,PTS)转运进入细胞,这个过程中3FN未被磷酸化[24]。接着,3FN在alfB编码的α-L-岩藻糖苷酶的作用下分解为L-岩藻糖和GlcNAc,后者被继续代谢,而L-岩藻糖部分则被外排至培养基中[25](图2)。
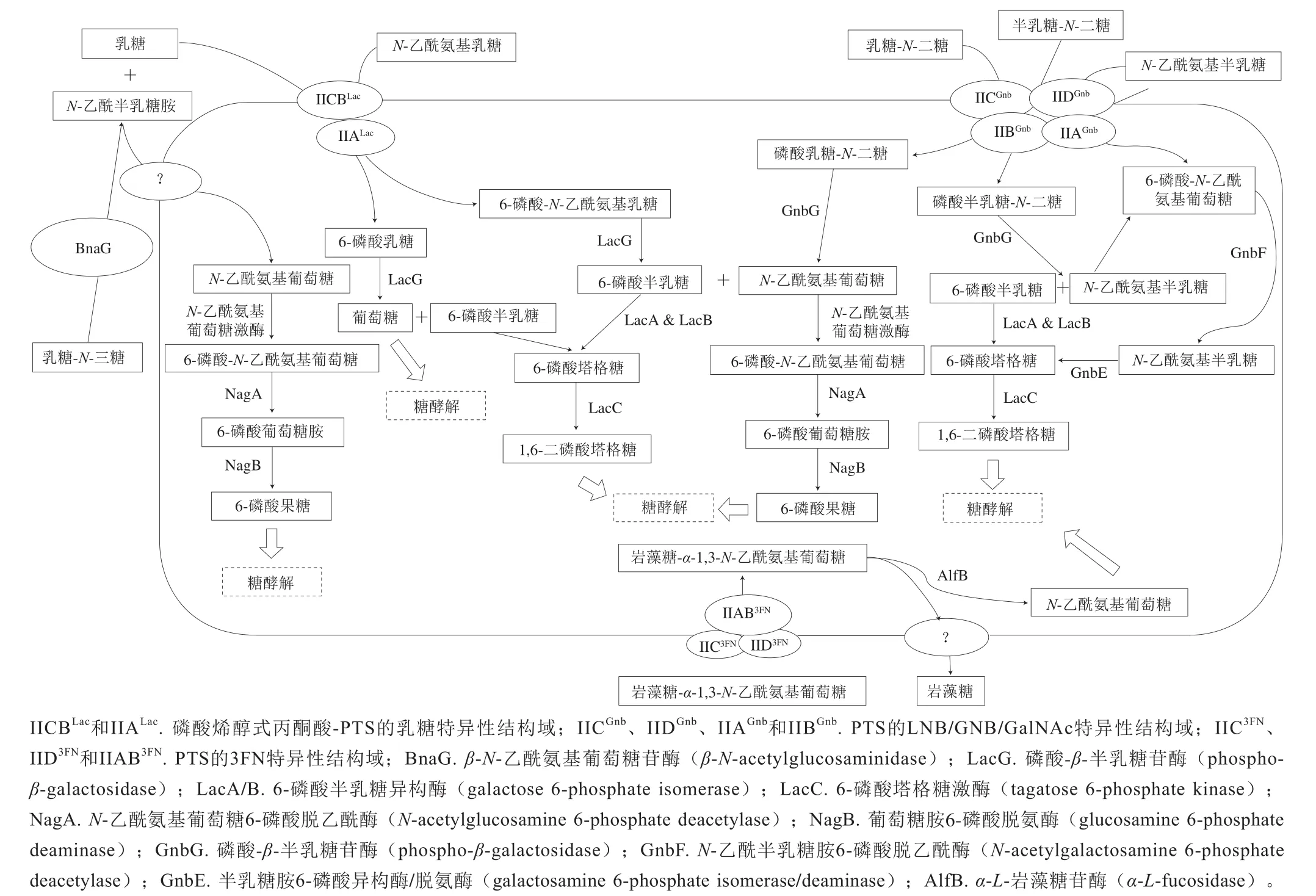
图2 干酪乳杆菌的乳源低聚糖代谢途径Fig. 2 Metabolic pathway of milk oligosaccharides in Lactobacillus casei
干酪乳杆菌对LNB和GNB的利用依赖于gnb操纵子,其中包含gnbR编码的转录抑制因子、gnbE编码的6-磷酸半乳糖胺异构酶/脱氨酶、gnbF编码的6-磷酸-N-乙酰半乳糖胺脱乙酰酶、gnbG编码的β-磷酸半乳糖苷酶和gnbBCDA编码的甘露糖PTS中酶II(enzyme II,EII)的4 个组分(EIIB、EIIC、EIID和EIIA);LNB、GNB和GalNAc经PTSGnb磷酸化转入细胞后,被β-磷酸半乳糖苷酶水解为6-磷酸半乳糖和相应的N-乙酰己糖胺(GlcNAc和GalNAc),随后GlcNAc和GalNAc被相应的激酶磷酸化为GlcNAc-6P和GalNAc-6P,并进入不同的分解代谢途径,6-磷酸半乳糖则通过塔格糖6-磷酸途径代谢;GlcNAc-6P经NagA脱乙酰酶转化为6-磷酸葡萄糖胺,6-磷酸葡萄糖胺再由NagB脱氨酶转化为6-磷酸果糖,进入糖酵解途径代谢。而GalNAc-6P经GnbF脱乙酰酶转化为6-磷酸半乳糖胺,6-磷酸半乳糖胺再由GnbE脱氨酶转化为6-磷酸塔格糖,进入塔格糖6-磷酸途径分解代谢[26-27]。
2.3 拟杆菌对乳源低聚糖的代谢
肠道寄生的拟杆菌有效利用HMO的能力并不普遍。Marcobal等[28]的研究表明,多形拟杆菌(Bacteroides thetaiotaomicron)、脆弱拟杆菌(Bacteroides fragilis)、粪拟杆菌(Bacteroides caccae)、普通拟杆菌(Bacteroides vulgatus)、卵圆拟杆菌(Bacteroides ovatus)和粪便拟杆菌(Bacteroides stercoris)6 种拟杆菌能在HMO为单一碳源的培养基生长,但其中卵圆拟杆菌与粪便拟杆菌未呈现指数增长。另外,该研究还发现HMO和人类肠道黏蛋白多糖的结构相似,在新生儿肠道菌群中占优势的多形拟杆菌和脆弱拟杆菌在利用HMO和黏蛋白多糖时诱导了一部分同样的基因。因此,HMO可以同时吸引依赖黏蛋白的菌群和依赖HMO的双歧杆菌到婴儿肠道,进而使得婴儿微生物区系在引入固体食物后平稳过渡。
3 乳源低聚糖对肠道菌群的调节作用
国际理论与应用化学联合会对低聚糖的定义如下:低聚糖是含有3~9 个单糖残基的化合物,这些残基的数量决定了其聚合程度。低聚果糖(fructooligosaccharides,FOS)广泛存在于食用植物和水果中,而低聚半乳糖(galacto-oligosaccharides,GOS)由乳糖经半乳糖基转移酶作用产生。乳源低聚糖与其他来源的低聚糖同为益生元,均能促进肠道中以双歧杆菌为代表的有益微生物生长,但是,它们对整个肠道菌群的调节作用尚不十分明确。此外,乳源低聚糖与其他来源低聚糖对肠道菌群的调节作用差异也有待摸索。
3.1 乳源低聚糖和其他低聚糖对肠道菌群的调节
Hamilton等[29]给4 组C57/BL6小鼠分别喂养高脂饮食、高脂饮食+6% BMO、高脂饮食+6%菊粉或对照饮食。结果发现,BMO和菊粉都增加了小鼠回肠中有益微生物双歧杆菌和乳酸菌的丰度,然而,菊粉的添加改变了整个肠道菌群系统发育多样性,降低了物种丰富度。Yu Zhuoteng等[30]发现,添加HMO或FOS后,婴儿肠道菌群中双歧杆菌数量增加,大肠杆菌和产气荚膜梭菌均减少,产生的乳酸含量显著高于对照组,pH值显著降低,但是,添加HMO的效果均较FOS更为明显。
乳源低聚糖相较于单一的益生元,在促进双歧杆菌丰度上有一定的优势。这可能是由于乳源低聚糖中的某些结构被双歧杆菌优先利用,使得双歧杆菌的物种丰富度与丰度都有所增加。在其他文献中,研究者还比较了HMO中的核心成分与其他益生元对肠道的影响。Kitaoka等[31]曾报道,在婴儿肠道中占优势的双歧杆菌具有LNB和GNB特有的代谢途径,能把2 种二糖进一步切割。而其他肠道分离菌不能利用LNB显著促进生长[32]。Satoh等[33]用含有1% LNB、乳果糖、棉子糖、低聚半乳糖或甘露寡糖的单一碳源培养基接种经特定婴幼儿配方乳粉喂养婴儿的粪便样本。结果表明:与其他寡糖相比,LNB能显著增加双歧杆菌总数;与其他寡糖的发酵产物相比,LNB的发酵产物中乳酸含量明显更低,乙酸含量明显更高。HMO比其他单一的低聚糖有益生优势可能体现在LNB这类核心组分对双歧杆菌的定向选择。
Salli等[34]在体外结肠模拟器中分别发酵2’-FL、GOS与乳糖。结果表明:发酵2’-FL的肠道菌群生物多样性增加,其中以双歧杆菌属最为显著;添加3 种物质的差异主要体现在短链脂肪酸上,GOS组产生更多的短链脂肪酸;2’-FL能使代谢它的细菌生长,因而能使双歧杆菌特异性增殖。当然,整个肠道菌群结构的维持需要更复杂的HMO混合物共同作用。
综上所述,乳源低聚糖与菊粉、FOS等其他来源低聚糖对肠道菌群的调节作用存在差异,且相对而言,乳源低聚糖似乎具有更佳的益生作用,如更好地增加肠道菌群的多样性、促进双歧杆菌的增殖等。
3.2 肠道菌群的组成影响不同低聚糖的调节作用
Medina等[35]以4 种典型的婴儿肠道微生物:长双歧杆菌婴儿亚种、普通拟杆菌、大肠杆菌和嗜酸乳杆菌模拟婴儿肠道菌群,在单培养、成对培养和共培养条件下,使其在2’-FL或FOS中生长。结果显示,虽然在2’-FL中成对培养时,长双歧杆菌婴儿亚种较普通拟杆菌更为强势,但是共培养时,普通拟杆菌主导发酵,其次为婴儿双歧杆菌;然而,在FOS中联合培养时,嗜酸乳杆菌始终占据主导地位。
Perdijk等[36]向成人或婴儿粪便培养物掺入SL或GOS,以探究SL和GOS对肠道微生物群组成的影响。结果表明,在婴儿粪便培养物中添加SL或GOS,拟杆菌和双歧杆菌数量均增加,而在成人粪便培养物中添加SL仅使得拟杆菌数量增加,添加GOS仅使得双歧杆菌数量增加。这也诱导了不同的短链脂肪酸组成:添加SL后短链脂肪酸以丙酸酯为主导,添加GOS后短链脂肪酸以乳酸为主导。
可见,乳源低聚糖对肠道菌群的调节作用可能受其间某些组成细菌驱动,即初始肠道菌群的组成会影响该调节作用,或者说同一种低聚糖作用于不同的肠道菌群也会产生不同的调节作用。
4 结 语
本文通过综述乳源低聚糖的种类和结构、肠道菌群对乳源低聚糖的代谢特点及乳源低聚糖对肠道菌群的调节作用,得出以下结论:1)来自不同哺乳动物的乳源低聚糖成分有很大差异,人乳中比例最高的FL在牛乳中比例极低,而在牛乳中占相当大比例的低聚糖为SL,HMO的种类最多,结构最为复杂;2)并非所有肠道微生物均可利用乳源低聚糖,现有研究发现,双歧杆菌属可以较好地利用乳源低聚糖,肠道相关乳杆菌中仅干酪乳杆菌、鼠李糖乳杆菌、玉米乳杆菌、格氏乳杆菌和约氏乳杆菌能进行GNB/LNB的体外发酵,拟杆菌中仅多形拟杆菌、脆弱拟杆菌、粪拟杆菌、普通拟杆菌、椭圆形拟杆菌和便拟杆菌能在HMO为唯一碳源的情况下生长;3)双歧杆菌已经进化出2 种乳源低聚糖代谢模式,一种是转运蛋白依赖型,即胞内代谢模式,另一种是胞外糖苷酶依赖型,即胞外代谢模式,干酪乳杆菌通过相同的甘露糖型PTS将LNB、GNB和GalNAc转运到细胞中,拟杆菌通过黏液利用途径摄取乳源低聚糖;4)乳源低聚糖与菊粉、FOS等其他来源低聚糖对肠道菌群的调节作用存在差异,且相对而言,乳源低聚糖似乎具有更佳的益生作用,如更好地增加肠道菌群的多样性、促进双歧杆菌的增殖等,乳源低聚糖对肠道菌群的调节作用可能受其间某些组成细菌驱动,即初始肠道菌群的组成会影响该调节作用。
综上所述,目前的研究已鉴定出一系列与乳源低聚糖运输和降解相关的基因,且证实这些基因在双歧杆菌属中相对保守,但是仍有大量乳源低聚糖同化过程中涉及的转运蛋白未被发现,有待研究揭示。另外,乳源低聚糖对肠道菌群的调节作用也值得更多的关注。

