14例转移性结直肠癌合并消化道穿孔临床病理特征及预后的回顾性系列分析
郜 辉, 王之龙, 许 婷, 王正航, 曹彦硕, 张小田, 李 健, 彭 智, 陆 明, 王晰程
1.郑州大学附属郑州中心医院肿瘤康复科,河南 郑州 450007;2.北京大学临床肿瘤学院 北京大学肿瘤医院暨北京市肿瘤防治研究所消化肿瘤内科 恶性肿瘤发病机制及转化研究教育部重点实验室;3.北京大学临床肿瘤学院 北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科
恶性肿瘤相关急腹症是由恶性肿瘤导致,或各种抗肿瘤治疗手段引发的以急性腹痛为主要临床表现的一种非围手术期腹部急性病变,往往与肿瘤本身的发生发展互为因果,病情较重,甚至威胁生命,常需施以外科为主的多学科诊疗模式(multidisciplinary diagnosis and treatment,MDT),依据不同的肿瘤学评估和治疗目标,制定相应治疗策略。对比良性急腹症,在病因、临床表现、诊治策略、后期管理等方面存在巨大差异,循证医学中证据匮乏,临床治疗争议极大[1]。2017年世界急诊外科协会(World Society of Emergency Surgery,WSES)指出结直肠癌导致的穿孔在诊断、治疗策略等方面都具有挑战性,同时更新关于结直肠癌穿孔治疗指南[2]。2020年5月我国出台了《恶性肿瘤相关急腹症多学科管理中国专家共识》,就恶性肿瘤相关急腹症多学科诊断与评估、预防与治疗给出临床指导[3]。
结直肠癌合并消化道穿孔是临床常见的恶性肿瘤相关急腹症之一,其发生率为2%~12%,通常迅速发展为腹膜炎、感染性休克等严重并发症,围手术期死亡率可高达12%[4]。局部转移性结直肠癌合并消化道穿孔,将增加结直肠腹膜转移(colorectal peritoneal metastasis,CPM)风险,且术后复发率高达56.5%[5]。因此,局部转移性结直肠癌合并消化道穿孔临床上应积极外科干预,且术后通常继续进行辅助化疗以期降低复发风险。然而,对于不可切除的转移性结直肠癌合并消化道穿孔的研究报道很少。晚期患者通常肿瘤负荷大、一般状况相对较差,且由于分期晚往往难以进行根治性手术,因此一旦出现消化道穿孔,肿瘤内外科医师都要面临巨大挑战。现就2019年11月至2020年11月北京大学肿瘤医院消化内科收治转移性结直肠癌合并消化道穿孔14例患者的临床病理特征、治疗、预后等进行探讨。
1 资料与方法
1.1 临床资料收集2019年11月至2020年11月北京大学肿瘤医院消化内科收治接受药物治疗的转移性结直肠癌患者共938例,其中出现消化道穿孔的有14例。病理分期参照美国癌症协会(American Joint Committee on Cancer,AJCC)第七版TNM分期。14例转移性结直肠癌合并消化道穿孔患者ECOG评分均≤2分,均经病理学证实为原发性结直肠癌,且影像学判断TNM分期为Ⅳ期,均经影像学和(或)手术证实合并消化道穿孔(1例小肠穿孔、1例阑尾穿孔和12例结肠穿孔),所有病例阅片均由同一位影像学教授完成。
1.2 方法对14例转移性结直肠癌合并消化道穿孔的患者进行临床病理特征回顾性分析和统计,包括:年龄、性别、原发灶部位、基因状态、穿孔前肠镜检查情况、穿孔前治疗情况、穿孔前治疗反应、穿孔部位、是否合并梗阻、影像学变化及治疗。并对其中12例穿孔后行手术干预的患者,进行门诊或电话随访。
1.3 统计学方法14例转移性结直肠癌合并消化道穿孔患者临床病理特征采用描述性统计学方法。穿孔术后继续抗肿瘤治疗组及术后最佳支持治疗组生存分析数据采用Log-rank进行生存曲线显著性检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征2019年11月至2020年11月北京大学肿瘤医院消化内科共收治晚期结直肠合并消化道穿孔的患者14例,发生率为1.49%,均为腺癌、微卫星稳定型(microsatellite stability,MSS)、Ⅳ期。其中12例穿孔后接受外科手术治疗,2例行内科对症支持治疗。14例转移性结直肠癌合并消化道穿孔的患者中,男9例(64.3%)、女5例(35.7%);年龄≥60岁10例(71.4%)、<60岁4例(28.6%);右半结肠癌4例(28.6%)、左半结肠癌10例(71.4%);RAS/BRAF全野生型5例(35.7%)、RAS/BRAF突变型9例(64.3%)(其中KRAS突变5例,NRAS突变3例,BRAF突变1例);肠梗阻同时合并消化道穿孔8例(57.1%);穿孔时一线治疗有11例(78.6%)、二线治疗1例(7.1%)、三线治疗2例(14.3%)。14例转移性结直肠癌合并消化道穿孔患者中,9例穿孔前有肠镜检查,其中镜身无法通过6例(66.7%),镜身可通过的3例(33.3%);14例转移性结直肠癌合并消化道穿孔患者中,未经任何抗肿瘤治疗即出现穿孔有4例,抗肿瘤治疗过程中出现穿孔的患者10例,其中使用VEGF抑制剂7例(50.0%),穿孔前治疗有效(PR、SD)者8例(57.1%)(见表1)。综上所述,老年、男性、左半结肠癌、RAS/BRAF突变型、合并肠腔狭窄甚至肠梗阻、使用VEGF抑制剂可能是转移性结直肠癌出现消化道穿孔的风险因素。

表1 14例晚期肠癌合并穿孔的临床病理特征
2.2 影像学特征通过临床症状及CT影像学阅片判断(见图1~2),14例肠癌合并穿孔患者,有8例(57.1%)穿孔时合并梗阻,5例(35.7%)穿孔同时伴病变相邻有憩室,9例(62.3%)肿瘤原发灶局部分期为T4a~T4b,CT可见肿瘤周围或腹盆腔游离气体的有10例(71.4%)。肠癌原发灶局部分期晚、合并梗阻、憩室可能是肠癌合并穿孔的高危因素。另外,并非所有穿孔CT均可见有游离气体,临床诊断应结合症状、体征及高危因素综合判断。
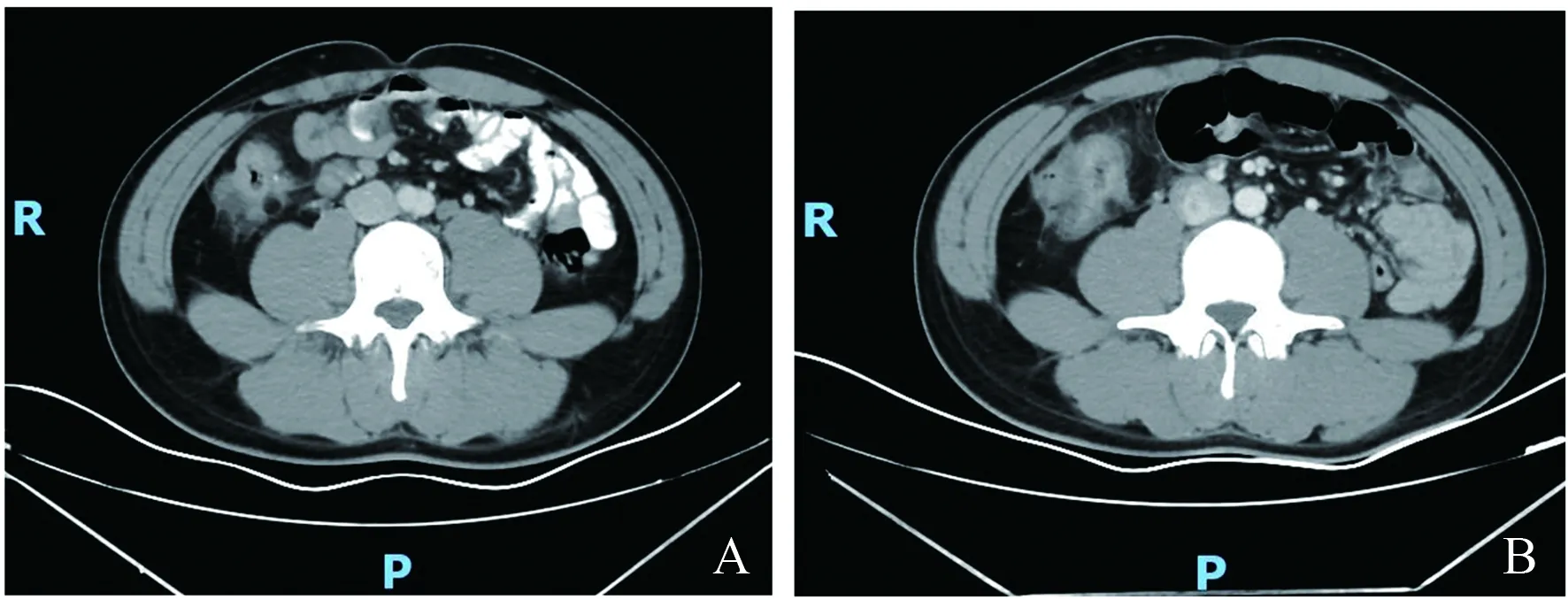
注:A:穿孔前CT影像;B:回盲部穿孔合并肠梗阻:CT可见腹腔新发游离气体,并可见肠腔明显扩张积气。

注:A:穿孔前CT影像;B:穿孔后CT可见:肿瘤侵透浆膜,局部透壁改变,含气腔外凸(包裹)。
2.3 预后分析14例转移性结直肠癌合并消化道穿孔患者中经手术干预者12例,对这12例患者进行门诊及电话随访,随访截止时间2020年11月30日。将12例手术患者分为两组:治疗组(术后继续进行抗肿瘤治疗包括化疗、放疗、靶向、介入等)8例;观察组术后最佳支持治疗(best supportive care,BSC)4例。治疗组总生存期显著优于观察组,差异有统计学意义(P<0.05,见图3)。

图3 穿孔术后抗肿瘤治疗组与最佳支持治疗组生存分析
3 讨论
结直肠癌是自发性穿孔相关的恶性肿瘤之一,转移性结直肠癌合并消化道穿孔病情凶险,疾病进展迅速,死亡率极高,是不良预后因素之一[6-7]。Banaszkiewicz等[8]研究发现,结直肠癌合并肠穿孔其术后并发症和死亡率增加。Alvarez等[9]研究结果显示以穿孔为初始表现的结直肠癌术后死亡率约为29%,且复发转移风险增高。结直肠癌合并消化道穿孔计算机断层扫描(computed tomography,CT)影像学特征可见游离或包裹性气体。Moon等[10]研究发现,结直肠癌合并穿孔与靠近穿孔部位远端肠壁偏心性增厚有显著相关性(P<0.01),平均厚度约13.6 mm,且肠周可见多发淋巴结增大,而良性病变如粪石引起穿孔厚度约5.1 mm。转移性结直肠癌合并消化道穿孔病因大致分为肿瘤相关与非肿瘤相关,前者指原发肿瘤或转移性肿瘤直接浸润肠壁全层引起坏死导致穿孔,肿瘤进展导致肠腔狭窄甚至造成肠梗阻,引起近段肠腔扩张,肠壁张力增加引起肠壁破裂穿孔。后者是由于诊断和治疗等因素导致的穿孔,如肠镜检查与梗阻支架放置中出现的肿瘤部位肠管破溃穿孔、盆腔放射性损伤导致的消化道穿孔等。本研究回顾性分析14例转移性结直肠癌合并消化道穿孔的患者,有10例在抗肿瘤治疗过程中发生穿孔,其中8例(57.1%)治疗有效,7例(50.0%)使用VEGF抑制剂,由此转移性结直肠癌合并消化道穿孔可能与抗肿瘤治疗有效及血管生成抑制剂使用相关,原因包括:(1)部分转移性结直肠癌抗肿瘤治疗有效,导致原发灶纤维组织挛缩,进而导致局部肠腔狭窄,甚至引起继发性肠梗阻,最终导致肿瘤原发灶或近段肠壁破裂穿孔。(2)肿瘤直接浸润局部肠壁,抗肿瘤治疗有效,肿瘤组织坏死退缩破坏肠壁完整性最终导致穿孔。(3)消化道穿孔可能是抗血管生成药物使用相关不良事件之一。VEGF抑制剂与穿孔发生具体机制尚不明确,可能与VEGF抑制剂引起凝血功能异常及肠壁修复功能障碍,从而引起肠壁缺血坏死,最终发生穿孔,尤其联合非甾体抗炎药物,肠黏膜易发生溃疡和穿孔[11-12]。
本研究回顾性分析14例转移性结直肠癌合并消化道穿孔患者的临床病理资料,总结特点如下:(1)老年男性:老年患者体弱、基础疾病多、梗阻症状不典型等因素导致疾病不能得到及时早期诊治,常常以发生严重消化道穿孔急性腹膜炎急诊。(2)左半结肠居多:本研究统计数据显示约70%的转移性结直肠癌合并消化道穿孔发生在左半结肠,其中约为50%为乙状结肠癌。Høydahl等[13]研究同样发现降结肠及乙状结肠肿瘤与自发性肠穿孔具有相关性。(3)合并肠梗阻:14例转移性结直肠癌消化道穿孔8例合并肠梗阻,约占57.1%;9例穿孔前行肠镜的患者中,有6例(66.7%)肠腔狭窄镜身无法通过。(4)联合使用VEGF抑制剂:本研究回顾性分析14例转移性结直肠癌合并消化道穿孔的患者中,有10例穿孔前已行抗肿瘤治疗,其中使用VEGF抑制剂(包括贝伐珠单抗、呋喹替尼、法米替尼、安罗替尼)的有7例(70%)。化疗联合VEGF抑制剂提高转移性结直肠癌总生存期(overall survival,OS)和无疾病进展期(progression free survival,PFS)是治疗转移性结直肠癌的重要策略之一,然而其消化道穿孔发生率较单纯化疗增加1倍[14-16]。(5)RAS/BRAF突变居多:本研究回顾性数据显示,9例(71.4%)患者为RAS/BRAF突变型,其中KRAS突变5例,NRAS突变3例,BRAF突变1例,可能与基因突变型生物学行为更差有关,具体机制仍需要进一步研究。(6)本研究资料回顾性分析穿孔手术后继续抗肿瘤治疗生存优于术后对症支持治疗组,提示转移性结直肠癌合并消化道穿孔需要多学科协作,术后积极抗肿瘤治疗患者生存获益。然而,本研究的局限性在于治疗组中位生存时间未达到,且病例数较少,因此,延长随访时间和扩大样本量对于进一步研究探讨转移性结直肠癌合并消化道穿孔的生存分析非常有必要。
另外,关于恶性肿瘤相关的消化道穿孔大多数研究并未区分包裹性穿孔和游离性穿孔。包裹性穿孔是指在手术、影像学或病理检查中发现局部脓肿性结肠穿孔,然而无游离性穿孔证据,包括粪便污染和腹腔消化道液体溢出等。Lee等[17]研究发现结直肠癌合并包裹性穿孔与游离性穿孔预后无明显差别。本研究回顾性分析14例转移性结直肠癌合并消化道穿孔的患者临床病理特征,其中有2例患者是包裹性穿孔。1例晚期乙状结肠癌行化疗联合贝伐珠单抗方案转化治疗3周期后评效获益的SD后,患者出现一过性剧烈腹痛持续约2 h后自行缓解未就诊,考虑患者穿孔症状已缓解且前期治疗有效,并未立即手术,而是继续单纯化疗1周期后外科行根治术。另1例病例特点是晚期直肠癌化疗2周期后评效PR,后续治疗中患者突然出现一过性腹痛,CT提示消化道穿孔局限性包裹,外科会诊考虑到患者急性消化道穿孔及腹膜炎的症状不明显,并未立即行手术治疗,而是继续化疗并联合西妥昔单抗治疗3周期后行手术切除。众所周知,肠癌合并穿孔,是恶性肿瘤急腹症之一,疾病凶险,若不及时处理死亡率极高。然而,临床工作遇到这种穿孔并局部形成包裹情况,患者并无急腹症临床症状,推荐应在肿瘤内科、影像科、外科等多学科讨论评估外科干预时机。
综上所述,转移性结直肠癌合并消化道穿孔是肿瘤相关急腹症之一,病情凶险,预后差。老年、男性、左半、RAS/BRAF突变、肠梗阻、肠癌病灶周围憩室形成以及肿瘤局部分期T4a~T4b是转移性结直肠癌合并消化道穿孔的风险因素;另外晚期肠癌药物治疗中使用血管生成抑制剂及抗肿瘤治疗有效时也需要高度警惕穿孔风险。穿孔患者经外科手术后继续进行抗肿瘤治疗有生存优势,但仍需要大样本数据进一步研究及延长随访。
——中国居民收入分配中的逆向调节机制

