基于网络药理学和分子对接技术探析洋参御唐方治疗糖尿病肾脏病的作用机制
彭 泽,赵大鹏,刘力嘉,顾欣悦
(1. 黑龙江中医药大学研究生院,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150020)
糖尿病肾脏病为糖尿病不可忽视的微血管并发症及炎症并发症,最终可引起肾小球硬化,患者可出现水肿、高血压、持续性泡沫尿(蛋白尿)、肾小球滤过率(GFR)降低等[1]。糖尿病肾脏病多呈慢性进行性发展,直至发展为终末期肾病。目前,我国糖尿病发病率高达9.7%,其中DKD的发病率占20%~60%[2]。中药复方洋参御唐方以西洋参、黄芪、菟丝子、女贞子、山药、白芍、玉竹、天花粉、山茱萸、葛根、乌梅、桃仁、红花共13味药物组成,有健脾补肾、益气养阴之效,是黑龙江中医药大学附属第一医院赵大鹏主任医师以标本同治、补泻兼施为治疗目的,在民间验方的基础上,结合历代医家治疗消渴病的经验拟定而成[3]。在改善患者临床症状、降低尿蛋白、保护肾脏并延缓病程进展以及提高患者生活质量等方面作用显著[4],具有疗效稳定、安全可靠等特点。目前洋参御唐方治疗糖尿病肾脏病的作用机制尚未完全阐明,以往研究主要集中于经验总结、血清学指标或单一机制,尚未深入探讨洋参御唐方治疗 糖尿病肾脏病的分子机制。基于中药复方多成分、多途径、多靶点的特征,寻找糖尿病肾脏病特异性高的分子标志物及新的分子靶点,对于糖尿病肾脏病的特异性治疗具有重要意义。生物信息学分析技术可通过一系列网络构建、核心靶点筛选以及信号通路富集分析,快速挖掘方药的主要作用靶点[5]。本研究以此技术分析了洋参御唐方的体内生物学特征,以此对洋参御唐方活性物质进行筛选并对其作用机制进行探究,为其临床治疗糖尿病肾脏病提供参考和理论依据。
1 材料与方法
1.1洋参御唐方生物信息集的获取 应用BATMAN-TCM数据库进行在线生物信息分析,收集洋参御唐方的主要活性成分及潜在靶点,并以君臣佐使形式输入中药复方进行网络药理学分析[6]。其中西洋参、黄芪为君药,山药、玉竹、天花粉、菟丝子、女贞子为臣药,山茱萸、白芍、葛根、乌梅、桃仁、红花为佐使药,一共3个集群,设定P≤0.05,score cutoff≥20为检索条件,并将得出的与洋参御唐方活性成分输入TCMSP平台。以口服生物利用度(OB)≥30%[7]、类药性(DL)≥0.18[8-9]为指标进行筛选,得到洋参御唐方的主要活性成分及其靶点并整理为生物信息集[10]。同时查阅中华人民共和国药典(2020版),并对CNKI、万方数据等数据库进行检索,避免遗漏个别认可度较高的活性成分,将其合并至生物信息集中并构建“活性成分-靶点-通路”相互作用网络。
1.2构建相互作用网络 借助UniProt[11]、Gene Cards[12]等数据库明确生物信息集对应的基因数据,并用Cytoscape3.8.2[13]构建“洋参御唐方-活性成分-靶点”相互作用网络。通过Network Analyzer功能对网络节点进行分析,以节点的大小来表现度(degree)值。
1.3获取糖尿病肾脏病的生物信息数据 在Gene Cards数据库、OMIM数据库[14]、Drugbank数据库[15]、TTD数据库[16]中分别以“diabetic nephropathy” “diabetic kidney disease”“nephropathy diabetic”作为关键词进行检索,寻找糖尿病肾脏病的相关基因数据,参考UniProt数据库进行靶点命名标准化。
1.4蛋白相互作用(PPI)网络构建及分析 通过OmicShare平台对获取的洋参御唐方生物信息集以及糖尿病肾脏病的相关基因数据进行映射分析,得到“洋参御唐方-糖尿病肾脏病-基因数据集”并导入STRING 11.5[17]网站,选定“Homo sapiens”为蛋白种类,将相互作用阈值下限设置为0.4并删除无连接的节点。将结果导入Cytoscape3.8.2软件进行可视化分析并绘制PPI网络。对其进行MCODE分析[18],得出作用显著的节点。度值的大小用节点的大小及颜色的深浅变化来展现,由此筛选出核心靶点。
1.5GO富集分析与KEGG通路分析 将洋参御唐方-糖尿病肾脏病-基因数据及导入Metascape[19]网站进行Gene Ontology(GO)富集分析和KyotoEncyclopedia of Genes and Genomes(KEGG)信号通路分析。限制物种为“Homo Sapiens”(人源) 进行操作,以P≤0.01为指标对分析结果进行筛选,得到相关性前10的分子功能和信号通路,并使用R语言对结果进行可视化处理。
1.6分子对接分析 采用分子对接技术验证从1.1中获取的关键成分和1.4筛选得到的靶点蛋白,探究洋参御唐方对糖尿病肾脏病进行调控的可能性。通过Pubchem数据库查询大分子物质结构并优化保存为.mol2格式;从PDB数据库中下载配体3D结构并使用PyMol软件删除结构中的水分子及小分子,再导入AutoDockTools进行加氢等预处理;将二者转换成pdbqt格式文件并运行AutoDockTools分别进行对接,选取最低结合能作为分子对接的得分。该得分可用于评估靶点与配体之间的对接活性,当对接得分<-7.0 时,二者对接能力显著。
2 结 果
2.1洋参御唐方的生物信息数据 通过BATMAN-TCM检索筛选得到354个活性成分及1 991个靶点,以君、臣、佐使形式分为3个合集,823个共同靶点及3个合集的“活性成分-靶点-通路”相互作用网络见图1。洋参御唐方的主要生物学途径包括神经活性配体-受体互作、钙信号途径、嘌呤代谢、CGMP-PKG信号途径等;分子功能 (MF) 以离子结合、跨膜转运、信号传导、氧化还原酶活化为主;细胞组分 (CC) 主要发生在胞浆及细胞质等细胞场所;生物过程 (BP) 以细胞的氮代谢、转运、生物合成、信号传导、小分子物质代谢、细胞分化等为重点进程。将BATMAN-TCM检索得到的活性成分录入TCMSP数据库,筛选去重后得到OB≥30%,DL≥0.18的145个活性成分及与其对应的275个靶点。洋参御唐方中部分活性成分基本信息见表1。
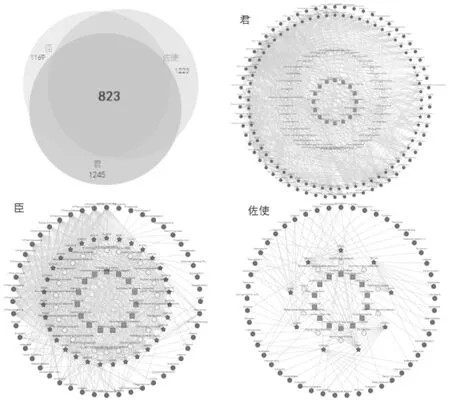
左上角为洋参御唐方的君、臣、佐使的各项靶点基因数,其余为洋参御唐方的君、臣、佐使的“活性成分-靶点-通路”相互作用网络图1 洋参御唐方的靶点基因集
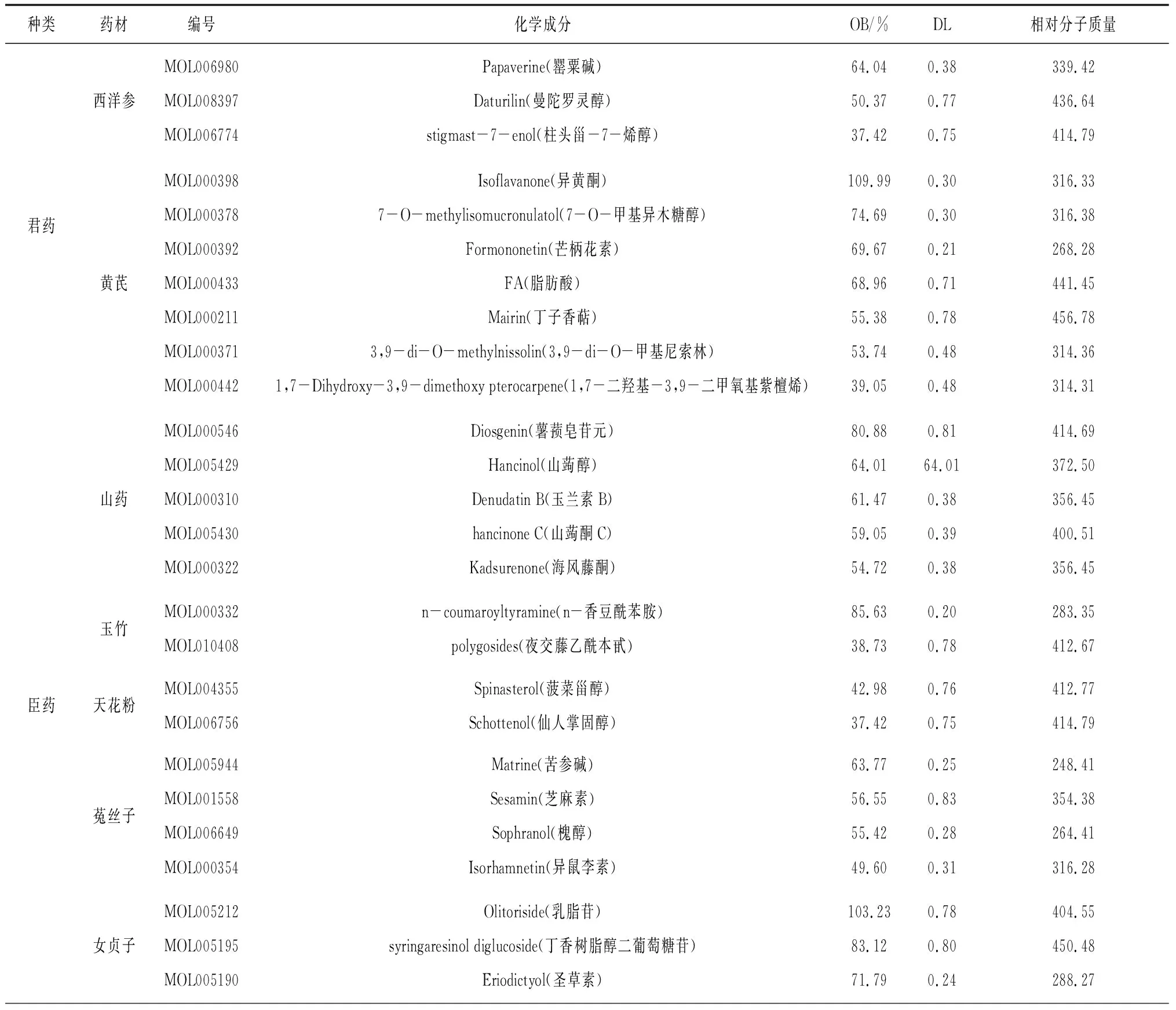
表1 洋参御唐方中部分活性成分的基本信息
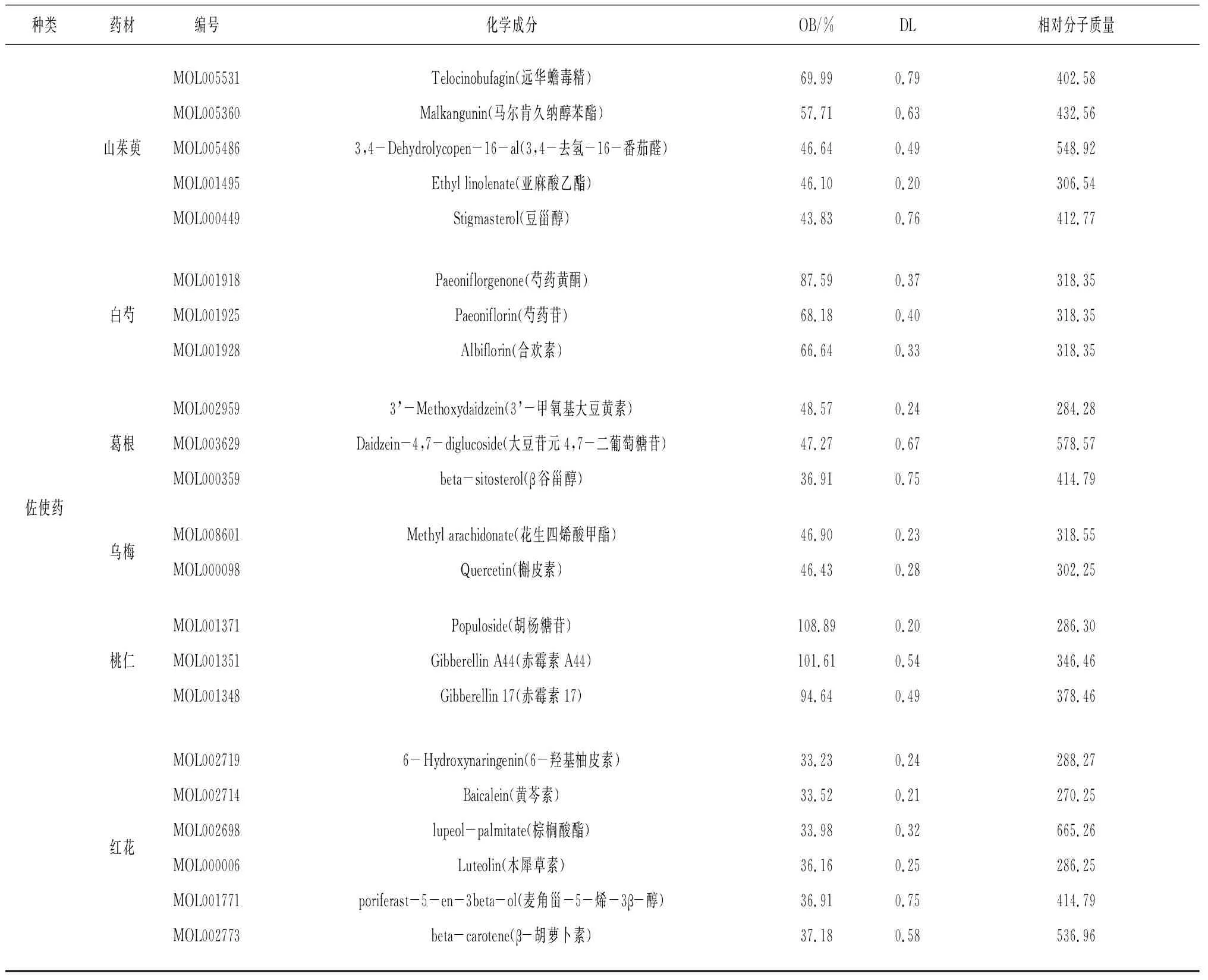
续表
2.2“洋参御唐方-活性成分-靶点”相互作用网络 洋参御唐方“药物-活性成分-靶点”相互作用网络见图2。共包括363个节点和1 496条边,其中13种颜色对应各自的药物节点,□代表75个活性成分节点,◇代表275个靶点节点,每条边则表示药物中所含活性成分及活性成分与靶点相互作用关系。根据网络拓扑学理论,节点的度值取决于与其相连结的节点数量。该网络中,节点的大小与度值呈正比关系,以中心度值、亲中心度值、等级值为标准,筛选得出在该网络中起枢纽作用的节点,作为洋参御唐方的关键活性成分及靶点。网络图提示排名最靠前的5个活性成分分别是quercetin(槲皮素)、beta-sitosterol(β-谷甾醇)、1,7-Dihydroxy-3,9-dimethoxy pterocarpene(1,7-二羟基-3,9-二甲氧基紫檀烯)、luteolin(木犀草素)、Stigmasterol(豆甾醇);根据网络药理学算法理论的角度,以上活性成分可能代表组方的主要疗效物质。从靶点的角度来看,单个基因数据受到越多的活性成分影响,则洋参御唐方对这个靶点的调控性可能越高;网络图提示洋参御唐方中排名前10位的靶点分别为PPARG、TOP2A、PGR、NCOA2、NOS3、SCN5A、ADRA1B、PTGS2、PDE3A、HSP90AB1。

图2 “洋参御唐方-活性成分-靶点”相互作用网络
2.3PPI网络及MCODE分析 将洋参御唐方生物信息集的275个作用靶点与糖尿病肾脏病的3 723个基因数据靶点进行映射分析,得到184个交集靶点并整理为“洋参御唐方-糖尿病肾脏病-基因数据集”。使用STRING 11.5 网站对“洋参御唐方-糖尿病肾脏病-基因数据集”进行分析,得到PPI网络并将结果导入Cytoscape 3.8.2进行可视化处理,见图3。网络图中越靠近圆形中心等级值越高,结果提示这个网络中等级值排名前5位的枢纽靶点蛋白依次为:IL6(白细胞介素-6)、VEGFA(血管内皮生长因子)、TP53(细胞肿瘤抗原P53)、TNF(肿瘤坏死因子)、JUN(转录因子AP-1复合物)。将PPI网络导入Cytoscape 3.8.2进行MCODE模块分析,得到3个K-core值>4的模块,这些模块中的蛋白质关系密切,执行共同的生物学进程。模块1包含大量AKT激酶、白细胞介素、血管内皮生长因子、细胞肿瘤抗原等相关靶点,可调控细胞代谢、增殖和血管生成、肿瘤抑制等生物进程,参与多种细胞周期调节;模块2主要作用于神经调控及细胞功能的协调,如细胞周期、对DNA损伤的反应、代谢、细胞凋亡和自噬等;模块3参与各种内源性及外源性物质的氧化、代谢,包括脂肪酸、类固醇激素和维生素等。见图4。

图3 “洋参御唐方-糖尿病肾脏病-基因数据集”的PPI网络图
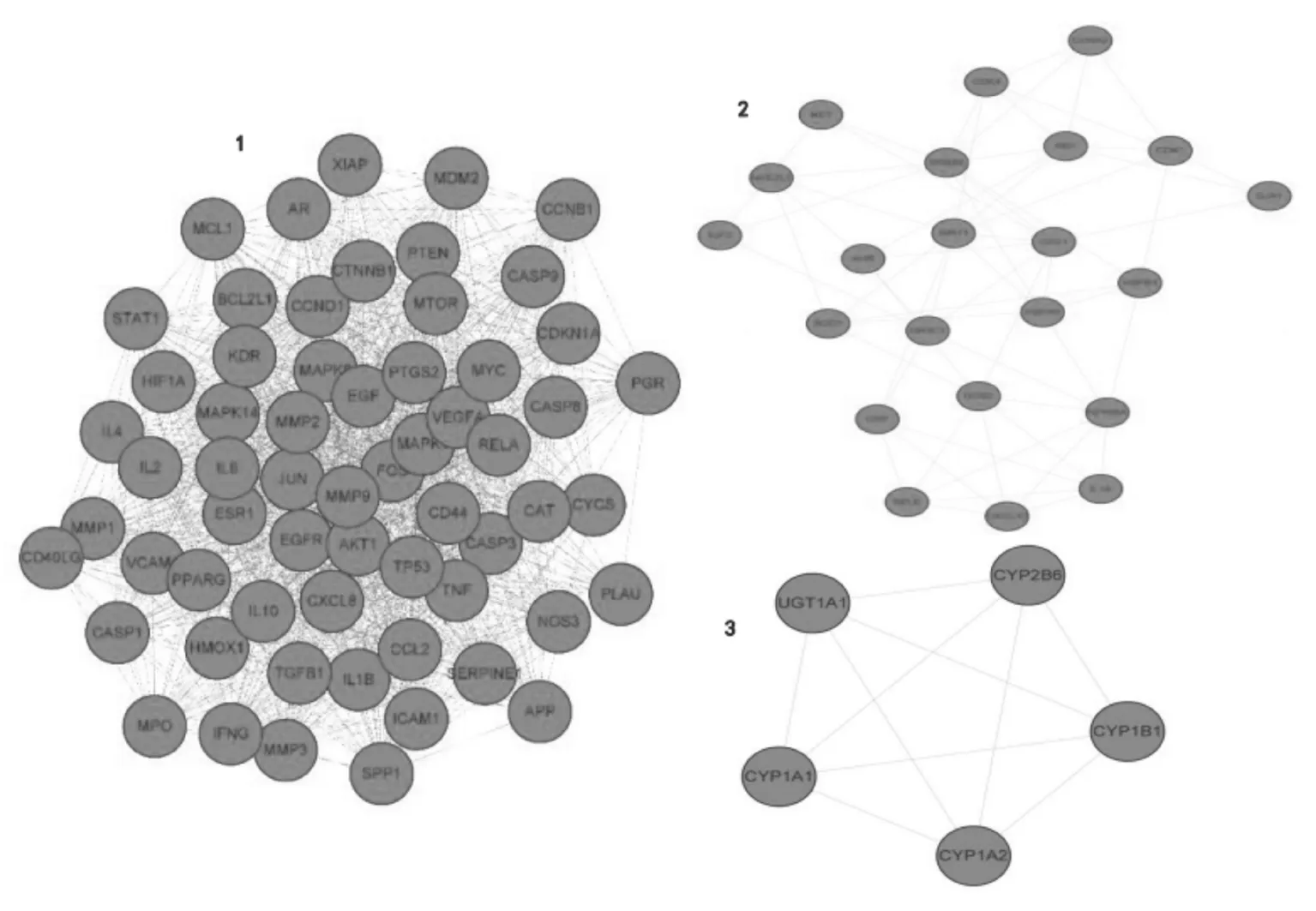
图4 PPI网络的MCODE功能分析
2.4“洋参御唐方-糖尿病肾脏病-基因数据集”的GO富集分析结果 使用Metascape网站对进行GO富集分析,得到P<0.01、最小计数为3且富集因子>1.5的项,并根据其成员相似性将其分组到集群中。GO富集分析结果显示“洋参御唐方-糖尿病肾病-基因数据集”的生物过程(BP)显著富集在于无机物反应、药物应答、脂多糖受体信号途径、伤害应答、细胞-有机环状化合物互作、血管发育、氧化过程、应答类固醇激素、细胞-氮化合物互作、凋亡信号途径等;细胞组分(CC)多集中于膜筏、囊泡腔、细胞顶端部分、细胞外基质等细胞场所;分子功能(MF)以RNA聚合酶Ⅱ特异性DNA结合转录因子结合、蛋白域特异性结合、核受体活性、氧化还原酶活性、激酶结合、血红素结合、细胞因子受体结合等为主。通过查阅文献排除明确不相关富集结果,同时结合文献进行筛选,以P值进行排序,筛选得到具有显著优势的前10位富集结果进行可视化处理。见图5。
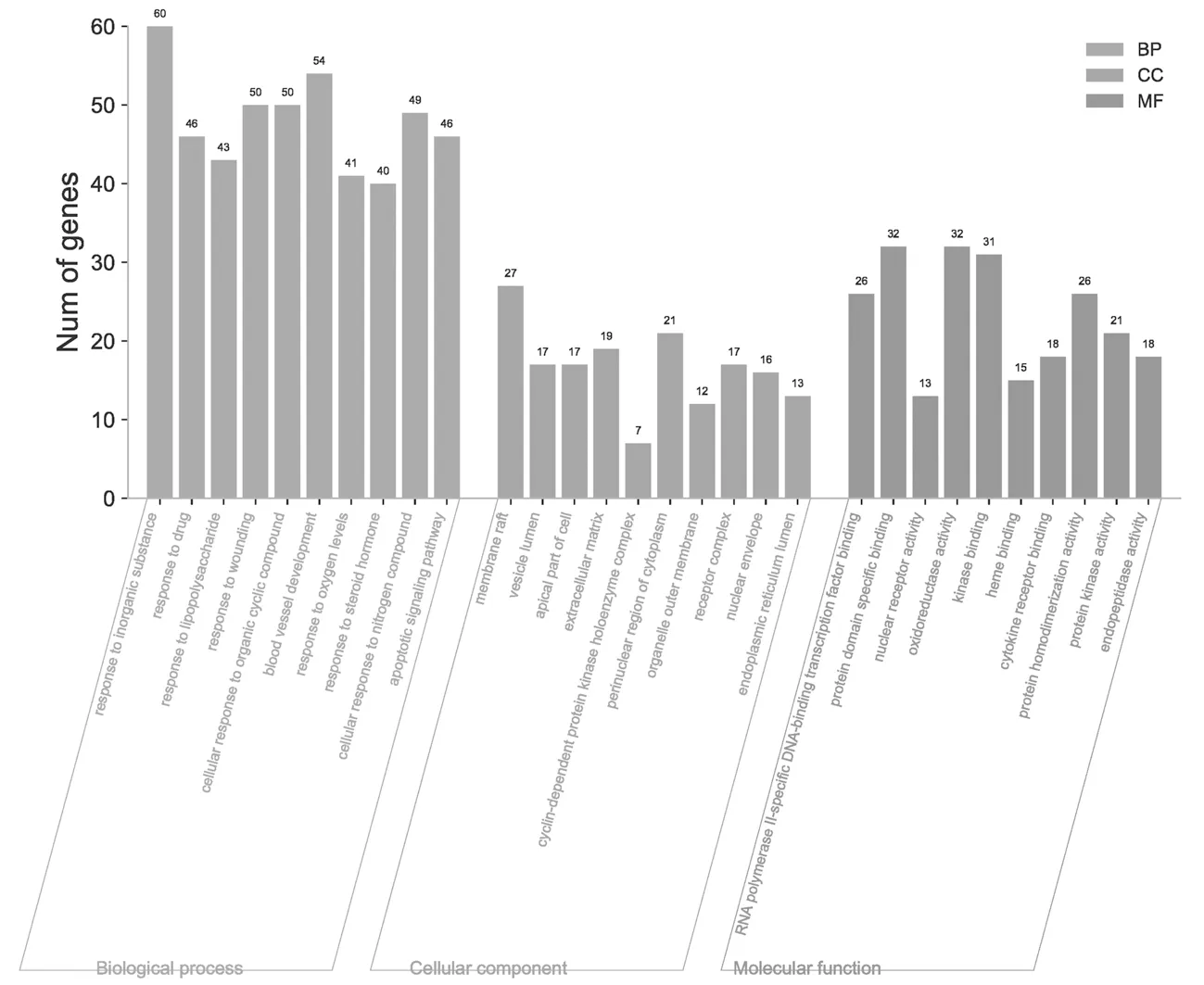
图5 “洋参御唐方-糖尿病肾脏病-基因数据集”的GO富集分析
2.5“洋参御唐方-糖尿病肾脏病-基因数据集”的KEGG通路分析结果 将“洋参御唐方-糖尿病肾病-基因数据集”录入Metascape网站进行KEGG通路分析,以P<0.01、最小计数为3且富集因子>1.5为筛选标准进行筛选,分析获得349条相关核心通路。选取结果中显性程度前10的KEGG通路进行可视化处理,见图6。分析表明目标数据集的主要生物学进程包括糖尿病并发症中的AGE-RAGE信号通路、HIF-1信号通路、癌症信号通路、爱泼斯坦-巴尔病毒感染、TNF信号通路、HTLV-I感染、铂类耐药、MAPK信号通路、阿米巴病信号通路、VEGF信号通路等。
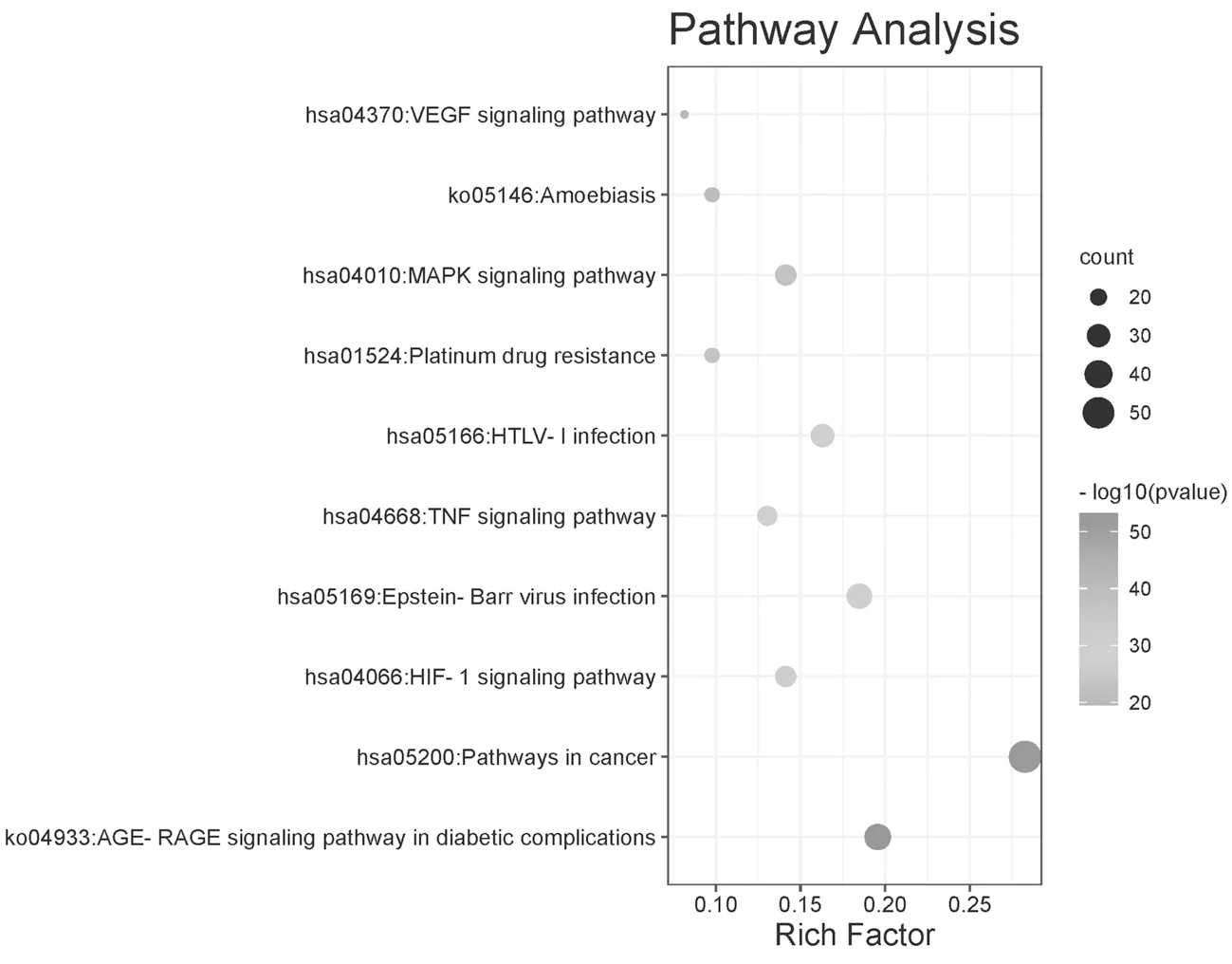
图6 “洋参御唐方-糖尿病肾脏病-基因数据集”的KEGG通路
2.6分子对接结果 将洋参御唐方治疗糖尿病肾脏病节点度值排名居前的槲皮素、β-谷甾醇、1,7-二羟基-3,9-二甲氧基紫檀烯、木犀草素、豆甾醇等活性成分与枢纽靶点进行分子对接,结果见表2。

表2 洋参御唐方活性成分与核心靶点分子对接自由结合能得分 kcal/mol
从结果中选取具有显著结合活性的IL6与β-谷甾醇以及TP53与豆甾醇,并将可视化展示对接模型,见图7。
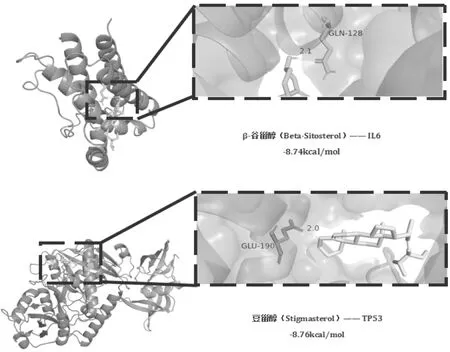
图7 “洋参御唐方活性成分—糖尿病肾脏病枢纽靶点”分子对接图
3 讨 论
糖尿病肾脏病属古籍医案中所述“三消”之“下消”的范畴,亦有医家称之为“消肾”。北宋医家赵佶和清代医家沈金鳌在《圣济总录》《杂病源流犀烛》中分别以“小便白浊如凝脂,形体羸瘦”“有消渴后身肿者,有消渴面目膝肿小便少者”来描述消肾患者病情进展至终末期多出现水肿、贫血、少尿等显著临床表现,同时揭示了消肾发病多由患者素体肾虚,病情迁延日久,伤津耗气,五脏虚损,又兼杂痰、热、郁、瘀等病理因素所致,病因病机属本虚标实。
洋参御唐方以西洋参和黄芪为君药,西洋参性苦寒、味微甘,味浓气薄,在《本草纲目》[20]中被誉为“虚而有火者相宜”之药,具有补肺降火、生津液、除烦倦的作用;黄芪在《本经逢原》[21]中被载为“补五脏诸虚,治脉弦自汗”,能行无汗则发,有汗则止之力。二药相合,共奏扶助正气之功、养阴生津之效。而山药味甘性平,能补益脾胃,益肾润肺;玉竹、天花粉性甘微寒,能养阴益胃润肺;女贞子、菟丝子味甘苦,性凉,有补益肝肾、清虚火、退骨蒸之效,此五药相配伍,共为臣药,能补肾滋阴清热。山茱萸在补益肝肾之时亦具兼助阳之效,为补阴阳之品;白芍敛阴柔肝;葛根解肌升阳、止渴除烦;乌梅有敛肺止咳、生津之功;桃仁、红花活血化瘀;六药相合,可清热、敛阴、生津,共为佐使。诸药相合,共奏健脾补肾、益气养阴之效。
本研究通过 BATMAN-TCM 检索获得洋参御唐方化学成分354种、靶点1 991个,可能与对无机物、药物、脂多糖的反应、损伤反应、细胞对有机环状化合物的应答、血管发育、对类固醇激素的反应、细胞对氮化合物的反应、凋亡信号通路等有关,可发挥协同作用以调控糖尿病肾脏病。
药物相互作用网络显示洋参御唐方治疗糖尿病肾脏病排名前5的化合物为槲皮素、β-谷甾醇、1,7-二羟基-3,9-二甲氧基紫檀烯、木犀草素、豆甾醇。槲皮素是一种天然的黄酮类化合物,可通过促进细胞对糖的吸收来降低血糖、提高抗氧化酶活性减轻氧化应激、抑制炎性因子过度表达减轻炎症并减少肾脏系膜增生延缓纤维化,从而发挥对肾脏的保护作用[22];张杰等[23]发现槲皮素可通过下调AngⅡ诱导下的系膜细胞的MCP-1的分泌,从而抑制肾脏系膜增生。β-谷甾醇对葡萄糖的吸收、脂肪的合成与分解具调控作用,从而抑制糖尿病的发生[24]。Rahimifard等[25]发现,以β-谷甾醇为主要成分的Atenuifolia根提取物可使胰岛β细胞功能增强,增加胰岛素的分泌及活性。紫檀素类化合物是异黄酮类家族中的一个亚类,是许多中药材的有效成分。1,7-二羟基-3,9-二甲氧基紫檀烯作为紫檀素类化合物,可通过抑制MAG来发挥抗菌、抗癌、抗炎、免疫抑制的药理活性[26]。木犀草素属于黄酮类化合物,王超超等[27]发现木犀草素可以抑制高糖诱导下肾小球系膜细胞过度增生,促进其凋亡,改善肾脏损伤,其机制可能与激活 AMPK/SIRT-1/PGC-1α蛋白表达,从而发挥抗肾小球炎症反应、抗增生作用。Ward等[28]研究发现,豆甾醇可通过增加葡萄糖转运蛋白4(GLUT4)的移位和表达的机制作用于2型糖尿病,这也表明了豆甾醇治疗糖尿病肾脏病的潜在益处。
本研究通过PPI蛋白互作网络分析,得出洋参御唐方中蛋白互作性较强的靶点。其中IL6可显著削弱胰岛β细胞的功能,引起胰岛素分泌功能障碍、胰岛素抵抗及代谢综合征,最终促进糖尿病肾脏病的发生,因此IL6作为糖尿病肾脏病发生、发展过程的关键靶点,可通过其水平高低来提示病情的严重程度[29];TNF在白细胞形成过程中起辅助作用,通过促进释放蛋白水解物及超氧化物而使肾组织受损,肾小球基底膜通透性提高,进而导致患者尿蛋白水平上升[30]。槲皮素作为洋参御唐方的主要活性成分,可减少IL-6、TNF-α、IL-1β及C反应蛋白等炎症介质在肾脏的含量,从而发挥抑制肾脏血管内皮炎性反应的功能,进而达到保护肾脏的作用[31]。VEGFA是糖尿病肾脏病发展或进展的敏感预测因子,其表达增加能够有效预测糖尿病肾脏病患者发生微量白蛋白尿[32];TP53作为肿瘤抑制蛋白,以诱导细胞凋亡、衰老、细胞周期阻滞等多种途径达到抑制细胞生长的生物进程,致力于调节细胞内葡萄糖代谢并维持细胞环境内的氧化还原稳态,其水平与糖尿病肾脏病的发展进程有关[33];JUN主要作用于糖尿病肾脏病患者的细胞分化、凋亡、应激过程[34],其在cAMP信号通路刺激下可导致类固醇生成基因表达增加,而类固醇激素可能抑制胰岛素分泌。
KEGG通路分析提示AGE-RAGE信号通路具有显著性,是糖尿病肾脏病发病、进展的重要环节;研究证实AGEs/RAGE水平与肾基底膜细胞、系膜细胞的增生和肥大呈正相关,可加快肾脏纤维化的进程,反之亦能有效延缓其病理进展[35]。有研究发现,高血糖可能通过抑制体内AMPK蛋白激酶的活性来降低5-羟甲基胞嘧啶(5hmC),这同时意味着患癌症的可能性增加[36];该发现揭示了一条存在于糖尿病与癌症之间,具有独特代谢视角的新通路,也为洋参御唐方通过癌症信号通路作用于糖尿病肾脏病提供了理论支持。KEGG通路分析还发现,洋参御唐方可通过HIF-1信号通路作用于糖尿病肾脏病,因高糖环境下,HIF-1信号途径可激活多种与肾间质纤维化的细胞因子,并促进其表达,导致糖尿病肾损伤的发生及发展[37]。
综上所述,洋参御唐方具有多靶点、多通路、多途径的特点,可能通过调控IL6、VEGFA、TP53、TNF、JUN等多个靶点,以及作用于AGE-RAGE信号通路、癌症信号通路、HIF-1信号通路等多条通路对糖尿病肾脏病起到治疗作用。鉴于网络药理学的局限性,洋参御唐方作用于糖尿病肾脏病的基因表达与通路的正负反馈调控过程有待后续实验研究进一步验证。
利益冲突:所有作者均声明不存在利益冲突。

