川陈皮素抑制Aβ25~35诱导的SH-SY5Y细胞氧化应激与凋亡作用
于晴 刘煜敏
(1深圳市龙华区中心医院重症医学科,广东 深圳 518000;2武汉大学附属中南医院神经内科)
阿尔茨海默病(AD)为记忆、认知功能障碍为主要特征的中枢神经系统退行性疾病,老年斑沉积、神经原纤维缠结及神经元大量丢失是其主要病理特点〔1〕。全球每年用于AD的治疗费用高达数千亿美元,给社会和家庭带来沉重负担〔2〕。目前临床治疗AD的药物主要有抗氧化剂、雌激素、降脂药、脑代谢改善药、非甾体抗炎药、钙离子拮抗剂及胆碱酯酶抑制剂等,但这些药物副作用多、价格昂贵、靶点单一且治疗效果难以令人满意〔3〕。因此,开发低毒副作用、价格低廉、多靶点且疗效好的AD治疗药物具有重要意义。
川陈皮素为多甲氧基黄酮类化合物,是陈皮的有效成分之一,具有降血糖、抗心血管疾病、抗肿瘤、抗氧化、抗炎等多方面药理作用〔4〕。近年来,川陈皮素对神经退行性疾病的治疗也逐渐引起了研究人员的关注〔5〕。研究发现〔6〕,川陈皮素能够通过减少半胱氨酸蛋白酶(Caspase)-12蛋白表达,上调海马CA1区γ-谷氨酰半胱氨酸合成酶(GCS)、血红素氧合酶(HO)-1表达,增强抑制凋亡和抗氧化应激作用而改善糖尿病大鼠的学习、记忆能力。川陈皮素也可以上调脑啡肽酶表达及降低脑组织β淀粉样蛋白(Aβ)水平,进而改善AD引起的学习、记忆障碍〔7〕。在转基因AD小鼠模型中,川陈皮素治疗有助于降低海马组织Aβ含量及纤维缠结〔8〕。但迄今为止,川陈皮素对Aβ25~35诱导的SH-SY5Y细胞损伤的保护作用未见报道,故本研究采用川陈皮素干预Aβ25~35诱导的SH-SY5Y细胞损伤模型,探讨其保护作用及潜在机制,为进一步开发AD的新治疗方法提供依据。
1 材料与方法
1.1药物与试剂 川陈皮素(成都普瑞法公司),纯度≥95.0%。Aβ25~35(美国Sigma公司),纯度≥98.0%;Aβ25~35溶解于无菌蒸馏水中配成1 mmol/L储备液,在37℃下放置7 d使其老化,保存于-20℃冰箱内备用。四甲基噻唑蓝(MTT)测定试剂盒(杭州联科美讯生物公司);乳酸脱氢酶(LDH)、谷胱甘肽过氧化酶(GSH-Px)、过氧化氢酶(CAT)及丙二醛(MDA)测定试剂盒(泉州睿信生物公司);TRIzol及qPCR测定试剂盒(日本Takara公司);膜联蛋白V-异硫氰基荧光素/碘化丙啶(Annexin V-FITC/PI)检测试剂盒(美国BD公司);蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、雷帕霉素靶蛋白(mTOR)及磷酸化mTOR(p-mTOR)多克隆抗体(美国Abcam公司)。
1.2细胞株 人神经母细胞瘤SH-SY5Y细胞(美国ATCC生物标准品资源中心)。
1.3仪器 DMILHC倒置相差显微镜,德国徕卡公司;QuantStudio 3实时定量qPCR系统,美国赛默飞公司;MuttiSkan Mk3酶标仪,芬兰Labsystem公司;Canpo-2流式细胞仪,美国BD公司;小型迷你伯乐电泳仪,美国Bio-Rad公司。
1.4MTT法测定细胞存活率 在饱和湿度、5% CO2及37℃条件下用含10%胎牛血清的DMEM培养液培养SH-SY5Y细胞至对数生长期,消化离心后计数,并用DMEM完全培养液调整细胞密度为5×105个/ml。设正常对照组、Aβ25~35损伤组及川陈皮素25、50、100 μmol/L组,培养2 h后,Aβ25~35损伤组及川陈皮素25、50、100 μmol/L组均加入终浓度为25 μmol/L的Aβ25~35,继续培养24 h,通过MTT法测定562 nm处吸光度(OD)值,计算细胞存活率。
1.5氧化应激水平及抗氧化能力测定 SH-SY5Y细胞培养至对数生长期,接种于6孔培养板中,2×105个/孔。分组及处理方法同“1.4”,4 000 r/min离心10 min,取上清液,按试剂盒说明书检测SH-SY5Y细胞培养上清液中的LDH活性。各组细胞加100 μl裂解液后,在冰上充分裂解30 min,4 000 r/min离心10 min,吸取上清液,按试剂盒说明书分别测定SH-SY5Y细胞GSH-Px、CAT活性及MDA含量。
1.6流式细胞法测定凋亡率 收集各组细胞,经磷酸盐缓冲液(PBS)重悬细胞,在避光、室温下先加入Annexin V-FITC,孵育10 min;同样条件下,再加入PI,继续孵育5 min,用流式细胞仪检测各组细胞凋亡率。
1.7实时定量qPCR法测定mRNA表达 收集各组细胞,TRIzol法提取总RNA,并逆转录为cDNA。根据Primer Bank公布的基因序列设计qPCR所需引物,Bcl-2:上游5'-GGGAGAACAGGGTACGATAA-3',下游5'-CCACCGAACTCAAAGAAGG-3';Bax:上游5'-TGTCCCGAAGGAGGTTTATT-3',下游5'-TGT CCCGAAGGAGGTTTATT-3';β-actin:上游5'-TGAACACGGCATTGTCACCAACTGG-3',下游5'-ACTTGCGCTCAGGAGGAGCAATGAT-3'。常规方法进行qPCR,根据实时定量qPCR扩增曲线,按照2-△△Ct法计算目的基因相对表达量。
1.8Western印迹法测定蛋白表达 收集各组细胞,分别加100 μl裂解液后,在冰上充分裂解30 min,4 000 r/min离心10 min,吸取上清液,二喹啉甲酸(BCA)法测定总蛋白浓度。吸取上清液10 μl,经聚丙烯酰胺凝胶电泳分离目的蛋白,转至聚偏氟乙烯(PVDF)膜上,在含5%脱脂奶粉的封闭液中封闭1 h。用PBS冲洗,分别加入Akt、p-Akt、mTOR和p-mTOR多克隆抗体,室温下放置2 h。再用PBS冲洗,加入二抗,室温下继续放置1 h,显色。采用凝胶图像处理系统,观测目的蛋白Akt、p-Akt、mTOR和p-mTOR的光密度值。
1.9统计学分析 采用SPSS16.0软件进行t检验、单因素方差分析。
2 结 果
2.1川陈皮素保护Aβ25~35诱导的SH-SY5Y细胞损伤 与正常对照组比较,Aβ25~35损伤组细胞存活率显著降低(P<0.05);与Aβ25~35损伤组比较,川陈皮素各浓度处理组细胞存活率显著增加(P<0.05)。与正常对照组比较,Aβ25~35损伤组SH-SY5Y细胞培养上清液中LDH活性显著增加(P<0.05);与Aβ25~35损伤组比较,川陈皮素各浓度处理组LDH活性显著降低(P<0.05),见表1。

表1 各组细胞存活率、LDH、GSH-Px、CAT、MDA水平比较
2.2川陈皮素减少Aβ25~35诱导的SH-SY5Y细胞凋亡 与正常对照组〔(5.49±0.68)%〕比较,Aβ25~35损伤组SH-SY5Y细胞凋亡率〔(30.71±3.09)%〕显著增加(P<0.05);川陈皮素25、50、100 μmol/L组〔(25.63±2.03)%、(14.88±1.81)%、(11.20±1.24)%〕与Aβ25~35损伤组比较显著降低(P<0.05),见图1。
2.3川陈皮素降低Aβ25-35诱导的SH-SY5Y细胞氧化应激水平 与正常对照组比较,Aβ25~35损伤组SH-SY5Y细胞GSH-Px、CAT活性明显降低,而MDA含量显著增加(P<0.05);与Aβ25~35损伤组比较,川陈皮素各浓度处理组SH-SY5Y细胞GSH-Px、CAT活性均呈不同程度增加,而MDA含量显著降低,差异有统计学意义(P<0.05),见表2。
2.4川陈皮素调控Aβ25~35诱导的SH-SY5Y细胞凋亡相关基因的表达 与正常对照组比较,Aβ25~35损伤组Bcl-2 mRNA表达及Bcl-2/Bax值明显降低(P<0.05),而Bax mRNA表达显著增加(P<0.05);给予不同浓度川陈皮素处理后,与Aβ25~35损伤组比较,SH-SY5Y细胞Bcl-2 mRNA表达及Bcl-2/Bax值显著增加(P<0.05),而Bax mRNA表达明显降低(P<0.05),见表2。

表2 川陈皮素对Aβ25~35诱导的SH-SY5Y细胞Bcl-2、Bax mRNA表达及Bcl-2/Bax值的影响
2.5川陈皮素激活Aβ25~35诱导的SH-SY5Y细胞Akt/mTOR通路 与正常对照组比较,Aβ25~35损伤组SH-SY5Y细胞p-Akt及p-mTOR蛋白表达明显降低(P<0.05);不同浓度川陈皮素处理后,与Aβ25-35损伤组比较,SH-SY5Y细胞p-Akt及p-mTOR蛋白表达显著增加(P<0.05),见图2,表3。
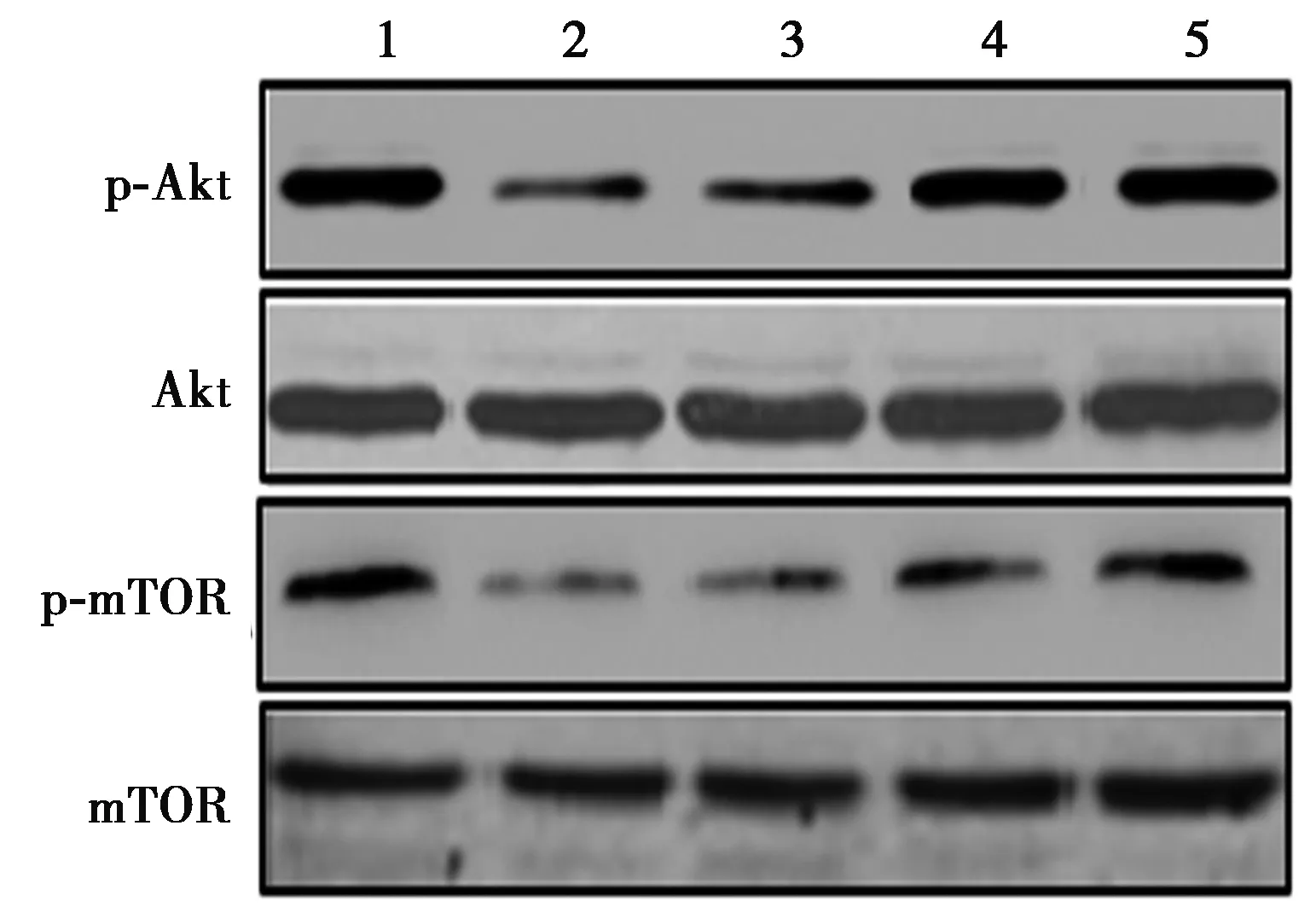
1~5:正常对照组、Aβ25~35损伤组、25 μmol/L川陈皮素组、50 μmol/L川陈皮素组、100 μmol/L川陈皮素组图2 川陈皮素对Aβ25~35诱导的SH-SY5Y细胞Akt/mTOR通路的影响

表3 川陈皮素对Aβ25~35诱导的SH-SY5Y细胞Akt/mTOR通路的影响
3 讨 论
Aβ是由β淀粉样蛋白前体蛋白(β-APP)的异常代谢而生成的具有β折叠结构的淀粉样肽段,可以在神经元外聚集成Aβ寡聚体〔9〕。Aβ寡聚体可以直接破坏离子通道进入胞内发生聚集,也可以与细胞膜表面的多种受体结合激活胞内信号通路,使细胞发生脂质过氧化、升高活性氧、线粒体功能紊乱等损伤,诱导细胞凋亡〔10〕。Aβ25~35为人工合成的Aβ活性片段,具有与Aβ1~42相似的生物学活性,常用于建立AD的体外与体内模型〔11〕。本研究结果提示川陈皮素对Aβ25~35诱导的SH-SY5Y细胞损伤具有保护作用。
在众多的AD发病机制中,氧化应激机制受到越来越多的关注。抗氧化系统功能紊乱和自由基水平升高可能导致脑神经细胞损伤,进而形成AD的病理变化〔12〕。Aβ可以介导神经细胞中活性氧簇(ROS)大量生成,如不能及时清除,ROS会攻击神经细胞膜,损害神经细胞的基本结构并造成细胞的凋亡或死亡〔13〕。抗氧化物可以阻止或消除ROS生成,缓解神经细胞退化,如具有清除自由基作用的褪黑激素,可以显著抑制胶质细胞的异常活化和Aβ的沉积,进而改善AD模型小鼠学习、记忆能力〔14〕。本研究结果表明川陈皮素保护Aβ25~35诱导的SH-SY5Y细胞损伤作用与降低氧化应激水平有关。
神经元凋亡是AD的病理特征之一,主要表现为神经元数量的显著减少;Aβ对神经元具有强烈的毒性,能够导致神经元凋亡〔15〕。本研究结果提示川陈皮素具有抗Aβ25~35诱导的SH-SY5Y细胞凋亡作用。神经元凋亡过程受到胞内的同源异二聚体蛋白Bax和Bcl-2调控,前者促进细胞凋亡,后者抗细胞凋亡,二者的比例决定细胞的凋亡进程〔16〕。研究发现〔17〕,人参总蛋白可抑制Aβ25~35诱导的SH-SY5Y细胞释放细胞色素C,上调Bcl-2表达,下调Bax表达。本研究结果进一步表明川陈皮素保护Aβ25~35诱导的SH-SY5Y细胞损伤作用与抗凋亡作用有关。
Akt/mTOR通路是一条重要的细胞存活信号通路,参与神经细胞增殖与凋亡过程〔18〕。Akt是原癌基因c-Akt的表达产物,处于这一通路的中心环节,其激活受PI3K调控,是神经元存活、突触间信息传递、突触结构形成、轴突及树突形成、神经和血管新生所必需〔19〕。当细胞发生氧化损伤时,活化的Akt可以保护神经细胞免受Aβ蛋白等氧化性毒物诱导的细胞凋亡,对细胞存活至关重要〔20〕。mTOR可以由Akt直接活化,在神经细胞的代谢、生长及凋亡中同样扮演重要的角色〔21〕。本研究结果提示川陈皮素保护Aβ25~35诱导的SH-SY5Y细胞损伤作用与活化Akt/mTOR通路有关。
综上,川陈皮素对Aβ25~35诱导的SH-SY5Y细胞损伤具有保护作用,该保护作用与调控Akt/mTOR通路抑制Aβ25~35诱导的SH-SY5Y细胞氧化应激及凋亡有关,但具体机制还有待于深入研究。

