HIF-1α与Glut-1在大肠癌中表达及与脉管侵犯的关系
贾永恒 姜涛
(吉林大学中日联谊医院肝胆胰外科,吉林 长春 130033)
大肠癌是我国临床常见的消化道肿瘤之一,是世界第三大恶性肿瘤〔1,2〕。大肠癌包括结肠癌和直肠癌。近年来,尽管随着医疗技术的改革与创新,大肠癌患者的生存时间有所延长,但术后5年生存率仍然较低,仅约50%〔3〕。目前,大肠癌的主要病因及发病机制仍不清楚,多种分子在大肠癌的发生、发展和转移等方面发挥重要作用。伴随着基因组计划的完成,基因转录、蛋白修饰等生物学过程在分子水平层面的研究受到越来越多学者的重视。肿瘤的发生发展中,常常伴随着肿瘤细胞不断生长,其恶性程度逐渐增高,氧的需求大于自身血管供应后,引起肿瘤局部缺氧的微环境状态。而肿瘤细胞可以通过自我调整适应这种缺氧状态,通过某些分子作用,促进肿瘤发展〔4〕。缺氧诱导因子(HIF)-1α可通过转录调节对细胞缺氧产生适应〔5〕。恶性肿瘤细胞相比较于正常细胞,代谢率较高。肿瘤能量来源中大部分为葡萄糖,因此葡萄糖的膜转运过程十分重要,葡萄糖转运蛋白(Glut)-1在细胞膜上进行双向转运,在肿瘤的发展中起到关键作用〔6〕。目前研究已经发现HIF-1α和Glut-1在多种恶性肿瘤中高表达,参与肿瘤发展〔7,8〕。而对于HIF-1α和Glut-1在大肠癌中的表达及临床意义仍然具有较多争议,机制尚未明确。因此,本文主要探讨HIF-1α和Glut-1在大肠癌中的表达及其与临床病理特征的关系。
1 材料与方法
1.1病例资料 随机选取2014年1月至2016年1月于吉林大学中日联谊医院胃肠结直肠肛门外科大肠癌患者32例,全部患者均行根治性大肠癌手术,术前未给予任何抗肿瘤治疗,术后1 h内获取病理标本及癌旁组织,存于液氮后制作成石蜡标本保存。本研究经过吉林大学中日联谊医院伦理委员会批准,并与患者及家属签署知情同意书。
1.2纳入及排除标准 纳入标准:患者术前行肠镜检查获取病理标本,明确诊断为原发性大肠癌;术前未给予放疗、化疗等抗肿瘤治疗;未发生远处转移的大肠癌患者;患者病例资料完整。排除标准:伴有严重高血压、严重心脏疾病等其他严重器质性疾病的患者;肿瘤复发再次切除者。
1.3免疫组化 10%的甲醛溶液固定,石蜡包埋,切片。用80℃烤箱对切片进行烘烤30 min,乙醇进行脱水,并使内源性过氧化物酶灭活,应用枸橼酸缓冲液行高温高压水化修复过程;PBS洗3次,加入一抗50 μl,温度控制于4℃一夜;再用PBS洗3次,加入二抗50 μl。室温下二氨基联苯胺(DAB)显色,磷酸盐缓冲液(PBS)洗3次,苏木素轻度复染,树胶行封片处理,光镜下观察。
1.4结果判定 两名病理科医师独立观察切片,有争议的免疫组化结果由第三名病理医师进行评估。光镜下,以癌旁组织作为对照,HIF-1α阳性取决于细胞质中着色的棕黄色颗粒;Glut-1阳性定义为细胞膜、细胞质中着色的棕黄色颗粒。每个切片随机观察10个视野(每个视野计100个肿瘤细胞),计算阳性表达率,阳性表达率<25%为阴性,≥25%为阳性。
1.5统计方法 采用SPSS23.0统计学软件进行数据分析,计量资料服从正态分布的采用t检验,非正态分布的采用非参数检验;计数资料比较采用χ2检验校正,采用Logistic回归进行相关性分析。
2 结 果
2.1HIF-1α、Glut-1在大肠癌中的表达及与临床病理特征的关系 通过免疫组化发现HIF-1α在大肠癌中阳性表达率为42.7%;Glut-1在大肠癌中阳性表达率为53.1%。HIF-1α的表达与脉管侵犯关系密切,差异有统计学意义(P=0.027);与性别、年龄、分化程度,浸润深度、神经侵犯及淋巴转移这些病理特征无关。同样发现,Glut-1的表达与脉管侵犯有关,差异有统计学差异(P=0.028);与其他临床病理特征间无统计学差异(P>0.05)。HIF-1α及Glut-1的表达与肿瘤的脉管侵犯密切相关。见表1,图1。
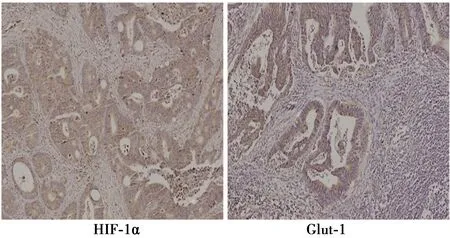
图1 大肠癌组织中HIF-1α、Glut-1表达(DAB,×100)

表1 HIF-1α与Glut-1的阳性表达与临床病理特征的关系(n)
2.2HIF-1α、Glut-1在大肠癌中表达的相关性 32例大肠癌患者中,Glut-1表达阳性共17例,其中14例HIF-1α表达阳性,HIF-1α及Glut-1在大肠癌中的表达关系密切,呈强正相关性(r=0.828,P<0.001)。
3 讨 论
HIF是一种异源二聚体转录因子,具有α和β两部分。HIF-α为活性亚基,HIF-β为结构性亚基。前者通过HIF-1α来体现,后者在细胞内表达稳定〔9〕。在正常氧量条件下,在脯氨酰羟化酶(PHD)的作用下,HIF-1α被羟化,通过线粒体内的泛素蛋白酶结合泛素化进行降解。
HIF-1α作为缺氧适应性反应的主转录调节因子,缺氧状态是其最强调节因素。缺氧情况下,羟化酶受到抑制,进而引起HIF-1α积累,并且通过与HIF-1β结合形成异源二聚体复合物〔10〕。复合物与目的基因启动子缺氧反应元件(HRE)的核心DNA序列结合,激活转录辅助因子,同时与NCOA互相作用,导致活性增加。通过与氧化还原调控蛋白作用后,激活CTAD、NCOA、CREBBP等物质,进一步激活血管内皮生长因子(VEGF)、糖酵解酶等40余个基因,参与多种生物学过程。在实体肿瘤中,由于肿瘤细胞生长速度较快,超过血管生成速度,因此在肿瘤细胞内,乏氧状态为其常见状态。肿瘤细胞为适应缺氧情况,多种细胞因子表达增高,其中最重要的就是HIF-1α。目前已经证明HIF-1α在包括肺癌〔11〕、胃癌〔12〕、乳腺癌〔13〕等多种类型的肿瘤中过度表达。本研究发现,HIF-1α在大肠癌中阳性表达率为42.7%。HIF-1α的表达与脉管侵犯关系密切,与不同性别、年龄、肿瘤细胞分化程度、浸润深度、神经侵犯及淋巴转移这些病理特征无关。
葡萄糖为细胞进行代谢并产生能量的主要物质来源,参与多种细胞活动以及功能的调节。正常有氧条件下,葡萄糖通过转化为丙酮酸后进入三羧酸循环,经过氧化磷酸化提供能量。但在缺氧条件下,主要提供能量的途径更改为糖酵解途径,仅少量丙酮酸经三羧酸循环供能。在整个供能过程中,葡萄糖转运过程作用关键,Glut家族在此过程中起着关键作用。Glut-1为葡萄糖转运蛋白家族的一员,参与多种生物学过程。Glut-1是第一个被描述的葡萄糖转运因子,是组织细胞跨膜转运葡萄糖的重要载体。Glut-1对葡萄糖具有强亲和力,确保细胞在低浓度葡萄糖的状态下,依然能够转运葡萄糖〔14〕。Glut-1在胚胎早期和哺乳期表达水平较高。哺乳后及成年以后,脑组织外,Glut-1表达明显下降。但在恶性程度较高的肿瘤组织中,葡萄糖进入细胞内改变为一种被动过程,Glut-1的表达明显增高,目的是将更多的葡萄糖跨细胞膜转运入肿瘤细胞内,从而确保葡萄糖的摄取,促进葡萄糖的利用〔15〕。研究显示,在肝癌〔16〕、胰腺癌〔17〕等有糖酵解机制的肿瘤中均表现出Glut-1过表达。本研究发现,Glut-1在大肠癌中阳性表达率为53.1%;Glut-1表达与脉管侵犯有关,与其他临床病理特征无关(如性别、年龄、分化程度,浸润深度、神经侵犯及淋巴转移)。
Wincewicz等〔18〕研究发现HIF-1α与Glut-1在结肠癌肿瘤组织中表达增高,这一结论与我们的研究结论相一致,不同的是Wincewicz等〔18〕并未发现HIF-1α与Glut-1两者的表达与脉管侵犯相关。武雪亮等〔19〕通过对50例结直肠癌患者肿瘤组织进行检测,发现Glut-1、HIF-1α 的表达阳性率均与结直肠癌浆膜浸润、分化程度、TNM 分期、淋巴转移、肝转移及脉管浸润有关。在我们的研究中,并未发现HIF-1α与Glut-1的表达与不同性别、年龄、肿瘤细胞分化程度,浸润深度、神经侵犯及淋巴转移相关。Chen等〔20〕研究发现HIF-1α 在大肠癌肿瘤组织中显著降低,而且与肿瘤浸润深度、淋巴结受累和转移显著相关,认为HIF-1α在大肠癌的发生发展中起着抑癌作用。这一结果与我们的研究结果相矛盾。分析与以上结果不同的原因可能为样本量及样本质量的差异,同时纳入标准间仍存在不同,需要通过扩大样本量,同时进行细胞动物等实验进一步确认以上实验结果。
脉管侵犯是消化道肿瘤常见的临床病理特征,主要是肿瘤细胞突破黏膜上皮侵入淋巴管和血管。侵入脉管的肿瘤细胞部分抵抗免疫系统的攻击,与白细胞、血小板等形成聚合物,产生癌栓,加重肿瘤细胞缺氧状态〔21〕。同时,新生淋巴管和血管产生,来适应肿瘤细胞的缺氧状态及能量代谢。我们的研究发现HIF-1α与Glut-1的高表达均与大肠癌细胞的脉管侵犯密切相关。进一步通过数据分析,我们发现HIF-1α与Glut-1在大肠癌中的表达关系密切,呈强正相关。可能的机制为肿瘤情况下,大肠癌细胞处于缺氧及能量代谢异常情况,为适应缺氧HIF-1α 大量表达,产生多种细胞因子如VEGF,进而促进新生血管的生成,改善缺氧状态。无氧糖酵解因素,Glut-1也出现大量表达,提高葡萄糖的利用,增加能量代谢。同时HIF-1α与Glut-1两者具有协同作用,共同应对缺氧等异常情况的发生。
综上所述,HIF-1α和Glut-1在大肠癌组织中的表达增高与肿瘤脉管侵犯有关,通过对两者的研究,可以为大肠癌的诊断及治疗提供指导依据。

