金钗石斛多糖对肝纤维化大鼠TGF-β1、α-SMA、Ⅰ型胶原、Ⅲ型胶原表达的影响
安祯祥 何远利 黄丹 唐东昕 王敏 王芳
(贵州中医药大学第一附属医院,贵州 贵阳 550001)
肝纤维化(HF)是细胞外基质(ECM) 异常增生与过度沉积所导致的肝组织结构和功能异常的病理变化〔1〕。HF是各种慢性肝病向肝硬化、肝癌发展的重要环节〔2〕。HF可逆转,而肝硬化失代偿期很难逆转,因此HF的逆转治疗是肝病治疗关键环节。HF的分子病理生理机制研究方兴未艾,但是针对肝星状细胞(HSC)的研究一直都是热点和重点〔3〕。HSC活化后表达α-平滑肌肌动蛋白(α-SMA),大量合成分泌ECM,促进HF形成,因此HSC的激活是HF发生至关重要的节点。中药治疗HF有疗效肯定,多途径、多环节和多靶位的作用机制是其优势。通过中药寻找抗HF药物是目前研究的热点〔4〕。赤水金钗石斛是贵州省道地药材,为滋阴要药。金钗石斛多糖(DNP)是从多年生兰科植物金钗石斛中提取的多糖类物质,安全、毒性低〔5〕,具有调节免疫、保肝、抗氧化、抗炎和抗肿瘤作用〔6〕。本课题组前期研究发现,DNP能降低HF大鼠血清谷丙转氨酶、谷草转氨酶、肝纤四项水平,降低丙二醛(MDA)水平,提高超氧化物歧化酶(SOD)含量,下调转化生长因子(TGF)-β1、基质金属蛋白酶组织抑制剂(TIMP)-1 mRNA表达,上调基质金属蛋白酶(MMP)13 mRNA 表达,具有拮抗HF的作用〔7,8〕。本研究通过复制大鼠HF模型,检测大鼠肝组织与HF进展关系密切的TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白的表达,探讨DNP抗HF的作用机制。
1 材料与方法
1.1动物 SPF级SD大鼠,雌雄各半,体重(180±20)g,购自重庆腾鑫比尔实验动物销售有限公司,动物许可证号:SCXK(渝)2012-0005,合格证号No 0004866。
1.2药品及试剂 金钗石斛生药购自贵州赤水,经贵州中医药大学药学院生药实验室王祥培教授鉴定为金钗石斛Dendrobium nobile的茎;经过干燥,采用水提醇沉法提取多糖〔9〕(贵州中医药大学一附院制剂中心制备),浓度2 g/ml;秋水仙碱片(云南玉溪生物制药,批号H53021904);扶正化瘀胶囊(上海黄海制药,批号Z200220073);四氯化碳(天津市光复科技发展有限公司,批号20120506);TGF-β1抗体(美国immunoway公司,批号YM3438);α-SMA抗体 (美国immunoway公司,批号YT5053);Ⅰ型胶原抗体(美国Proteintech公司,批号14695-1-AP);Ⅲ型胶原抗体(北京博奥森生物技术有限公司,批号bs-0549R);免疫组化染色试剂盒(河南赛诺特生物技术有限公司);Trizol 试剂、聚合酶链反应(PCR)试剂盒及逆转录试剂盒均购自北京康为世纪生物科技有限公司。
1.3主要仪器 BX51显微镜(日本奥林巴斯公司);CFX96 Real-Time System荧光定量PCR仪(美国Bio-Rad公司);NANODROP 2000紫外分光光度计(美国Therno scientific公司);低温高速离心机Heraeus Multifuge X1R(美国赛默飞世尔公司)。
1.4分组、造模、给药及采样 大鼠按性别随机分为:正常组、模型组、秋水仙碱组(0.2 mg/kg),扶正化瘀组(0.415 g/kg),DNP低、中、高剂量组(5、10、20 g/kg),考虑造模存在大鼠死亡情况,正常组为10只,其余各组各12只。采用文献方法造模〔10〕,50%四氯化碳(CCL4)橄榄油溶液(1.5 ml/kg)腹腔注射,2次/w,第2周开始30%酒精(10 ml/kg)灌胃,隔日1次。正常组予等量橄榄油腹腔注射和生理盐水灌胃。造模8 w。第9周起分别给予对应药物(10 ml/kg)灌胃,1次/d,给药4 w,正常组及模型组灌胃生理盐水。每周按体重改变药物剂量。给药结束后采样,禁食12 h,处死大鼠,取肝脏组织行苏木素-伊红(HE)、Masson染色、组化、PCR检查。
1.5病理学检查 肝组织甲醛固定,石蜡包埋切片,HE、Masson染色,光镜下观察病理组织学变化。用Image J软件计算肝纤维组织胶原容积分数(胶原阳性的蓝色面积与组织总面积的百分比)。
1.6免疫组化法检测肝组织中TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白的表达 石蜡切片常规脱蜡,梯度酒精水化,微波抗原修复,3 %H2O2室温去除内源性过氧化物酶,羊血清封闭,加一抗TGF-β1(1∶400)、α-SMA(1∶100)、Ⅰ(1∶1 000)、Ⅲ(1∶400)型胶原,4℃冰箱过夜,加二抗工作液,二氨基联苯胺(DAB)显色,苏木素复染,脱水、透明、中性树胶封片,光镜下采集图片。以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。以表达棕黄色为阳性,以不着色为阴性。使用Image J软件计算蛋白表达的平均光密度值进行统计分析。
1.7qRT-PCR检测肝组织Ⅰ、Ⅲ型胶原 mRNA表达 Trizol法提取样本总RNA,测定RNA浓度,检测RNA完整性,逆转录为cDNA。PCR反应体系:SYBR Green Ⅰ 10 μl,上游引物0.75 μl,下游引物0.75 μl,ddH2O 12.5 μl,cDNA 1 μl。将各反应管放入PCR 仪。引物由生工生物工程(上海) 股份有限公司合成。引物序列:Ⅰ型胶原蛋白(167 bp):上游5'-CAGTGGCGGTTATGACTTCAG-3',下游5'-GGCTGCGGATGTTCTCAATC-3';Ⅲ型胶原蛋白(224 bp):上游5'-GCCTTCTACACCTGCTCCT-3',下游5'-CCACTCCAGACTTGACATCATAT-3';GAPDH(252 bp):上游5'-ACAGCAACAGGGTGGTGGAC-3',下游5'-TTTGAGGGTGCAGCGAACTT-3'。扩增条件:95℃ 30 s,95℃5 s,60℃ 30 s,40个循环。以GAPDH为内参基因,采用2-△△Ct法来计算目的基因mRNA的相对含量。
1.8统计学处理 采用SPSS20.0软件进行单因素方差分析、LSD检验。
2 结 果
2.1HE染色结果 正常组肝小叶结构完整,无明显的纤维组织增生。与正常组比较,模型组肝索排列紊乱,肝细胞变性、坏死,见大量炎细胞浸润,明显的纤维组织增生,正常肝小叶结构破坏。与模型组比较,DNP低、中、高剂量组、秋水仙碱组、扶正化瘀组的纤维化有不同程度的减轻。见图1。
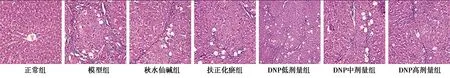
图1 DNP对HF大鼠肝组织病理学变化的影响(HE,×200)
2.2Masson染色情况 正常组肝小叶结构完整,汇管区和中央静脉区有少许蓝染胶原纤维。与正常组比较,模型组汇管区、中央静脉区见大量增粗、增大蓝染胶原纤维,纤维间隔明显增大、变宽。与模型组比较,各给药组蓝染胶原纤维变细、变小,纤维间隔缩小、变窄。见图2。正常组比较,模型组胶原容积分数明显增加(P<0.01);与模型组比较,各给药组胶原容积分数均有明显减少(P<0.01);与秋水仙碱组比较,DNP高剂量组胶原容积分数显著减少(P<0.05);与扶正化瘀组比较,DNP中、高剂量组胶原容积分数显著减少(P<0.05)。见表1。
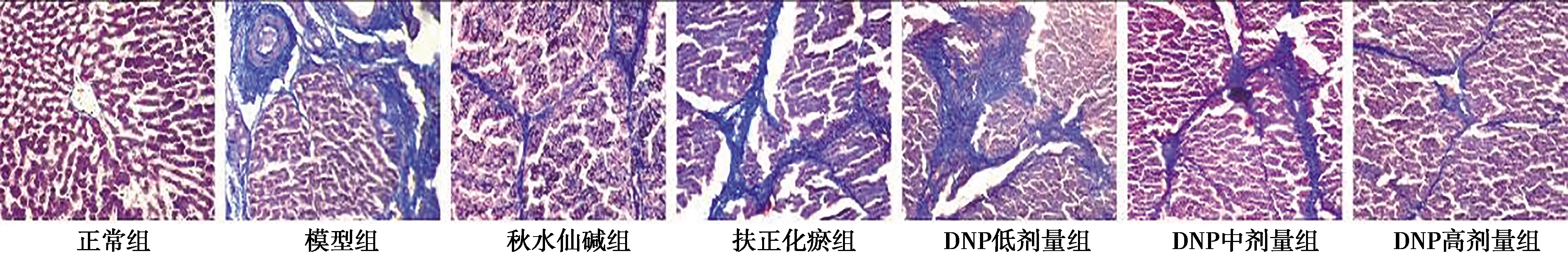
图2 DNP对HF大鼠肝组织病理学变化的影响(Masson,×200)
表1 DNP对HF大鼠肝组织胶原容积分数、TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白表达及Ⅰ、Ⅲ型胶原mRNA表达的影响
2.3DNP对HF大鼠肝组织TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白表达的影响 正常组肝组织汇管区和中央静脉区见少量TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白表达。与正常组比较,模型组TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白着色明显加深、增多,具有统计学差异(P<0.01),TGF-β1多分布于胞浆、汇管区,α-SMA、Ⅰ、Ⅲ型胶原蛋白多见于汇管区,与胶原纤维的分布呈一致性;与模型组比较,各给药组TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原蛋白着色面积均有明显减少、降低,具有统计学差异(P<0.01);与秋水仙碱组比较,DNP中、高剂量组TGF-β1、α-SMA蛋白表达无差异(P>0.05),DNP高剂量组Ⅰ、Ⅲ型胶原表达无差异(P>0.05);与扶正化瘀组比较,DNP高剂量组TGF-β1蛋白表达有差异(P<0.05),DNP中、高剂量组α-SMA蛋白表达无差异(P>0.05),DNP高剂量组Ⅰ型胶原表达有差异(P<0.05),DNP中、高剂量组Ⅲ型胶原表达无差异(P>0.05)。见表1、图3~6。
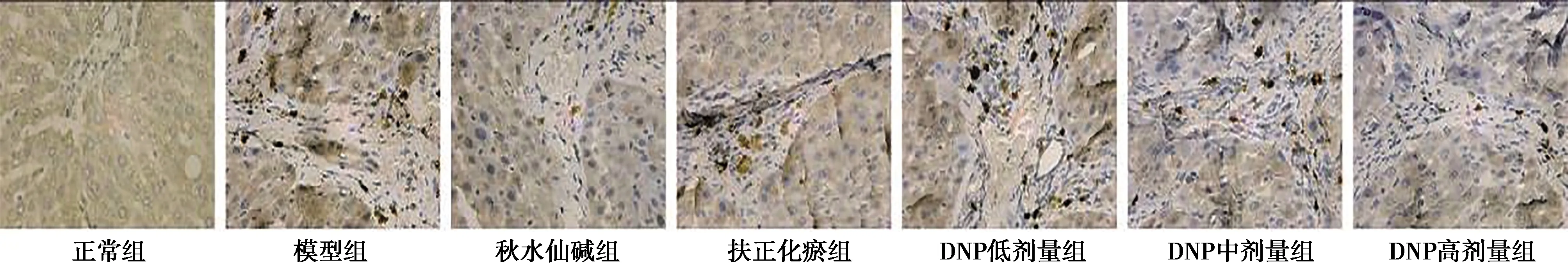
图3 DNP对HF大鼠肝组织TGF-β1蛋白表达的影响(免疫组化,×200)

图4 DNP对HF大鼠肝组织α-SMA蛋白表达的影响(免疫组化,×200)
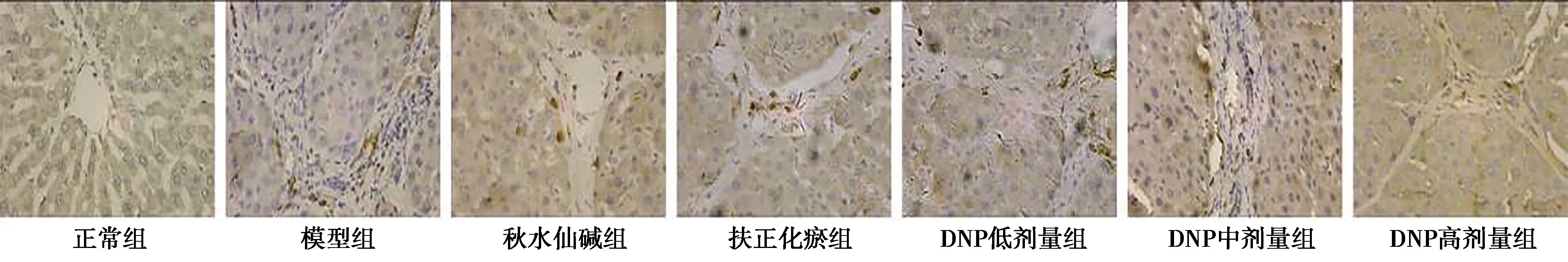
图5 DNP对HF大鼠肝组织Ⅰ型胶原蛋白表达的影响(免疫组化,×200)

图6 DNP对HF大鼠肝组织Ⅲ胶原蛋白表达的影响(免疫组化,×200)
2.4DNP对HF大鼠肝组织Ⅰ、Ⅲ型胶原mRNA表达的影响 与正常组比较,模型组Ⅰ、Ⅲ型胶原mRNA表达明显升高(P<0.01);与模型组比较,各给药组Ⅰ型胶原mRNA表达均有明显下降(P<0.05),Ⅲ型胶原除外DNP小剂量组外,其余各给药组亦有明显下降(P<0.01);与秋水仙碱组、扶正化瘀组比较,DNP各组相比Ⅰ、Ⅲ型胶原mRNA表达无明显统计学差异(P>0.05)。见表1。
3 讨 论
HF属中医“肝积”“积聚”“胁痛”等范畴。HF时肝细胞坏死增加,修复能力下降,肝星状细胞激活,增殖能力上升,分泌合成大量间质,肝细胞与肝星状细胞关系失调。因此在治疗上需要加强肝细胞自身修复能力,抑制肝星状细胞活化。在HF过程中,肝肾阴虚是其重要证型,养阴柔肝是重要的治疗法则〔11~17〕。HF以ECM的过度沉积为主要特征,Ⅰ、Ⅲ型胶原是ECM的主要成分,因而调控胶原代谢则影响HF的进程。秋水仙碱可增加Ⅰ、Ⅲ型胶原蛋白的降解,具有抗HF的作用〔18〕,扶正化瘀胶囊能调节TGF-β1/Smad通路,影响Ⅰ型前胶原和α-SMA的表达而抗肝纤维化,故设置秋水仙碱和扶正化瘀胶囊为对照。肝组织病理检查仍然是诊断肝纤维化的金标准。本研究通过四氯化碳联合灌胃酒精8 w,HE、Masson染色,模型组可见明显的纤维组织增生,正常肝小叶结构破坏,形成假小叶。DNP干预后肝组织纤维化均有不同程度的减轻,说明DNP具有一定的抗肝纤维化作用。
HSC激活增殖,合成分泌大量ECM,是HF时ECM的主要细胞来源,是HF的细胞学基础〔19,20〕。在HF形成过程中,肝细胞旁分泌的TGF-β1可结合HSC表面的相应受体,活化HSC,特异性表达α-SMA,上调ECM表达,活化的HSC又可自分泌TGF-β1,进一步激活HSC,通过肝细胞的旁分泌、HSC的自分泌形成正反馈,大量合成分泌ECM,诱导HF形成〔3〕。TGF-β1是HSC活化的关键细胞因子,TGF-β1促进HSC合成ECM,减少ECM的降解,加速HF的发展进程〔21〕。亦可通过TGF-β1/Smad信号通路调控HSC增殖活化,影响ECM的沉积。ECM持续过度沉积,肝脏结构破坏,形成假小叶,影响肝脏循环系统,进而发展成肝硬化。ECM以Ⅰ、Ⅲ型胶原为主,HF早期以Ⅲ型胶原增加明确,后期主要是Ⅰ型胶原增加,主要沉积于汇管区〔22,23〕。Ⅰ、Ⅲ型胶原是胶原代谢的重要参数,是判断抗肝纤维化药物疗效的依据。α-SMA多表达于纤维间隔、汇管区,α-SMA表达上升提示HSC活化〔24,25〕,细胞体外实验表明,HSC合成ECM的量是肝细胞的10多倍,是窦状隙内皮细胞的20余倍〔4〕。检测TGF-β1、α-SMA、Ⅰ、Ⅲ型胶原在肝组织的表达,可判断肝纤维化的程度〔26,27〕。因此抑制TGF-β1、α-SMA、Ⅰ、Ⅲ胶原蛋白的表达,是抗HF的重要节点。

