基于肝X受体探讨健脾祛痰法对高脂血症大鼠肝内胆固醇代谢通路的影响
洪诗晓,李墨辞,涂文玲,郭明章
(福建中医药大学 中医学院,福建 福州 350122)
近年来,高胆固醇血症成为动脉粥样硬化(Atherosclerosis,AS)的高危因素,而AS可进一步导致冠心病、脑卒中等高危疾病[1]。研究发现,我国成人高脂血症的患病率逐渐升高,已达20%,且该症患病人群有年轻化趋势[2]。西医临床多以他汀类、贝特类等为主要抗脂手段,长期服用则出现肌肉疼痛、横纹肌溶解、痉挛等副作用,而中药具有副作用低、疗效显著、愈后良好的优势。因此,明确高胆固醇血症的发病机理,寻找安全有效的中医药治疗高脂血症的方法为临床迫切所需。
肝X受体(Liver X receptor,LXR)作为核受体,它在肝组织、肠道以及其他组织中广泛存在,目前普遍认为,其表达是调节体内脂质代谢的重要途径之一。LXR中的亚型之一,LXRα促进胆汁酸合成,从而降低血脂的作用途径,主要通过前反馈激活CYP7A1导致胆汁酸合成增加[3]。LXR还可通过影响下游因子ABCG5、ABCG8的表达,促进胆固醇直接排入胆汁以助胆固醇排出体外[4]。近年来的研究表明,中医运用健脾祛痰法治疗高脂血症及其引发的心血管疾病,与LXR通过对下游因子的影响作用,促进肝脏中胆固醇分解代谢并排出体外的途径较为相似。其中,健脾祛痰法经典方温胆汤化裁方在改善血液脂质水平,抵抗血液黏稠凝聚等疗效明显,但其具体作用机理尚未明确[5-7]。因此,本课题以LXR为切入点,探索健脾祛痰法对肝内胆固醇分解代谢及排出通路的影响机制,以期深入研究其代谢途径,并为今后用药提供理论依据。
1 材料与仪器
1.1 实验动物
40只SPF级健康雄性SD大鼠,体质量(180±20)g,购自上海吉辉实验动物饲养有限公司(许可证号:SCXK(沪)2017-0012)。动物饲养于福建中医药大学SPF级动物实验中心,照明周期以12 h/12 h交替,换气频率为10~20次/h,温度(23±2)℃。每组动物均自由饮水。本课题通过福建中医药大学实验动物伦理委员会审查,批准文号:FJTCM IACUC 2020069。
1.2 药物及饲料
本课题方药温胆汤化裁方药物均购自福建中医药大学附属第三人民医院中药房,组成为:薏米30 g、茯苓30 g、浙贝10 g、竹茹10 g、扁豆10 g、枳壳10 g、桔梗15 g、陈皮5 g、甘草5 g。配置方法:用蒸馏水将中药材水煎30 min,提取两次。将两次煎液混合后用双层纱布过滤,待药液中无明显杂质后,水浴加热蒸发浓缩,该药液配置完毕后需置于4℃冰箱保存,每次取用时须放置至常温,方可进行灌胃。给药剂量:温胆汤化裁方3组灌药的剂量通过人与大鼠体表面积比率换算法计算为6 g/kg、12 g/kg、25 g/kg。其余两组分别按相应比例蒸馏水代替温胆汤化裁方灌服,每次用药体积均按1 mL/100 g计算,本次实验给药与造模同时进行。本课题使用的高脂饲料均购自上海帆泊生物技术有限公司,配方见表1。

表1 高脂饲料配方
1.3 主要试剂及仪器
1.3.1 试剂 主要试剂或试剂盒如下:大鼠胆固醇7a羟化酶(CYP7A1)、G5(ABCG5)、G8(ABCG8)试剂盒。江苏酶免(SOD)、(MDA)试剂盒(TBA法)、江苏酶免(GSH-PX)试剂盒(比色法)(江苏酶免实业有限公司,批号如下:MM-0685R1、MM-70740R1、MM-70743R1、A001-3-2、A003-1-2、A005-1-2)。Trizol (RNA 提取试剂盒)、cDNA一链合成试剂盒、Gelred、SYBR Green荧光定量试剂盒(Vazyme公司,批号分别为:R401-01、R123-01、GR501-01、Q311);PCR Mix、DNA maker II(北京艾德莱公司,批号分别为:PC0903、DM0702)。
1.3.2 仪器 本研究使用仪器见表2。
表2 主要实验仪器
2 方法
2.1 分组、造模与给药
40只大鼠分开适应性喂养7 d后,按体质量随机平均分配为5组,分组情况和每组饲养情况见表3。
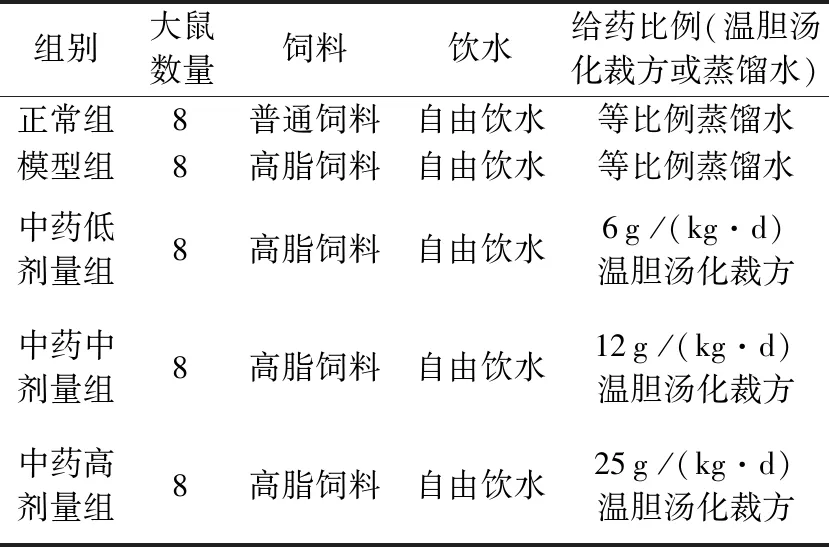
表3 大鼠分组情况
2.2 给药方法及标本采集
从造模第一天起同时给药,按1 mL/100 g鼠体质量的比例计算药量。连续灌胃4周,取材前一晚禁食不禁水。20%乌拉坦(0.6 mL/100 g)腹腔注射麻醉,待麻醉后经腹主动脉取血,分离血清以便后续实验使用;迅速取下肝左叶同样部位组织,部分置于冻存管中保存于-80 ℃冰箱待测,部分置于4%多聚甲醛液中固定备用。
2.3 检测指标及检测方法
2.3.1 血清脂质含量 测定血清TC、TG、HDL、LDL 的含量:血液常温静置2 h,3 000 r/min离心10 min,抽取上清液,全自动生化分析仪检测上清液相关指标。
2.3.2 肝功及病理指标检测 使用生化检测方法对肝组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)和脂质过氧化物(MDA)的病理指标进行检测。
2.3.3 肝脏形态学观察 将已固定的肝组织进行包埋、切片、HE染色,光学显微镜下观察其病理形态。
2.3.4 分子生物学检测 采用qPCR方法对LXRαmRNA表达水平进行测定。取适量肝组织进行碾磨,提取RNA,用紫外分析仪测其浓度与纯度。进行PCR扩增时以mRNA逆转录的cDNA为模板。反应体系为:TB Green Ex Taq(TilRaseH Plus)(2x)10 μL、ROX Reference Dye Ⅱ(50x)0.4 μL,上下游引物各0.8 μL,ddH2O 6 μL,cDNA 2 μL。反应条件为:90 ℃ 30 s、90 ℃ 10 s、60 ℃ 30 s、95 ℃ 15 s、60 ℃ 1 min,40个循环。按照反转录试剂盒上的说明进行操作,其中,引物序列见表4。

表4 引物序列
2.3.5 ELISA法检测肝组织中CYP7A1、ABCG5和ABCG8的蛋白表达水平 分组、加样、温育、显色等操作按说明书依次进行。终止反应后用450 nm 波长测量各孔的吸光度(OD值)。
2.4 统计学方法
3 结果
3.1 大鼠体质量变化情况
实验期间,正常组大鼠体型匀称,皮毛顺滑光泽,活动灵活,性情较为温顺;模型组大鼠体型肥胖,行动较为懒惰,与正常组相比皮毛较为暗淡蓬乱,易被激怒。各组大鼠体质量变化见表5。实验末期,模型组大鼠体质量增长速度高于正常组大鼠(P<0.01)。与模型组比较,低剂量组大鼠体质量增长无差异,中、高剂量组体质量增量降低(P<0.01)。
表5 各组大鼠体质量增量比较
3.2 各组大鼠血清TC、TG、HDL、LDL 含量变化
与正常组比较,模型组TC、TG、LDL急剧上升(P<0.001,P<0.001,P<0.05),HDL急剧下降(P<0.001),这提示模型构建成功。与模型组比较,低剂量组TG明显降低(P<0.001)。中、高剂量组TC、TG显著降低(P<0.01,P<0.001)、LDL各自有不同程度的下降(P<0.05,P<0.001)、HDL显著增高(P<0.001),差异具有统计学意义。这表明温胆汤化裁方在不同剂量时,均有相应的降脂效果。见表6。
表6 各组大鼠血清TG、TC、HDL、LDL含量比较
3.3 各组大鼠肝组织中SOD、GSH-PX、MDA的比较
模型组MDA明显上升(P<0.001),SOD、GSH-PX显著下降(P<0.001)。低剂量组有所下降,但差异并无统计学意义。中、高剂量组MDA随着药物剂量的增长,其结果呈逐渐下降趋势(P<0.01,P<0.001),而SOD、GSH-PX也随药物剂量的增加呈现不同程度的上升趋势(P<0.01,P<0.001)。见表7。
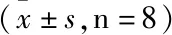
表7 各组大鼠肝组织SOD、GSH-PX、MDA水平组间比较
3.4 各组大鼠肝脏组织形态学变化
正常组大鼠细胞排列呈以中央静脉为圆心的条索状,无空洞,细胞结构完整,未见异常凋亡,无明显脂肪样变性。模型组大鼠细胞排列凌乱,难以辨认细胞边界和肝小叶形态,细胞可见坏死或脂质样改变、中性粒细胞浸润,且出现大量空洞;与模型组比较,各治疗组均有所改善,其中,以高剂量组病理改善效果为佳。见图1。
3.5 各组大鼠肝组织中LXRαmRNA表达水平变化
模型组LXRαmRNA表达相对于正常组降低(P<0.05)。与模型组比较,低、中、高剂量组LXRαmRNA水平变化随着给药浓度增加而增加,其中,低、中剂量组差异无统计学意义,高剂量组LXRαmRNA表达水平则显著增加(P<0.01)。见表8。

注:A为正常组,B为模型组,C为低剂量组,D为中剂量组,E为高剂量组。图1 温胆汤化裁方对高胆固醇血症大鼠肝组织形态学变化的影响(HE,×400)
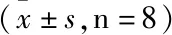
表8 各组大鼠肝组织中LXRαmRNA表达水平的变化
3.6 各组大鼠肝组织中CYP7A1、ABCG5和ABCG8的蛋白表达水平变化
与正常组比较,模型组大鼠肝组织CYP7A1、ABCG5和ABCG8的蛋白表达水平均明显降低(P<0.001,P<0.05,P<0.001)。与模型组比较,低剂量组CYP7A1、ABCG5的蛋白表达水平明显增高(P<0.01),ABCG8的蛋白表达水平无统计学意义(P>0.05);中、高剂量组CYP7A1、ABCG5和ABCG8蛋白表达水平明显上升(P<0.05,P<0.01,P<0.001)。见表9。
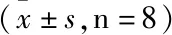
表9 各组大鼠肝组织中CYP7A1、ABCG5和ABCG8的蛋白表达水平变化
4 讨论
在传统中医理论中,虽无明确高脂血症病名,但在论述此类病症时,多以“膏”“痰”“湿”表述[8]。当体内脏腑阴阳不平衡时,气血津液的生化代谢也会出现障碍,最后聚积成为痰湿。在中医理论中,生痰之源为脾胃,若脾胃阴阳失调,功能不健,则津液积聚不能代谢,最后成为痰湿脂膏入血脉,脂质含量必然随之增高。因此有医家提出,高脂血症虽病位在血液,但其致病本质还在于脾胃失调,不能运化黏稠的代谢产物,最终堆积则为血浊,堵塞脉道。
本病脾胃为虚,痰浊脂膏为实,证属本虚标实,治疗当以健运脾胃、祛痰化湿。通过增强脾胃运化的功能,使得积聚的痰湿脂膏运化排出,则高脂血症得以改善。这种治法,与现代医学研究中通过调控LXR对下游因子的影响,促进肝脏中胆固醇分解代谢并排出体外的途径非常相近。从研究结果看,①模型组大鼠的TC、TG、LDL均显著增高,且HE染色结果显示其肝组织细胞出现脂质变性,说明在高脂饲料喂养下,该组大鼠体内胆固醇出现病理性堆积,进一步出现高胆固醇血症,而通过温胆汤化裁方干预的大鼠,其TC、TG、LDL均有不同程度的降低,其中,高剂量组效果最为明显。这表明温胆汤化裁方可有效减少大鼠肝组织脂肪变性,帮助脂质代谢,从而防治高胆固醇血症;②从qPCR结果看,模型组大鼠LXRαmRNA表达水平明显降低,通过药物干预后,LXRαmRNA表达水平逐步上升,其中,高剂量组的效果最为明显。这说明温胆汤化裁方可有效提高LXRαmRNA表达水平,促进其激活CYP7A1,导致胆汁酸合成增加,使胆固醇向胆汁酸转化,从而达到降低血脂的目的;③从CYP7A1、ABCG5和ABCG8的蛋白表达水平的变化结果看,模型组大鼠表达均降低,而中药组大鼠表达则逐渐上升,数据显示温胆汤化裁方中、高剂量组的蛋白表达水平均增加明显。这表明在温胆汤化裁方干预下,限速酶CYP7A1增强自身表达,促进了胆固醇合成为胆汁酸。ABCG5和ABCG8表达的增强也对胆固醇向胆汁中排放具有推动作用,从而达到降低体内脂质的目的[9-12]。
因此,本研究探讨健脾祛痰法,研究其对LXR通路的影响机制,并在选方上选用了以理气化痰、和胃利胆为主的温胆汤化裁方。在原方半夏、竹茹、枳实、陈皮、甘草、茯苓的基础上减半夏,加浙贝、扁豆、薏米、桔梗。方中浙贝、竹茹、陈皮、桔梗、枳壳祛痰理气,茯苓、扁豆、薏米、甘草健脾祛湿。全方以脾胃痰湿较盛之多见证候而立,可改善血液浓、黏、凝、聚状态[13-17],临床上适应人群较广,副作用低,适合长期服用,对于高脂血症的临床具有未病防治、既病防变的独特优势。
综上,本研究结果表明:温胆汤化裁方可有效降低肝组织脂质变性,增强胆汁酸合成,促进胆固醇向胆汁中排放,从而有效防治高脂血症。其作用机制与上调CYP7A1表达,促进胆汁酸转化,上调ABCG5和ABCG8的蛋白表达,促进胆固醇排放有关。相比于临床上运用西药治疗,该方效果明显,且副作用少、不良反应小,对治疗高脂血症,降低心脑血管疾病有防治作用。

