萝卜赤霉素生物合成和信号转导相关基因的全基因组鉴定及表达分析
阳文龙,李锡香,张晓辉,宋江萍,贾会霞,王海平
(中国农业科学院 蔬菜花卉研究所,北京 100081)
萝卜(RaphanussativusL.) 是我国最重要的蔬菜之一。我国常年萝卜种植面积约120 万hm2,总产量超过4 000万t[1],可以生食、炒食、煮食、腌渍、制干等,在蔬菜周年供应中占有很重要的地位。但是在生产上普遍存在冬春栽培和高寒地区夏季栽培出现先期抽薹开花现象,从而影响萝卜的产量和品质。赤霉素(Gibberellin,GA)途径是植物六大开花调控途径之一,对植物的生殖生长起着重要作用[2]。许多研究表明,赤霉素的生物合成与代谢是多种酶参与的多步骤酶促反应过程,通过这些酶的编码基因的表达精确调节赤霉素合成与代谢速率[3-5]。高等植物中赤霉素是由古巴焦磷酸合成酶 (ent-Copalyldiphosphate synthase,CPS)、内根-贝壳杉烯合成酶 (ent-Kaurene synthase,KS)、内根-贝壳杉烯氧化酶 (ent-Kaurene oxidase,KO)、内根-贝壳杉烯酸氧化酶 (ent-Kaurenoic acid oxidise,KAO)、GA 20-氧化酶 (GA 20-oxidase,GA20OX)、GA 3-氧化酶 (GA 3-oxidase,GA3OX)等参与合成的[6]。其中,GA20OX和 GA3OX受活性GA的负反馈调节[7-8]。GA 2-氧化酶 (GA 2-oxidase,GA2OX)是 GA降解过程中的关键酶,它可以使植物体内具有生物活性的 GAs及其前体和其他中间产物分解失活,进而保持植物体内具有生物活性的 GAs和中间体之间的平衡[9]。GA20OX和 GA3OX缺失,合成有生物活性 GA的量减少,同样,过表达GA2OX则降解了植物体内生物活性的 GA,导致矮化表型[10-11]。到目前为止,CPS、KS、KO、KAO、GA20OX、GA3OX和GA2OX 等基因已在多个物种中报道,如拟南芥[12-13]、水稻[4,14]等。植物体内GA信号传导途径一般认为是基于GA-GID1-DELLA复合体的形式[15-16]。作为GA的受体,GID1可以与GA结合后引起构象改变,从而与DELLA蛋白发生互作形成GA-GID1-DELLA复合体。该复合体易被E3泛素连接酶SCF复合体F-box亚基识别,引导DELLA蛋白被26S蛋白酶体水解,从而解除DELLA蛋白对植物生长的抑制作用[15-17]。DELLA蛋白是植物特异的转录调控因子GRAS家族的一个亚族,定位于细胞核内[18-19],是植物细胞内GA信号转导途径中的关键负调控因子[20-23]。在拟南芥中,基因组共编码5种不同功能的DELLA蛋白(GAI、RGA、RGL1、RGL2、RGL3)对植物生长的不同生物过程起作用,而它们均对GA应答起抑制作用[21,24-28]。GA受体基因GID1编码一个水溶性蛋白,与激素敏感脂酶 (Hormone sensitive lipase)家族具有同源性[29]。活性GA与GID1蛋白结合后,引起GID1构象发生改变,GA-GID1复合体上表面便可以与DELLA蛋白的TVHYNP基序结合,形成GA-GID1-DELLA复合体[30-33]。在缺乏GA的情况下,DELLA蛋白得到富集并抑制GA应答及相关生物过程。F-box蛋白是E3泛素连接酶SCF(SKP1、CULLIN、F-box)蛋白复合体的一个亚基,能够催化泛素链与靶蛋白结合,并通过泛素/26S蛋白酶体途径降解靶蛋白[34]。酵母双杂交结果表明,GA-GID1-DELLA复合体可以诱导DELLA蛋白的GRAS域发生构象变化,促进F-box蛋白SLY1/GID2与DELLA的VHIID和LHRII基序相互识别[35]。接着SCFSLY1/GID2复合体便促进泛素化,引导DELLA蛋白被26S蛋白酶体水解[36-37],DELLA蛋白对植物相关生物过程的抑制作用被解除,即GA通过调控蛋白酶体水解DELLA蛋白来调控植物的株高和生长发育。目前,赤霉素代谢和信号转导相关基因在拟南芥和水稻等植物中得到了广泛深入的研究,但是在萝卜上还没有相关的报道。
本研究对萝卜赤霉素生物合成和信号转导相关基因CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、 RGA、RGL、GID1、SKP2等进行了鉴定,并检测其在萝卜不同组织器官和发育时期中的表达特性,以期发掘调控萝卜抽薹开花的关键基因,为深入研究奠定基础。
1 材料和方法
1.1 材料及处理
试验于 2019年8月至2020年5月在北京市海淀区中关村南大街(116°20′E,39°56′N)中国农业科学院蔬菜花卉研究所农场塑料大棚和温室进行,8月15日播种,10月30日移栽到温室。供试材料为北京心里美萝卜和野萝卜,株行距 0.4 m × 0.5 m。选取生长势较为一致的植株,在盛花期分别采集茎、叶、蕾、花、果,用锡箔纸包裹,迅速用液氮冷冻,-80 ℃保存,用于 RNA提取,检测基因表达量。
1.2 萝卜赤霉素相关基因的鉴定与表达分析
1.2.1 萝卜赤霉素相关基因的数据库检索 从萝卜基因组数据库网站(http://radish-genome.org/)下载基因组DNA、cDNA和蛋白质序列数据。根据文献[12-13]获得拟南芥赤霉素相关基因的登录号,并从 TAIR网站(http://www.arabidopsis.org/)下载拟南芥赤霉素相关基因的蛋白序列,用拟南芥中赤霉素相关基因的蛋白质序列在TBtools软件中通过Blast Several Sequences to a Big Database搜索萝卜蛋白质数据库获得候选蛋白质序列,利用Pfam和 NCBI 2个在线网站验证这些候选蛋白质,最后通过基因注释最终确定了46个萝卜赤霉素相关基因,包含CPS 2个,KS 1个,KO 2个,KAO 2个,GA20OX 9个,GA3OX 5个,GA2OX 12个,GAI,RGA各1个,RGL 4个,GID1 3个,SKP2 4个。
1.2.2 染色体位置及理化性质分析 从萝卜基因组数据库网站(http://radish-genome.org/)下载基因定位和基因注释信息,获得候选赤霉素相关基因的染色体位置,利用ExPASy(http://web.expasy.org/protparam/)在线软件分析候选赤霉素相关基因的理化性质。
1.2.3 结构分析及保守结构域分析 从萝卜基因组数据库网站(http://radish-genome.org/)下载萝卜赤霉素相关基因的内含子和外显子分布数据的 gff3文件,利用TBtools软件绘制基因结构示意图。利用 MEME在线软件(http://meme-suite.org/)进行蛋白保守结构域分析,将保守结构域最大基序数量设置为 10个,其余设置为默认参数。
1.2.4 系统进化关系分析 用上述下载得到的拟南芥赤霉素相关基因的蛋白序列,以及萝卜赤霉素相关基因的候选蛋白序列,用 MEGA 7.0软件对拟南芥和萝卜的赤霉素相关蛋白构建系统进化树。采用邻接法(Neighbor-Joining,NJ), 选择参数“ Poisson model” 、 “ Complete deletion” 、Bootstrap= 1 000次进行计算。
1.2.5 启动子顺式作用元件分析及不同组织中的基因表达分析 用TBtools 软件从萝卜基因组数据库中调取赤霉素相关基因的启动子序列(基因编码区上游1 500 bp),利用PlantCARE在线软件对各基因的启动子元件进行预测分析。从数据库(http://radish-genome.org/)下载萝卜不同发育时期和不同器官的赤霉素相关基因的表达数据,利用 TBtools软件作基因表达热图。
1.2.6 早开花和晚开花萝卜材料赤霉素相关基因的表达分析 利用TRIzol(天根公司)法按试剂说明书提取早开花材料心里美萝卜和晚开花材料野萝卜的茎、叶、蕾、花、果等器官的RNA。用反转录试剂盒(天根公司)合成第一链cDNA,以该cDNA为模板,利用表1 中的引物对萝卜赤霉素相关基因的表达情况进行实时荧光定量 PCR检测,采用SYBR Premix Ex Taq Ⅱ 试剂盒(TaKaRa)。PCR 反应体系为20 μL:SYBR Premix Ex Taq 10 μL,正反向引物各0.5 μL,cDNA 模板 2 μL,ROX Reference Dye(50×)0.4 μL,ddH2O 6.6 μL。反应条件为:95 ℃预变性 10 min;然后95 ℃ 10 s,60 ℃ 20 s,40个循环。每份样品3次生物学重复,2次技术重复。以RsGAPDH基因为内参基因,用2-ΔΔCt公式计算各基因的相对表达量。
1.3 数据统计分析
采用 Microsoft Excel 2007(美国,微软公司)进行数据分析。

表1 萝卜赤霉素相关基因的定量PCR引物Tab.1 Quantitative PCR primers for gibberellin related genes in radish

表1(续)
2 结果与分析
2.1 萝卜赤霉素相关基因的鉴定和理化性质分析
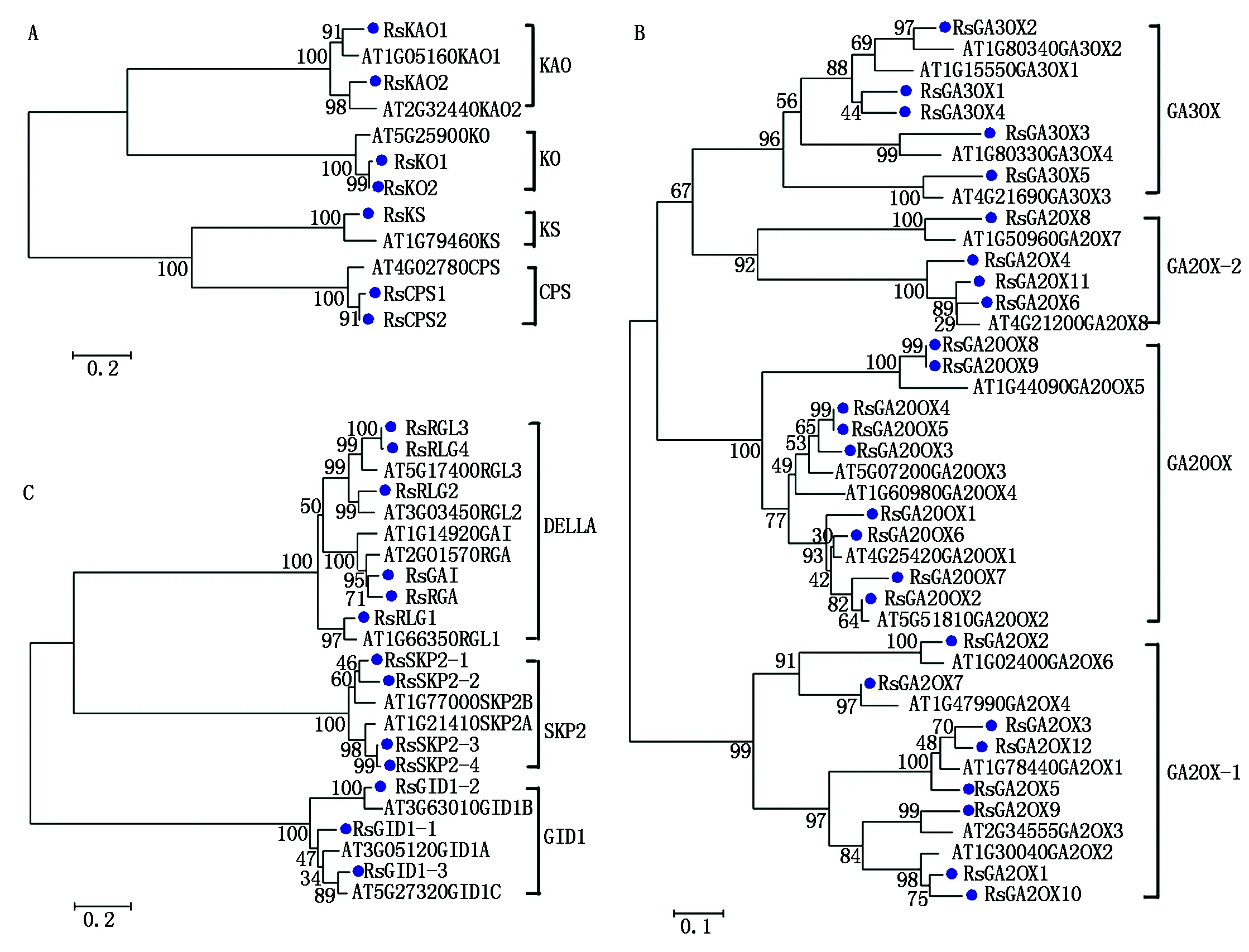
以拟南芥CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2基因编码的蛋白序列作为种子,利用TBtools软件的Blast Several Sequences to a Big Database工具,设置 E值< 10-20,比对萝卜蛋白序列数据库,并去除冗余序列后获得 46个候选赤霉素相关基因(按功能分为12类),CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2分别有2,1,2,2,9,5,12,1,1,4,3,4个。按照它们的染色体定位信息依次命名RsCPS1、RsCPS2、RsKS、RsKO1、RsKO2、RsKAO1、RsKAO2、RsGA20OX1~RsGA20OX9、RsGA3OX1~RsGA3OX5、RsGA2OX1~RsGA2OX12、RsGAI、RsRGA、RsRGL1~RsRGL4、RsGID1-1~RsGID1-3、RsSKP2-1~RsSKP2-4(表 2)。其中有 1个CPS基因(Rs527850)、1个KO基因(Rs574920)和1个RGL基因(Rs541920)未定位到染色体上,分别被命名为RsCPS2、RsKO2和RsRGL4。由表2 和图1 可知,这12类基因不均匀分布于9条染色体上,2号染色体上分布最多,有8个基因;其次是4和9号染色体,各有7个基因;3,6和 7号染色体上分布的基因最少,分别是2,3,3个。
通过ExPaSy软件分析发现,萝卜CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2基因 CDS编码序列为555(GA2OX8)~3 393(RsKS)bp,编码184 ~ 1 130个氨基酸。这46个蛋白质预测的分子质量为21.32 ~ 127.80 ku,等电点为4.72 ~ 9.04,大部分蛋白属于酸性,碱性蛋白仅有9个(GA2OX、GA3OX、KAO、SKP2分别有5,2,1,1个)。此外,46个蛋白质的亲水性值为0.067~-0.495,除SKP2-1、SKP2-3、SKP2-4外,均为亲水性蛋白;而且46个蛋白质中有37个蛋白质的不稳定指数大于40,其中GA20OX、GA2OX和KAO蛋白分别有2,6,1个蛋白质的不稳定指数小于40。
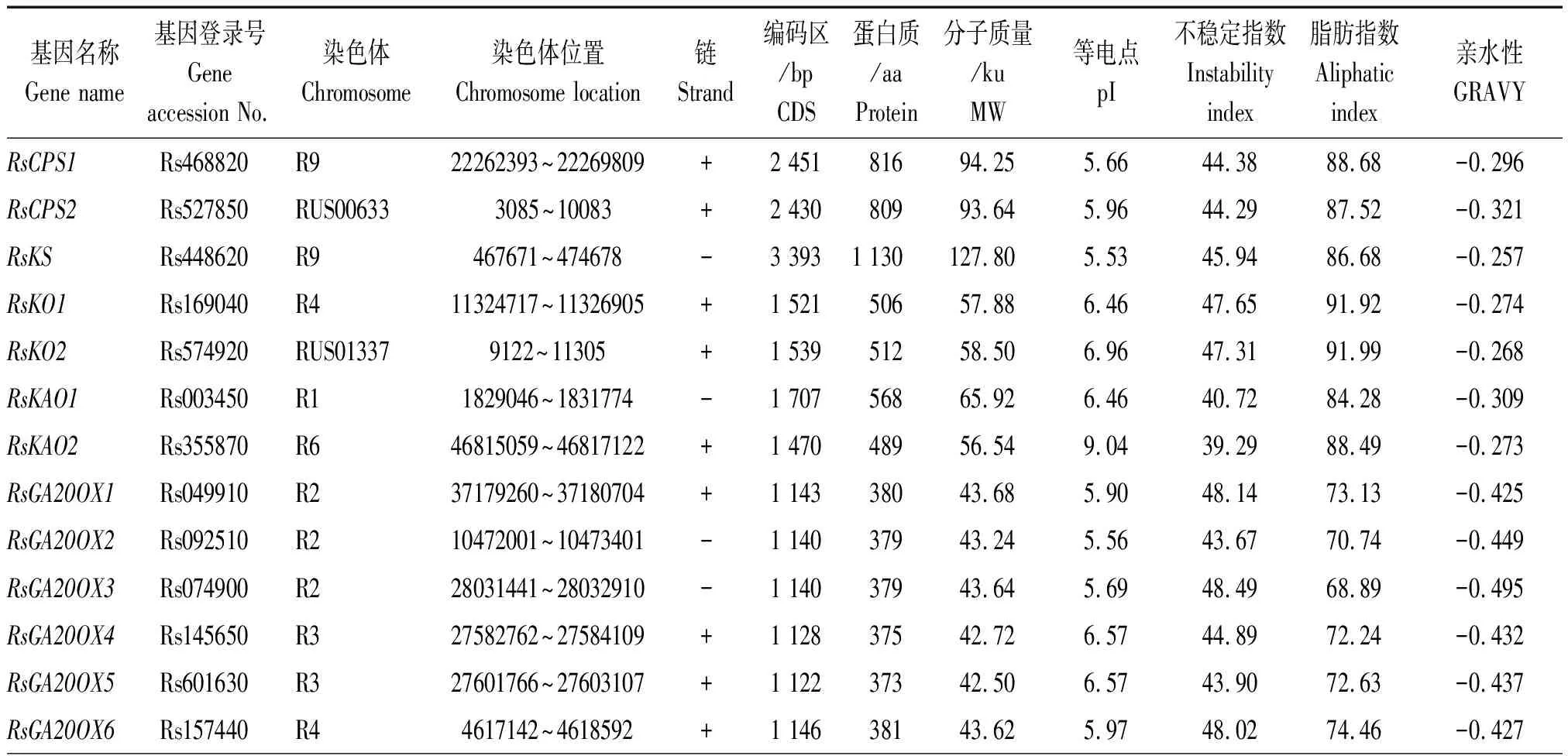
表2 萝卜赤霉素相关基因的理化性质Tab.2 Physicochemical properties of gibberellin related genes in radish
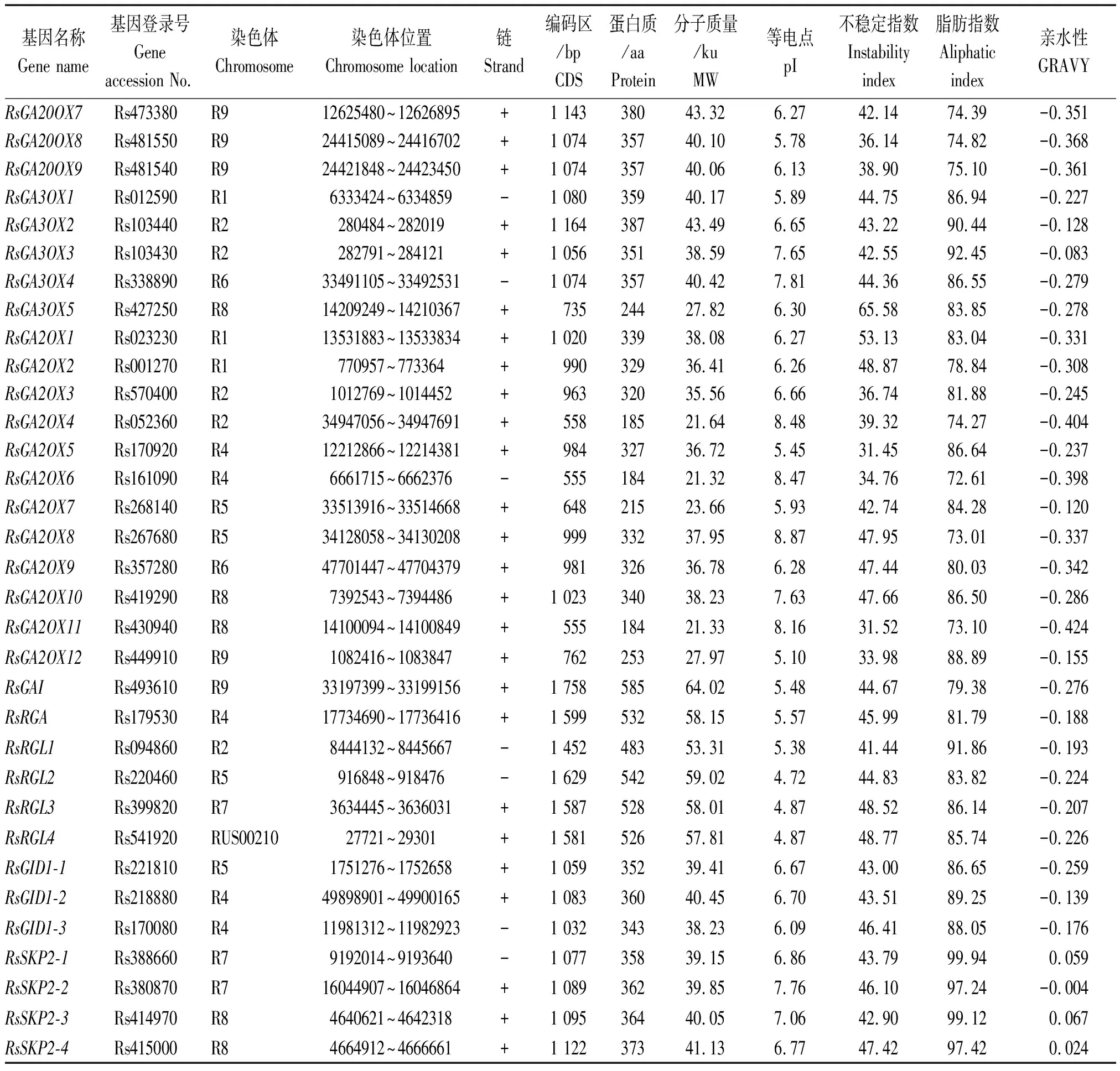
表2(续)
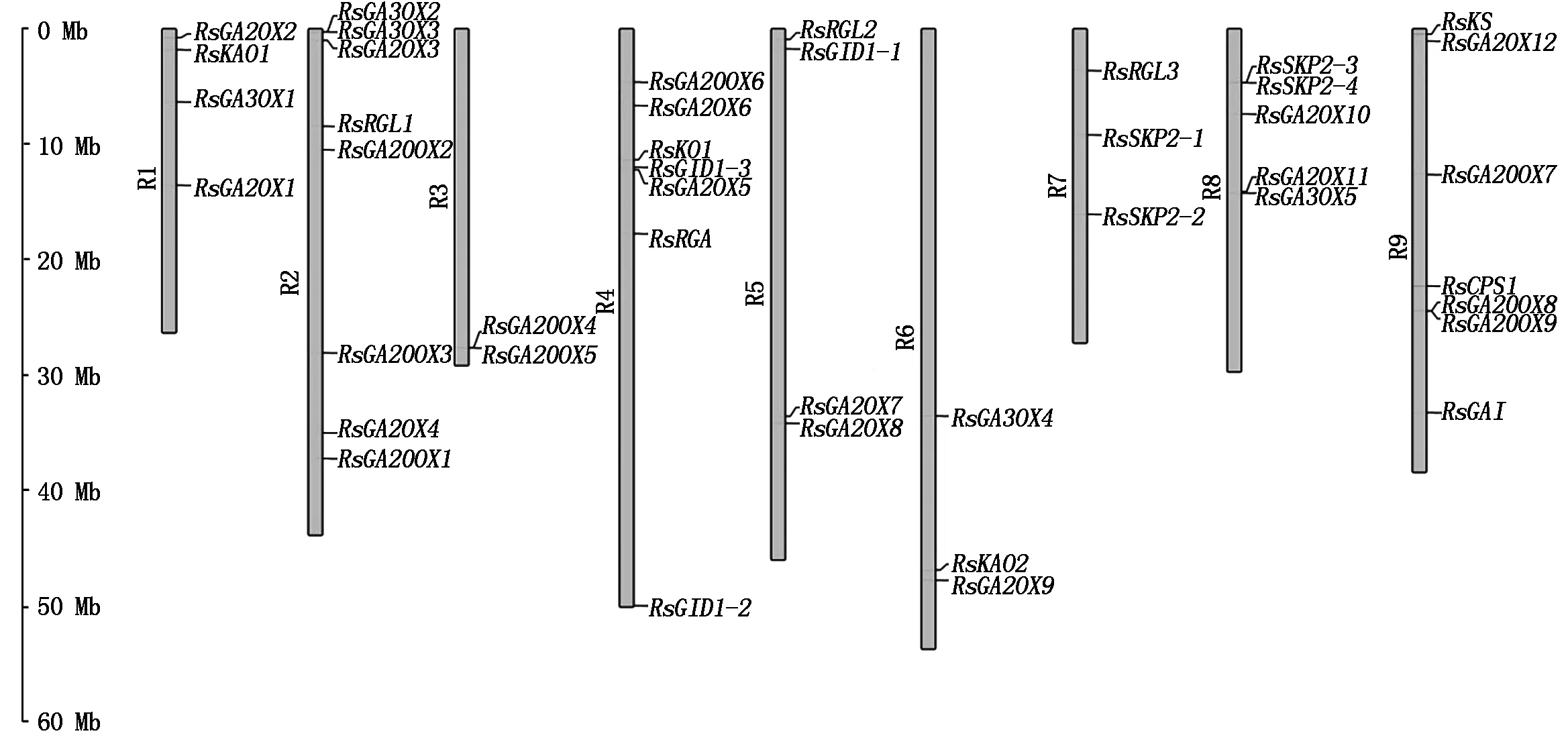
图1 萝卜赤霉素相关基因在染色体上的分布Fig.1 Distribution of gibberellin related genes on radish chromosomes
2.2 萝卜赤霉素相关基因的基因结构分析
对萝卜赤霉素相关基因进行基因结构分析(图 2),发现这 46个赤霉素相关基因的外显子数为1~21个不等,其中RsGAI、RsRGL2、RsRGL3和RsRGL4仅有 1个外显子,没有内含子,而RsKS、RsCPS1、RsCPS2的外显子最多,分别具有21,16,15个外显子。同类酶的编码基因其基因结构相似,如9个RsGA20OX基因均含有 3个外显子,5个RsGA3OX基因都含有 2个外显子,12个RsGA2OX基因的7个含有 3个外显子,5个含有2个外显子,RsGID1-1~RsGID1-3均含有2个外显子,而RsSKP2-1~RsSKP2-4均含有4个外显子,而且外显子长度也比较相似。从基因长度上来看,RsCPS1、RsCPS2和RsKS最长,将近8 kb,其他基因的长度大多在3 kb 以内。
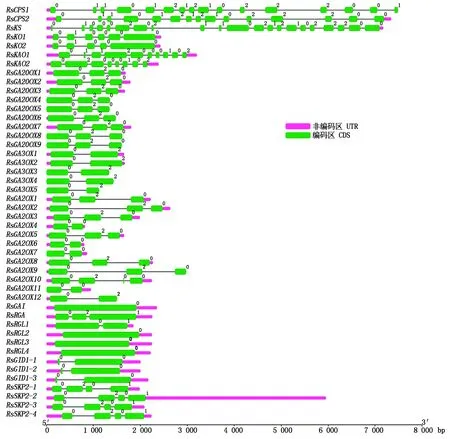
图2 萝卜赤霉素相关基因的基因结构Fig.2 Gene structure of gibberellin related genes in radish
2.3 萝卜赤霉素相关基因编码蛋白质的保守基序分析
根据萝卜赤霉素相关基因的基因结构将这46个基因分为赤霉素合成上游基因(CPS、KS、KO、KAO)、赤霉素合成下游基因(GA20OX、GA3OX、GA2OX)和赤霉素信号转导基因(GAI、RGA、RGL、GID1、SKP2)。用 MEME分别对这3类基因编码的蛋白序列进行保守基序分析,设置参数为 10个保守基序(图 3),分别命名为基序 Motif 1~Motif 10(表 3)。在赤霉素合成上游基因中,Motif 1、Motif 2、Motif 3、Motif 5是全部基因所共有的,Motif 4和Motif 9为CPS 所特有。在赤霉素合成下游基因中,Motif 4是全部基因所共有的,Motif 1、Motif 2、Motif 3、Motif 5、Motif 6、Motif 7为大多数基因所共有,Motif 9为RsGA20OX1~RsGA20OX7所特有,而Motif 10则是RsGA2OX1、RsGA2OX2、RsGA2OX3、RsGA2OX5、RsGA2OX9、RsGA2OX10所特有。此外,RsGA2OX4、RsGA2OX6、RsGA2OX7、RsGA2OX11具有种类和分布相同的 Motif 1、Motif 2、Motif 4、Motif 5、Motif 7 5个保守基序。在赤霉素信号转导基因中,Motif 8是全部基因所共有的,Motif 1、Motif 3是除GID1基因外所共有的,Motif 2、Motif 4、Motif 9、Motif 10为RsGAI、RGA、RGL所特有,而Motif 5、Motif 6、Motif 7是RsSKP2特有的保守基序。

表3 萝卜赤霉素相关基因的10个保守基序Tab.3 Ten conserved motifs of gibberellin related genes in radish
2.4 萝卜赤霉素相关基因系统进化关系分析
利用拟南芥(At)和萝卜(Rs)的 CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2蛋白构建了系统进化树(图 4)。从图4可以看出,萝卜和拟南芥的赤霉素相关基因有很相似的进化关系,它们的12类基因都几乎一一对应,只是萝卜的赤霉素相关基因成员数量比拟南芥(共31个)的相对多一些,如拟南芥中CPS和KO分别只有1个基因,而在萝卜中分别有2个;拟南芥中GA20OX、GA3OX和 GA2OX分别有6(含有1个假基因),4,8(含有1个假基因)个基因,而在萝卜中则分别有9,5,12个;拟南芥中SKP2只有2个,而萝卜中有4个。这可能是因为萝卜在进化过程中经历了3次复制事件,导致基因组增大较多,基因数也大大增加,从而能更好地适应环境。
2.5 萝卜赤霉素相关基因启动子分析
为了进一步探究萝卜赤霉素相关基因的功能,利用PlantCARE软件对这些基因上游的启动子元件进行了预测(表 4)。从表中可以看出,在这12类基因中,与光信号相关的顺式作用元件最多,而且每一个基因都具有4~ 16个不等;其次是与厌氧胁迫和ABA相关的顺式作用元件比较多,分别有37,31个基因含有;与赤霉素、生长素、茉莉酸甲酯、水杨酸、玉米素等激素相关的作用元件分别有22,17,25,15,

图3 萝卜赤霉素相关基因编码蛋白的保守基序Fig.3 Conserved motifs of proteins encoded by gibberellin related genes in radish
12个基因含有;与干旱、低温、抗性等相关的顺式作用元件分别有16,14,18个基因含有;14个基因的启动子上含有 1~2个与分生组织相关的作用元件。虽然46个基因都与赤霉素代谢或信号转导有关,但是只有22 个基因的启动子上含有与赤霉素相关的作用元件,部分基因还同时具有与多种激素或逆境胁迫等相关的作用元件,推测这些基因可能在多个生物学过程中起作用,其功能需要进一步试验验证。
2.6 萝卜赤霉素相关基因在不同组织器官中的表达
为了解赤霉素相关基因在萝卜不同发育时期和不同组织器官中的表达情况,从萝卜基因组数据库中下载了大根白萝卜 46个赤霉素相关基因的表达数据,并作图分析(图 5)。从图5可以看出,46个基因的相对表达量为0~7,不同基因在不同组织器官或不同发育时期的叶和根中的表达量存在较大差异。表达量最高的是RsGAI,在所有组织器官和不同发育时期的叶和根中都是高表达;其次是RsGA2OX2、RsRGL2、RsRGL3、RsRGL4、RsGID1-1、RsGID1-3在不同组织器官和不同发育时期的叶和根中有较高水平的表达;RsKO1、RsKO2、RsKAO2、RsGA20OX1、RsGA3OX1、RsGA2OX3等基因有相对较低水平的表达;而RsGA20OX4、RsGA20OX5、RsGA20OX8、RsGA20OX9、RsGA2OX10、RsRGA、RsRGL1、RsSKP2-1等8 个基因几乎检测不到表达。说明这46个赤霉素相关基因具有不同的时空表达特异性。
AT.拟南芥;Rs.萝卜。AT.Arabidopsis thaliana; Rs.Raphanus sativus.
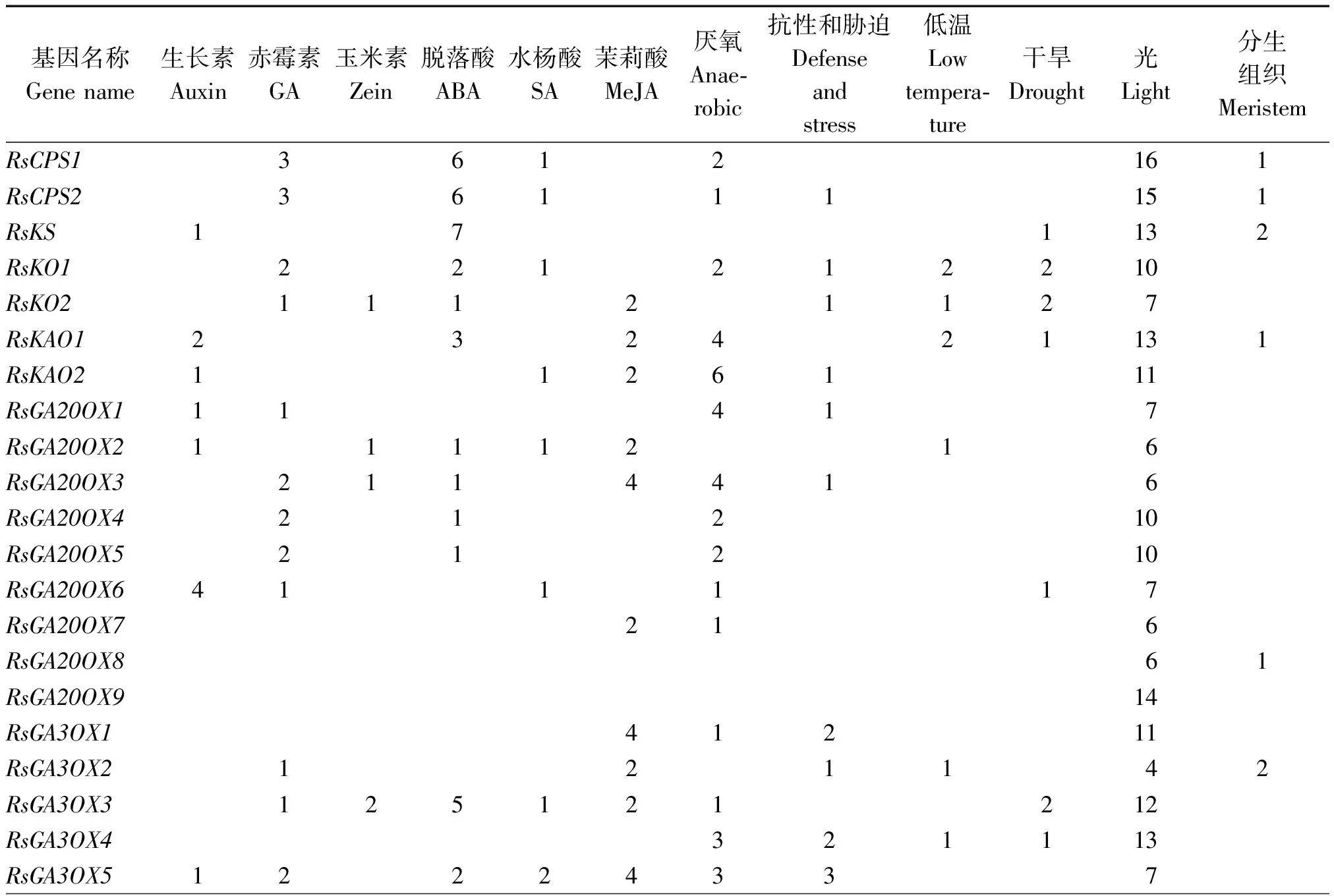
表4 萝卜赤霉素相关基因启动子顺式作用元件Tab.4 Promoter cis-elements of gibberellin related genes in radish

表4(续)
进一步用实时荧光定量PCR检测早开花的心里美萝卜和晚开花野萝卜中赤霉素相关基因的表达情况发现,RsCPS1、RsKS、RsKO1、RsGA20OX1、RsGID1-1等基因在叶中有较高水平的表达,而RsGA3OX1、RsGA3OX2、RsGAI、RsRGA几乎检测不到表达;RsGA20OX2、RsGA20OX3、RsGA3OX3、RsGID1-2在心里美萝卜叶中的表达水平明显高于野萝卜,而RsKS、RsKO1、RsGA20OX1、RsGA20OX4、RsGID1-1在野萝卜叶中的表达水平明显高于心里美萝卜(图6-A)。RsKS、RsGA20OX1、RsGA3OX1、RsGID1-1在心里美萝卜花薹中表达水平较高,而RsKO1在野萝卜花薹中表达水平较高,其他基因在心里美萝卜和野萝卜花薹中的表达水平都很低(图6-B)。RsKO1、RsGA20OX2、RsGA20OX3、RsGAI在心里美萝卜花蕾中有较高水平的表达,RsGA20OX4、RsGA3OX1、RsGID1-1在心里美萝卜角果中有高水平的表达,其他基因表达量都很低(图6-C)。说明赤霉素相关基因在心里美萝卜和野萝卜中的表达有明显差异,并具有各自的时空特异性。另外还检测了开花相关基因RsFLC、RsFRI、RsFT的表达情况,发现开花抑制基因RsFLC在晚开花的野萝卜叶和花薹中有高水平的表达,但在早开花的心里美萝卜花薹、花和角果中的表达量很低(图6-D),而开花促进基因RsFT只在心里美萝卜花蕾和花中有高水平的表达,在野萝卜的叶和花薹中检测不到表达(图6-E),说明萝卜开花早晚和RsFLC基因关系很密切,赤霉素相关基因跟萝卜开花早晚的关系还需要进一步研究。
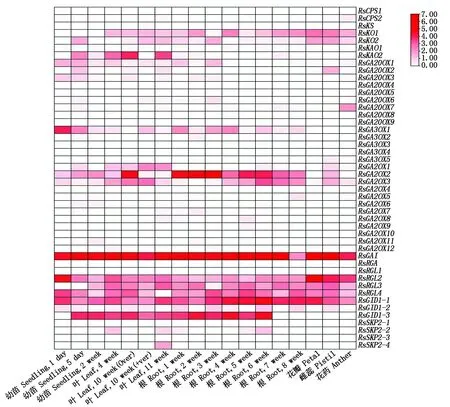
图5 萝卜赤霉素相关基因在萝卜不同组织器官和不同发育时期的表达分析Fig.5 Expression analysis of gibberellin related genes in different tissues and organs and different developmental stages of radish
3 结论与讨论
赤霉素作为经典五大类植物激素之一,是一种高效能的广谱植物生长调节剂,参与调控植物的众多生理过程。本研究通过对萝卜赤霉素相关基因CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2的鉴定与分析,从大根白萝卜基因组中鉴定出 46个赤霉素相关基因,相比同为十字花科植物的拟南芥赤霉素相关基因(31个)数量多15个,这可能与萝卜在进化过程中发生了基因组三倍化事件有关[38-39]。萝卜这46个赤霉素相关基因不均匀分布于 9条染色体上,每条染色体上含有2~8个基因,其中2号染色体中分布最多,有8个基因;3号染色体上分布的基因最少,只有2个。对基因结构和保守基序的分析发现基因进化关系相近的基因结构相似,萝卜的保守基序在赤霉素合成上游基因中,Motif 4和Motif 9是RsCPS 所特有的;在赤霉素合成下游基因中,Motif 9是RsGA20OX1~RsGA20OX7所特有的,而Motif 10则是RsGA2OX1、RsGA2OX2、RsGA2OX3、RsGA2OX5、RsGA2OX9、RsGA2OX10所特有的;在赤霉素信号转导基因中, Motif 1、Motif 3是RsGID1基因所特有的,Motif 2、Motif 4、Motif 9、Motif 10是RsGAI、RsRGA、RsRGL所特有的,而Motif 5、Motif 6、Motif 7是RsSKP2特有的保守基序。在拟南芥和水稻等物种中也有相似的有关保守基序的报道[3,12]。
启动子顺式作用元件分析结果显示,在CPS、KS、KO、KAO、GA20OX、GA3OX、GA2OX、GAI、RGA、RGL、GID1、SKP2 这12 类46 个基因中,每一个基因都具有与光信号相关的顺式作用元件,还有部分基因含有与赤霉素、ABA、生长素、茉莉酸甲酯、水杨酸、玉米素等激素相关的作用元件,以及与厌氧胁迫、干旱、低温、抗性等相关的顺式作用元件,此外有14个基因的启动子上含有与分生组织相关的作用元件,说明这些基因除受GA调控外,也受ABA、生长素、茉莉酸甲酯、水杨酸、玉米素、逆境胁迫等的调控,与前人研究结果[40-42]类似。另外,分析发现,46个基因中只有22个基因的启动子上含有1~3个赤霉素顺式作用元件,其余24个基因的启动子上不含赤霉素相关作用元件,可能是由于选取的启动子序列长度(上游 1 500 bp)较短,也可能是通过 GA信号通路上的其他作用因子调控其响应内源 GA含量变化,从而调节植物体内的 GA水平[43],具体原因还需要进一步研究证实。
大根白萝卜不同组织器官或不同发育时期的表达数据分析表明,46个赤霉素相关基因在不同组织器官或不同发育时期的叶和根中的表达量存在较大差异。表达量最高的是RsGAI,其次是RsGA2OX2、RsRGL2、RsRGL3、RsRGL4、RsGID1-1、RsGID1-3、RsKO1、RsKO2、RsKAO2、RsGA20OX1、RsGA3OX1、RsGA2OX3等,而RsGA20OX4、RsGA20OX5、RsGA20OX8、RsGA20OX9、RsGA2OX10、RsRGA、RsRGL1、RsSKP2-1几乎检测不到表达。这可能与萝卜不同器官和不同发育时期内源 GA水平不同有关[44-46]。为了探究赤霉素相关基因对萝卜抽薹开花的影响作用,通过实时荧光定量 PCR分析了早开花材料心里美萝卜和晚开花材料野萝卜的赤霉素相关基因的表达情况,结果发现,这些基因在不同开花期材料中的表达有明显差异,如RsKS、RsGA20OX1、RsGA3OX1、RsGID1-1在心里美萝卜花薹中表达水平较高,而RsKO1在野萝卜花薹中表达水平较高,其他基因在心里美萝卜和野萝卜花薹中的表达水平都很低。再结合开花抑制基因RsFLC在晚开花的野萝卜叶和花薹中高水平表达,但在早开花心里美萝卜的花薹和花中表达量很低,而开花促进基因RsFT只在心里美萝卜花蕾和花中高水平表达的情况,推测不同开花期材料中GA含量可能不一样,因此,赤霉素相关基因的表达水平也不同,萝卜开花早晚可能跟RsFLC基因的关系更密切[47-51],这些还需要进一步研究证实。
本研究通过生物信息学方法和实时荧光定量 PCR对萝卜赤霉素相关基因进行了系统的鉴定和表达分析,研究结果为萝卜赤霉素生物合成和信号转导相关基因的克隆和功能研究奠定了基础。

