TNNI1、TNNI3在麦洼牦牛横纹肌中的表达分析
向 娅,钟金城,武志娟,柴志欣
(青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,四川 成都 610041)
肌肉组织根据肌细胞形态特征及分布特点可分为平滑肌、心肌和骨骼肌,且骨骼肌和心肌肌原纤维上分布有明暗相间的横纹,故也将其称为横纹肌。肌钙蛋白 (Troponin,Tn)主要位于肌纤维蛋白的细肌丝上[1],包括肌钙蛋白C(TNNC)、肌钙蛋白T(TNNT)和肌钙蛋白I(TNNI),是肌肉组织收缩和舒张的中枢调节蛋白,可调节Ca2+介导的肌动蛋白和肌球蛋白间的相互作用。其中TNNI属于Ca2+结合蛋白多基因家族,包括TNNI1、TNNI2和TNNI3等3种亚型[2]。TNNI是肌钙蛋白-原肌球蛋白调节复合物中的抑制性亚单位,可与肌动蛋白结合以阻止其与肌球蛋白头部的结合发挥抑制作用[3],也称肌钙蛋白抑制因子,也可通过结合Ca2+调控肌球蛋白ATP酶的活性来控制肌肉的收缩活动,进一步影响肌纤维组织学形态及肌纤维直径。
研究发现,TNNI1基因在不同年龄天府肉羊腹肌中的表达量与肌纤维直径呈正相关,与肌纤维密度呈负相关[4]。姬改革等[5]发现,TNNI1基因可能参与了鸭早期发育骨骼肌纤维发育及类型的转换。相关研究显示,TNNI1可调控肌纤维的生长发育。杨华[6]研究显示,TNNI1在猪幼年个体的心肌和慢收缩骨骼肌纤维中表达,在成年阶段仅在慢收缩骨骼肌纤维中表达。TNNI1、TNNI3基因在人、小鼠胚胎形成及发育过程的心肌和慢骨骼肌纤维中均有表达,且TNNI1在心肌中表达水平较TNNI3高;在个体幼年期,TNNI1在其心肌中的表达水平降低,相反TNNI3表达水平升高;TNNI1在成年阶段仅在慢骨骼肌纤维中表达[7-8]。杂交技术检测发现,出生初期大鼠心肌组织存在TNNI1mRNA和TNNI3mRNA[9],而在9月龄人心肌组织中仅检测发现TNNI3mRNA[10],表明TNNI1和TNNI3在不同年龄段肌肉组织中存在表达差异。本研究主要分析了TNNI1基因在不同年龄段麦洼牦牛臀肌组织中的表达趋势及与肌纤维直径及密度的相关性,以及TNNI1、TNNI3在其臀肌和心肌中的表达模式,以期为深入研究牦牛肌肉生长发育调控机制提供理论依据。
1 材料和方法
1.1 试验样品
在四川省阿坝藏族羌族自治州红原县选取9头健康雌性麦洼牦牛,其中0.5岁 (犊牛)、1.5~2.5岁(断奶犊牛)、4.5岁 (成年牛)各3头,屠宰后采集臀肌及心肌组织样本各2份,分别置于液氮及4%多聚甲醛中保存备用。
1.2 主要试剂和仪器
主要试剂:RNA反转录试剂盒和TB Green Premix Ex TaqⅡ购自TaKaRa公司;TNNI1 Antibody(NBP1-56641)、TNNI3 Antibody(NBP2-20734)及蛋白酶抑制剂均购自Abcam公司;RIPA高效裂解液、SDS-PAGE凝胶制备及电泳试剂盒均购自北京索莱宝科技有限公司;PVDF膜、苏木精、伊红等均购自天根生化科技(北京)有限公司。
主要仪器:微量分光光度计(型号NanoDrop 2000)、酶标仪(型号Micro17)均购自Thermo公司;Real-Time PCR System(型号QuantStudio 5)购自Life Technologies公司;倒置荧光显微镜(型号Axio Observer3)购自ZEISS公司;垂直板电泳和转移装置(型号Mini-Protean Tetra)购自伯乐(中国)公司等。
1.3 实时荧光定量PCR
TRIzol法提取各组织样本总RNA。用1.5%琼脂糖凝胶电泳和微量分光光度计检测所提RNA样品的质量和浓度。检测合格后,取1 μg总RNA反转录为cDNA,-20 ℃保存备用。以先前研究获得的克隆序列[11]为参考序列,利用Primer 5.0设计实时荧光定量PCR引物(表1),引物由成都擎科梓熙生物技术有限公司合成。
反应总体积10 μL,反应体系为:2×TB Green Premix Ex TaqⅡ 5 μL、上下游引物(10 μmol/L)各0.4 μL、cDNA模板(400 ng/μL)1.0 μL、ddH2O 3.2 μL。扩增条件:95 ℃ 30 s;95 ℃ 10 s,56 ℃ 30 s,65 ℃ 5 s,共39个循环。设置阴性对照且每个样品设置3个重复。以GAPDH为内参基因,采用2-ΔΔCt对定量结果进行分析。
相对定量结果利用2-ΔΔCt法处理。采用SPSS 22.0软件中One-way ANOVA进行差异显著性分析,数据用平均值±标准误差表示。
1.4 总蛋白提取及Western Blot
利用组织裂解液提取3个年龄段麦洼牦牛心肌组织总蛋白,并检测蛋白浓度;以SDS-聚丙烯酰胺电泳后,湿转法将蛋白质转移至PVDF膜后封闭,一抗二抗孵育,洗膜,显色,曝光后扫描,利用Image J软件进行灰度分析[12]。
1.5 HE染色及统计学分析
取臀肌、心肌组织经4%多聚甲醛固定后,常规石蜡包埋、切片,HE染色观察[13]。取臀肌各年龄段样本切片,在每张切片中随机选取5个视野取点拍照。每个样品制备5张切片,在每张切片每个随机视野选取10根肌纤维测其直径,取其平均值作为单个样本肌纤维直径。肌纤维密度为测定每个视野面积中的肌纤维根数,计算各视野中每平方毫米的肌纤维根数[14],并利用Pearson进行相关性分析。选取不同年龄段牦牛组织切片,随机选取5个视野,利用Image-Pro Plus 6.0测定其平均光密度值[15]。

表1 PCR扩增引物Tab.1 Primers for PCR
2 结果与分析
2.1 TNNI1、TNNI3 mRNA表达
由图1可知,TNNI1在各年龄段麦洼牦牛臀肌组织mRNA表达趋势为:成年牛>犊牛>断奶犊牛,成年牦牛表达量显著高于犊牛、断奶犊牛(P<0.05),且断奶犊牛与犊牛间差异不显著(P>0.05)。
由图2可知,TNNI1在犊牛心肌组织中表达量最丰富,其次为断奶犊牛,在成年牛中表达量最低,三者间差异显著(P<0.05);TNNI3在断奶犊牛心肌组织中的表达量显著高于犊牛、成年牛(P<0.05),但犊牛与成年牛间差异不显著(P>0.05)。TNNI1在犊牛心肌组织的表达量显著高于TNNI3,而TNNI3在断奶犊牛及成年牛心肌组织的表达量显著高于TNNI1(P<0.05)。

不同小写字母表示差异显著(P<0.05)。图2,5,6,9—11同。Different lowercase letters indicate significant difference(P<0.05).The same as Fig.2,5,6,9—11.

不同大写字母表示不同基因表达量之间差异显著(P<0.05)。Different capital letters indicate significant difference between two genes(P<0.05).
2.2 SDS-PAGE电泳检测
根据BCA总蛋白测定数据,绘制标准曲线。如图3所示,线性拟合公式复相关系数R2=0.997 7>0.99,表明该公式可用于计算样本的蛋白浓度。如图4所示,各蛋白质样品均一性好,条带清晰丰富,可用于后续试验所需。

图3 蛋白质吸光度标准曲线Fig.3 Protein absorbance standard curve
2.3 TNNI1、TNNI3蛋白表达
通过蛋白质印迹法检测TNNI1、TNNI3蛋白表达结果显示(图5,6),TNNI1、TNNI3蛋白在各年龄段麦洼牦牛心肌组织中的表达量均随年龄增大而降低;TNNI1、TNNI3蛋白在犊牛心肌组织中的表达量显著高于断奶犊牛和成年牛(P<0.05)。

图5 TNNI1蛋白印迹分析Fig.5 Western Blot analysis of TNNI1

图6 TNNI3蛋白WB分析Fig.6 Western Blot analysis of TNNI3
2.4 麦洼牦牛不同肌肉组织组织学性状
通过观察各年龄段麦洼牦牛不同肌肉组织HE染色切片发现,牦牛臀肌纤维呈长圆柱形,细胞核椭圆形,且肌纤维直径随年龄增长逐渐增粗,而肌纤维密度随年龄增长的趋势与其相反。由图7和表2可知,就肌纤维直径和密度而言,成年牛与犊牛、断奶犊牛差异显著(P<0.05),而犊牛与断奶犊牛差异不显著 (P>0.05)。

A.犊牛;B.断奶犊牛;C.成年牛。图8—11同。A.Calf;B.Weaned calf;C.Adult yak.The same as Fig.8—11.
由图8可知,不同年龄段麦洼牦牛心肌纤维组织学形态存在差异。犊牛心肌细胞多且排列紧密,肌纤维彼此紧密连接间隙小(图8-A),断奶犊牛较犊牛心肌纤维间隔增大 (图8-B),成年牦牛肌纤维间隔较断奶犊牛期增大,肌纤维直径增大(图8-C)。
2.5 TNNI1表达与臀肌纤维性状的相关性
由表3可知,TNNI1mRNA表达量与肌纤维直径呈极显著正相关(P<0.01),与肌纤维密度呈显著负相关(P<0.05)。

图8 不同年龄麦洼牦牛心肌纤维切片Fig.8 Myocardial muscle fibers slices of Maiwa yak at different ages

表2 各年龄段麦洼牦牛臀肌纤维组织学性状测定Tab.2 Gluteal muscle fiber traits comparison of Maiwa yak at different ages

表3 TNNI1 mRNA表达量与肌纤维性状的相关性Tab.3 Correlations between TNNI1 mRNA expression and muscle fiber traits
2.6 TNNI1、TNNI3在牦牛臀肌纤维中的蛋白定位
如图9免疫组化分析所示,TNNI1在不同年龄段麦洼牦牛臀肌纤维中均表达,蛋白表达水平趋势为:成年牛>犊牛>断奶犊牛(图9-A—C);数据统计显示,TNNI1在成年牛中的表达量显著高于犊牛(P<0.05),犊牛显著高于断奶犊牛(P<0.05)(图9-D)。

图9 不同年龄麦洼牦牛臀肌组织TNNI1蛋白表达特征(10×10)Fig.9 Protein expression characteristics of TNNI1 in gluteal muscle(10×10)
通过TNNI1、TNNI3表达定位发现(图10,11),TNNI1在不同年龄段牦牛心肌组织中的表达水平为:成年牛>犊牛>断奶犊牛,且成年牛与犊牛、断奶犊牛差异显著(P<0.05);TNNI3蛋白表达趋势为:犊牛>断奶犊牛>成年牛,三者之间均差异均显著(P<0.05),同时TNNI3蛋白表达水平随年龄的增长呈逐渐降低的趋势。

图10 不同年龄麦洼牦牛心肌组织TNNI1蛋白表达特征(10×10)Fig.10 Protein expression characteristics of TNNI1 in myocardial(10×10)
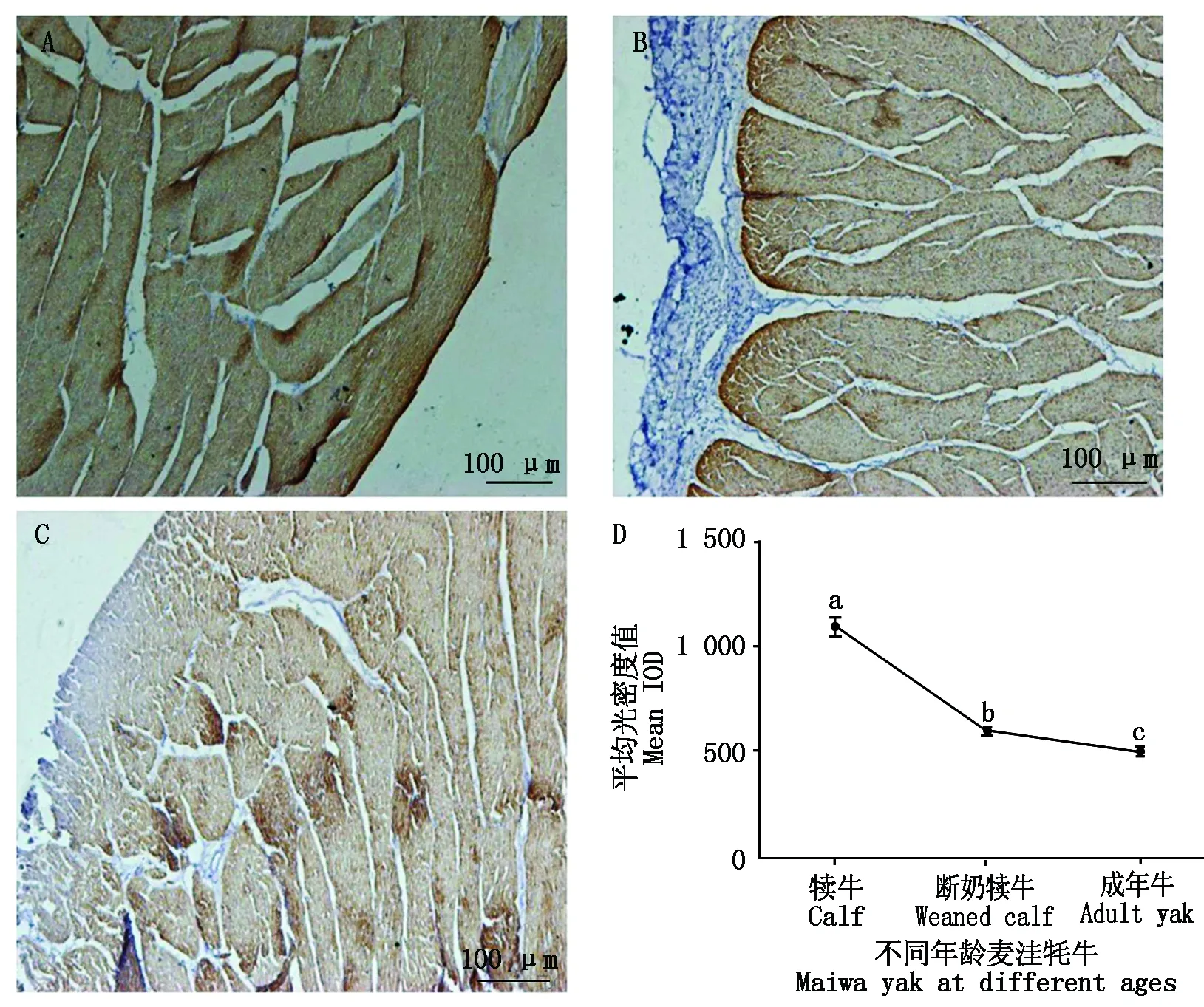
图11 不同年龄麦洼牦牛心肌组织TNNI3蛋白表达特征(10×10)Fig.11 Protein expression characteristics of TNNI3 in myocardial(10×10)
3 结论与讨论
3.1 TNNI1、TNNI3在牦牛各年龄段的mRNA表达变化
Xu等[16]报道,TNNI1在梅山猪股二头肌中的表达量在胚胎期60 d最高,后逐渐降低,在出生后60 d降至最低,此后随发育缓慢上升。姬改革等[17]研究显示,TNNI1在高邮鸭骨骼肌胚胎期表达量较高,随后显著下调,5日龄表达量逐渐上调。Zheng等[18]检测发现,蛋鸡骨骼肌中TNNI1的表达量在出雏后4周龄显著高于2周龄。本研究结果显示,TNNI1在成年牛臀肌组织中表达量最高,在断奶犊牛中表达量最低,且与犊牛无显著差异。TNNI1在骨骼肌中的表达无种属特异性,但与物种发育所处的时期相关[19]。研究发现,随季节变化幼年期牦牛肌肉生长发育出现消长变化[20],成年牦牛产乳量下降,不能全乳喂养,犊牛断奶后肌肉生长发育出现短暂下降期,故断奶犊牛臀肌组织TNNI1表达量出现降低现象。研究结果的差异,可能与研究物种及发育时期有关。
麦洼牦牛心肌组织TNNI1mRNA表达量随年龄的增长而降低,TNNI3表达量则随年龄的增长呈先升高后降低趋势,这与TNNI3在天府肉羊心肌组织中表达量随年龄增长逐渐下调的结果不同[4]。相关分析显示,TNNI3在不同物种启动基因表达所需的近侧启动子长度均不同[21],其表达可能具有物种特异性。杨华[6]通过比较TNNI1、TNNI3在大白猪和梅山猪不同发育时期的表达水平,发现TNNI1表达水平在个体出生后逐渐降低,而TNNI3则逐渐上升,但TNNI3表达水平在其不同发育时期均占主导。本研究结果显示,麦洼牦牛在犊牛期时以TNNI1表达为主,随年龄增长TNNI3表达水平逐渐上调,直至成年期均以TNNI3表达为主。研究发现,胚胎期心脏以TNNI1表达为主,随年龄增长TNNI1在心肌细胞的表达逐渐被TNNI3取代,转录因子GATA4在这一转变过程发挥关键作用[22]。以上研究表明,TNNI1在不同物种的心肌组织表达趋势一致,而TNNI3mRNA表达具有物种特异性,不同物种的表达趋势均存在较大差异。
3.2 TNNI1 mRNA表达量与肌纤维性状关系
肌纤维直径和肌纤维密度等组织学特性与肉品质关系密切,且直接影响肉质嫩度[23]。肌纤维数量在个体出生后就固定不再变化,而肌纤维直径随个体发育逐渐变粗,肌纤维密度则逐渐降低。肌纤维越细,肉质越嫩;肌纤维越粗,肉质越差[24-25],所以肌纤维直径与密度也成为评估肉品质的重要影响因素。毛国祥等[26]通过对我国3个地方鹅种肌纤维直径及密度等肌肉理化参数的测定,发现肌纤维直径及密度对不同鹅品种肉质有影响。McMeekan[27]研究表明,通过肌纤维性状可进一步反映猪的生长过程;Carpenter[28]发现,随大鼠的生长发育,肌纤维直径与肌肉嫩度呈负相关。通过对大通牦牛和九龙牦牛肌纤维组织学性状分析,发现牦牛品种、年龄、性别、取样部位等对肌纤维直径均有影响[29-30]。沈元新等[31]研究显示,肌纤维直径及肌纤维密度对金华猪肉质有显著影响。本研究结果显示,麦洼牦牛犊牛臀肌纤维直径最小,随年龄增长,断奶犊牛肌纤维直径较犊牛增大,成年牛达到最大;而肌纤维密度与肌纤维直径呈负相关,其变化趋势与肌纤维直径恰好相反,与以上其他物种相关研究结果一致。肌纤维直径及肌纤维密度与牦牛年龄相关性较大,年龄越小,肌纤维直径越小,肌纤维密度越大,肉质越嫩。
本研究发现,TNNI1在不同年龄麦洼牦牛臀肌组织的mRNA表达量与肌纤维直径极显著正相关,与肌纤维密度显著负相关,这与吴婷婷[4]对不同年龄天府肉羊腹肌TNNI1研究结果相符,与姬改革等[17]发现鸭早期各类型肌纤维直径与TNNI1表达量不相关的结果不同。可能与不同物种以及肌肉发育不同时期TNNI1的作用机制不同有关[22]。目前,家牦牛仍采用半野生放牧方式,且牦牛善攀岩,臀肌尤为发达,肌纤维含量丰富,不同于其他圈养家畜品种。相关研究显示,牦牛、羊等哺乳动物肌肉组织TNNI1表达量与肌纤维直径显著相关,而鸭、火鸡等禽类TNNI1表达量与肌纤维直径不相关,说明TNNI1在哺乳动物和禽类中的作用方式不同,推测TNNI1并不影响禽类的肌纤维直径和密度,主要对肌纤维类型的转化发挥作用;而TNNI1表达量与哺乳动物肌纤维组织学特性显著相关,与肌纤维的生长发育密切相关。
3.3 TNNI1、TNNI3蛋白表达特点
孙艳[32]发现,ssTnI基因中包含2个TNNI1亚型结构,且以上2个亚型无法在蛋白水平检测发现。张阳[12]研究显示,在小尾寒羊和杜泊羊的心肌组织中TNNI3蛋白均显示2条大小不一的谱带。本研究结果表明,麦洼牦牛心肌组织中TNNI1、TNNI3蛋白表达量均随年龄的增长而逐渐下调,且TNNI1蛋白表达趋势与mRNA表达趋势一致,而TNNI3则存在差异,可能TNNI3mRNA的翻译过程受到了一定影响[12],其转录与翻译的表现丰度发生变化。同时,在麦洼牦牛各年龄段心肌组织中TNNI1蛋白表达谱带均存在大小不同的另一条带,推测可能为TNNI1蛋白亚型,但在克隆过程并未发现其mRNA可变剪切体,也未检测发现其基因亚型结构。
本研究结果显示,TNNI1蛋白在各年龄段麦洼牦牛臀肌组织中均有表达,其中在成年牛中表达量最高,犊牛次之,断奶犊牛表达量最低。犊牛尚处于哺乳期,生长发育迅速,肌纤维各项理化指标均处于上升趋势;1.5~2.5岁牦牛生长发育接近成熟,但存在季节性消长现象[20],故TNNI1蛋白在断奶犊牛中的表达量表现为下调趋势;而成年牛代谢水平稳定,各生产性能均达到最高。研究表明,TNNI3基因突变会引起心肌疾病,并作为心肌梗死等突发心肌疾病的特异性诊断标志基因广泛用于临床检测。张璐璐[33]发现,TNNI3基因可调控心肌细胞的增殖和凋亡。通过对关键代谢通路对心脏生长发育的代偿性调控,为TNNI3基因突变对心肌疾病的致病机制提供了新的研究思路[34-35]。上述研究均表明,TNNI3基因在心肌生长发育及正常代谢过程发挥重要调控作用。本研究蛋白定位结果显示,TNNI3在牦牛心肌组织中的表达量在随牦牛年龄的增长而逐渐下调,与蛋白表达水平一致,推测TNNI3可抑制心肌细胞增殖,故TNNI3表达水平逐渐降低,与其正常生长发育过程相符。

