牦牛KIF2A基因克隆及其在卵泡与卵母细胞发育过程的表达规律
杨满珍,闵星宇,,杨璐瑜,于海玲,,胡宇磊,,朱艳锦,潘帮婷,李 键,,熊显荣,
(1.西南民族大学 畜牧兽医学院,四川 成都 610041;2.青藏高原动物遗传育种资源保护与利用国家教育部重点实验室,四川 成都 610041;3.动物科学国家民委重点实验室,四川 成都 610041)
Aizawa等[1]在小鼠脑组织首次发现KIF1-5,成功完成了前体cDNA的克隆和测序,并通过Northern Blot分析表明,KIF1、KIF3、KIF5只在小鼠脑组织表达、而KIF2和KIF4在脑和其他组织表达。Debernardi等[2]揭示了人和鼠驱动蛋白的酶促活性区域的空间结构域后,含有驱动蛋白结构的蛋白质被逐渐发现,根据其分子结构及功能的不同被划分为14个家族[3]。KIF2A(Kinesin family member 2A,KIF2A)、KIF2B、KIF2C(也称MCAK)、KIF24同属于驱动蛋白超家族-13(Kinesin superfamily of proteins 13),该家族的共性是含有一个极保守的动力结构域,该结构域是微管动态变化的重要调控者[4]。在高等真核生物的细胞分裂中,微管的伸长和收缩对纺锤体尺寸、染色体的运动十分重要[5-6]。KIF2A具有微管解聚活性,其通过增加或减少微管末端的蛋白亚基调节神经元的发育、参与机体物质运输、调控纺锤体的组装[7-9]。在有丝分裂中,KIF2A定位于纺锤体负末端,与位于正末端的MCAK相互配合维持纺锤体的双极性[10]。Bufe等[11]研究表明,Wnt信号通路在有丝分裂过程中调控KIF2A与PLK1的活性以确保纺锤体定位和染色体排列正确。
基于KIF2A在细胞有丝分裂过程中的功能研究和发现,近年来,越来越多的研究表明,KIF2A与细胞分裂相关因子相互作用,共同调控减数分裂过程中纺锤体形成和染色体运动。Chen等[12]研究表明,纺锤丝或纺锤体异常会影响甚至破坏卵母细胞的正常分裂和第一极体的排出速率。Eagleson等[13]研究表明,非洲爪蟾早期胚胎中KIF2A耗尽会导致纺锤体形成缺陷,早期胚胎胞质分裂失败抑制胚胎发育。除此之外,研究表明,KIF2A在人类胎儿生殖细胞(Fetal germ cells,FGCS)4个重要发育阶段,以及人卵母细胞减数分裂过程中3个关键时期差异表达,KIF2A通过纺锤体的组装调控染色体排列对人卵母细胞成熟和早期胚胎发育有重要作用[14]。Xu等[15]研究发现,在小鼠卵母细胞中KIF2A主要定位于纺锤体,利用siRNA干扰小鼠卵母细胞KIF2A的表达后,纺锤体组装和染色体联会异常,小鼠卵母细胞微丝帽的形成受损。Chen等[16]研究表明,下调小鼠卵母细胞中KIF2A的表达后,会出现染色体排列紊乱,异常的不对称分裂等现象;检查点蛋白BubR1被激活,使小鼠卵母细胞发育阻滞于MⅠ期,最终导致第一极体排出的速率降低。综上,KIF2A基因对细胞分裂、卵母细胞成熟等过程具有重要作用。
牦牛(Bosgrunniens)作为高原地区的优势种群,具有耐寒、耐粗饲、抗病和抗逆性强等特点,其有“高原之舟”的美誉,是高原地区牧民主要的生产生活资料和经济来源[17-18],但与平原牛种相比,牦牛性成熟晚、发情率低、空怀率高,繁殖性能低[19-20]。KIF2A基因可能与牦牛雌性繁殖力相关,但目前关于KIF2A基因的研究主要集中在人和小鼠上,尚未见牦牛KIF2A基因的相关研究报道,KIF2A基因是否参与调控牦牛卵泡发育和卵母细胞成熟尚不清楚。
本研究拟通过RT-PCR技术扩增牦牛KIF2A基因,分析其序列结构和生物学特征,并利用RT-qPCR检测KIF2A在牦牛各组织中的表达模式;通过免疫组织化学染色分析该基因在牦牛卵巢组织中的表达定位;利用RT-qPCR检测在不同发育程度卵泡颗粒细胞和不同成熟阶段卵母细胞中的表达规律,旨为进一步挖掘KIF2A在牦牛雌性繁殖方面的调控作用提供基础数据。
1 材料和方法
1.1 样品的采集和处理
试验样品采自成都市青白江区屠宰场,母牦牛屠宰后,立即采集卵巢、心、肝、脾、肺、肾、胃、子宫(n=5),使用磷酸盐缓冲溶液(PBS)冲洗后,剪成0.5 cm3的组织块,装入冻存管并标记,放入液氮罐中保存。完整卵巢组织用含有1%双抗的PBS冲洗数遍,随机取3个用4%多聚甲醛固定液固定用于免疫组织化学染色,其余的卵巢投入含1%双抗的37 ℃生理盐水保温瓶中用于细胞培养。
1.2 主要仪器与试剂、
二氧化碳培养箱(Thermo,美国);光学显微镜(Laika,意大利);激光共聚焦显微镜(Carl Zeiss,德国);荧光定量PCR仪(Bio-Rad,美国);超纯水系统(MILLI-Q,法国)高通量组织研磨器(新芝,中国);紫外分光光度计(Biospec-nano,日本)。RNA isolater、PCR相关试剂盒(诺唯赞);TAE缓冲液、DEPC水(碧云天);感受态细胞DH5α、DNA胶回收试剂盒(天根生化);Rabbit Anti-KIF2A antibody(博奥森);透明质酸酶、琼脂糖购(索莱宝);胎牛血清(FBS)、DMEM/F12培养基、Medium 199培养基(Gibco,美国)。
1.3 卵母细胞的分离培养
使用PBS冲洗卵巢组织3次,使用6号针头注射器将小、中、大卵泡中的卵泡液抽出,分别置于60 mm培养皿中,在显微镜下用捡卵针(2.5 mm×2.0 mm×100.0 mm玻璃细管拉制)收集卵丘-卵母细胞复合体(Cumulus-oocytecomplexes,COCs)。同时将剩余卵泡液中的COCs捡去,分别收集到1.5 mL离心管中并标记,3 000 r/min离心5 min后弃上清,PBS清洗3次,沉淀加1 mL培养液(10%FBS、89% DMEM/F12、1%双抗)得到颗粒细胞备用。使用培养箱37 ℃平衡6 h的卵母细胞成熟液(10% FBS、89% Medium 199、1%双抗1 μg/mL EGF、0.05 IU/mL FSH、0.05 IU/mL LH、0.5 μg/mL 17β-E2)将COCs清洗3次,取50枚置于0.5%透明质酸酶溶液中处理2 min,使颗粒细胞脱去后收集GⅤ期卵母细胞。剩余COCs转入卵母细胞成熟液培养液,置于培养箱(二氧化碳5%、38.5 ℃)中培养12,24 h后,分别收集培养到MⅠ期和MⅡ期的卵母细胞。
1.4 cDNA的获取及cDNA合成
各组织样用高通量组织研磨器研磨后加入1 mL RNA isolater,使组织、细胞充分溶解,经氯仿离心取上清、异丙醇沉淀、75%乙醇清洗、DEPC水促溶获得所有样品总RNA,使用紫外分光光度计检测RNA浓度和纯度,选取OD260/280值介于1.8~2.0的RNA样本,将上述RNA按照反转录试剂盒说明书分别反转合成cDNA,-20 ℃保存备用。
1.5 引物设计合成与克隆
根据GenBank中预测的野牦牛(Bosmutus)KIF2A基因序列(XM_014479690.1)及内参基因序列GAPDH(XM_014482068.1),运用Primer Premier 5.0软件设计引物(表1)。以卵巢cDNA(200 ng/μL)为模板,使用RT-PCR技术扩增KIF2A序列,扩增体系为50 μL,2 × Phanta®Max Master Mix(Dye Plus)25 μL,ddH2O 19 μL,上、下游引物(10 μmol/L)各2 μL,模板2 μL。程序为:95 ℃预变性3 min;95 ℃变性15 s,59 ℃退火15 s,72 ℃延伸30 s,30个循环;72 ℃彻底延伸5 min,4 ℃保存。PCR产物通过浓度为2%的琼脂糖凝胶电泳分析,将目的条带切下,产物纯化回收,连接转化后随机筛选数个阳性菌种送生工生物工程(成都)有限公司测序。
1.6 牦牛KIF2A基因生物信息学分析
牦牛KIF2A基因生物信息学分析工具参见表2。
1.7 KIF2A表达分析
利用RT-qPCR技术,GAPDH作为内参基因,检测分析KIF2AmRNA在牦牛各组织、不同直径大小卵泡颗粒细胞以及不同发育程度卵母细胞中的相对表达量。反应体系:2 × AceQ qPCR SYBR Green Master Mix 10 μL,ddH2O 8.2 μL,模板(200 ng/μL) 1 μL,上下游引物(10 μmol/L)各0.4 μL,50×ROX Reference Dye 1 0.4 μL。RT-qPCR反应程序

表1 PCR引物序列及产物信息Tab.1 PCR primer sequences and products information
表2 生物信息学分析内容和工具Tab.2 Bioinformatics analysis contentsand tools
如下:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,40个循环;溶解曲线为60~95 ℃ 每10 s增加0.5 ℃。
1.8 免疫组织化学染色分析
从4%多聚甲醛固定液中取出卵巢,PBS冲洗后制作石蜡切片,切片放入二甲苯、梯度酒精、纯水中依次洗涤,置于EDTA(pH值9.0)溶液中于烤箱内进行抗原修复15 min,PBS洗涤3次,每次5 min。用纸巾轻轻擦拭组织周围残留的PBS,3% H2O2覆盖避光孵育25 min;3%BSA覆盖室温封闭30 min;滴加一抗(单克隆兔抗KIF2A,1∶200稀释,博奥森),用封口膜盖住防止干燥,4 ℃孵育过夜;移去封口膜,滴加二抗(辣根过氧化物酶标记)室温闭关孵育1 h,滴加DAB显色液显色,镜下观察显色程度,纯水冲洗切片终止显色;苏木精复染;梯度酒精、二甲苯脱水晾干封片;使用共聚焦显微镜拍照。
1.9 数据分析
利用2-ΔΔCt法对RT-qPCR结果进行分析,通过SPSS 19.0统计软件处理,用一般线性模型对各个组织及颗粒细胞、卵母细胞中KIF2A的相对表达量进行比较,当P<0.05时差异显著。
2 结果与分析
2.1 牦牛KIF2A基因的克隆和序列分析
以卵巢cDNA为模板,PCR扩增KIF2A基因后,经2%琼脂糖凝胶电泳检测显示目的条带清晰,片段与预期大小一致(图1-A)。经测序获得牦牛KIF2A基因全长为1 964 bp,CDS为1 530 bp,编码509个氨基酸(图1-B)。利用DNAMAN 6.0软件将测定序列的CDS与NCBI上黄牛KIF2A基因(NM_001077073.1)的CDS核苷酸序列比对,发现657 bp位点和1 073 bp位点上存在碱基突变,其中657 bp碱基突变(C→G)导致该位点的氨基酸由Gly变为Arg(图1-C)。
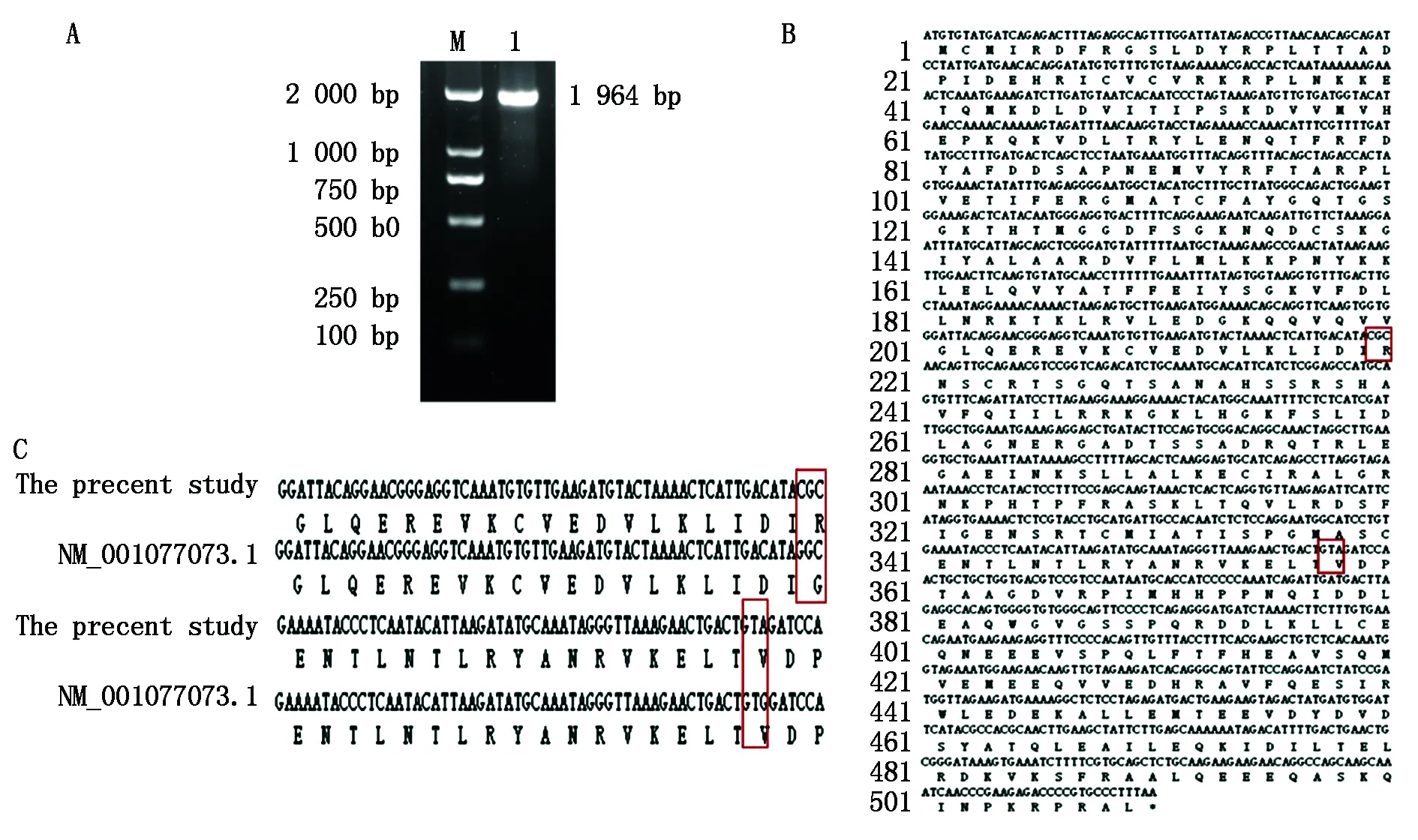
A:M.DL2000 DNA Marker,1.KIF2A基因;B.牦牛KIF2A基因预测序列及推测的氨基酸序列;C.测定序列与黄牛KIF2A编码区序列差异。A: M.DL2000 DNA Marker,1.KIF2A gene;B. Predicted sequence of KIF2A gene and predicted amino acid sequence of yak;C. The difference between the determination sequence and the KIF2A coding region sequence of cattle.
2.2 牦牛KIF2A基因生物信息学分析
通过DNAMAN将预测的核苷酸序列翻译成氨基酸序列后,运用表2所列工具分析预测KIF2A蛋白的理化性质,发现其蛋白质分子式为:C2534H4075N727O781S25,分子质量为58.023 ku,脂肪指数81.41,等电点为6.32,带正、负电荷残基总数分别为73,77个,整体带负电。KIF2A在哺乳动物未完全成熟的红细胞(体外)、酵母和大肠杆菌(体内)的半衰期分别为30,20,10 h。KIF2A含量较高的氨基酸Leu(L)有47个占比为9.2%,含量较低的氨基酸Arg(W)有2个占比0.4%。KIF2A蛋白质中有15种氨基酸亲水性数值小于0,总亲疏水性平均值为-0.68,该蛋白为疏水性蛋白(图2-A)。KIF2A蛋白共有90个潜在的磷酸化位点,其中潜在的丝氨酸磷酸化位点最多48个(图2-B)。通过STRING在线预测,与KIF2A互作的蛋白主要有CENPE、KIF18A、TMED10、PLK1等(图2-C)。
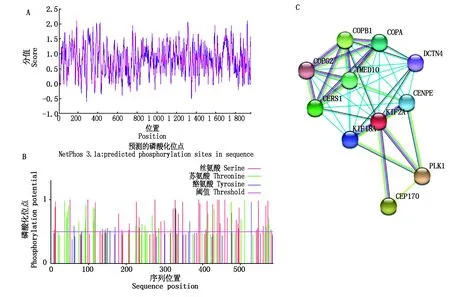
A.牦牛KIF2A蛋白亲疏水性分析;B.牦牛KIF2A蛋白磷酸化位点分析;C.牦牛KIF2A蛋白互作蛋白预测。A.Hydrophilic and hydrophobic analysis of yak KIF2A protein;B.Phosphorylation site analysis of yak KIF2A protein;C.Prediction of yak KIF2A protein interaction protein.
2.3 牦牛KIF2A蛋白质结构功能预测分析
KIF2A蛋白分子具有一个Kinesin动力结构域,该结构域具有水解ATP、运输物质和微管解聚功能,位于700~1 700 bp(图3-A)。牦牛KIF2A蛋白二级结构中的无规则卷曲占比最大为49.96%,其次是α-螺旋占23.81%,再次是延伸连和β-转角占比分别为18.54%,9.69%(图3-B)。KIF2A蛋白三级结构中主要由α-螺旋、无规则卷曲和延伸链缠绕而成,延伸链介于α-螺旋、无规则卷曲之间(图3-C)。
2.4 牦牛KIF2A基因同源性分析与进化树
利用NCBI同源性比对不同物种间KIF2A氨基酸序列,结果显示,牦牛与野牛(XM_010845503.1)、瘤牛(XM_027520446.1)和绵羊(XM_015101285.2)的同源性较高,分别为99.87%,99.48%,98.67%,与小鼠(XM_036157878.1)的同源性较低为91.02%(图4-A)。利用MEGA 6.0软件对牦牛在内的12个物种KIF2A氨基酸序列构建进化树,结果显示,牦牛与野牛首先聚在一起彼此亲缘关系较近,二者随后与瘤牛聚在一起,12个物种中最后与小鼠聚在一起,说明牦牛与小鼠亲缘关系较远(图4-B)。综上可知,KIF2A基因在不同物种间进化过程中较为保守。
2.5 牦牛KIF2A基因在各个组织中的表达差异分析
以GAPDH作为内参,利用RT-qPCR检测KIF2A在卵巢、心、肝、脾、肺、肾、胃、子宫中的相对表达量,结果显示,KIF2AmRNA在牦牛各个组织中均有表达,其在心脏和卵巢组织表达水平差异不显著,但二者的表达量显著高于其他组织(P<0.05),在胃中的表达量最低(图5)。
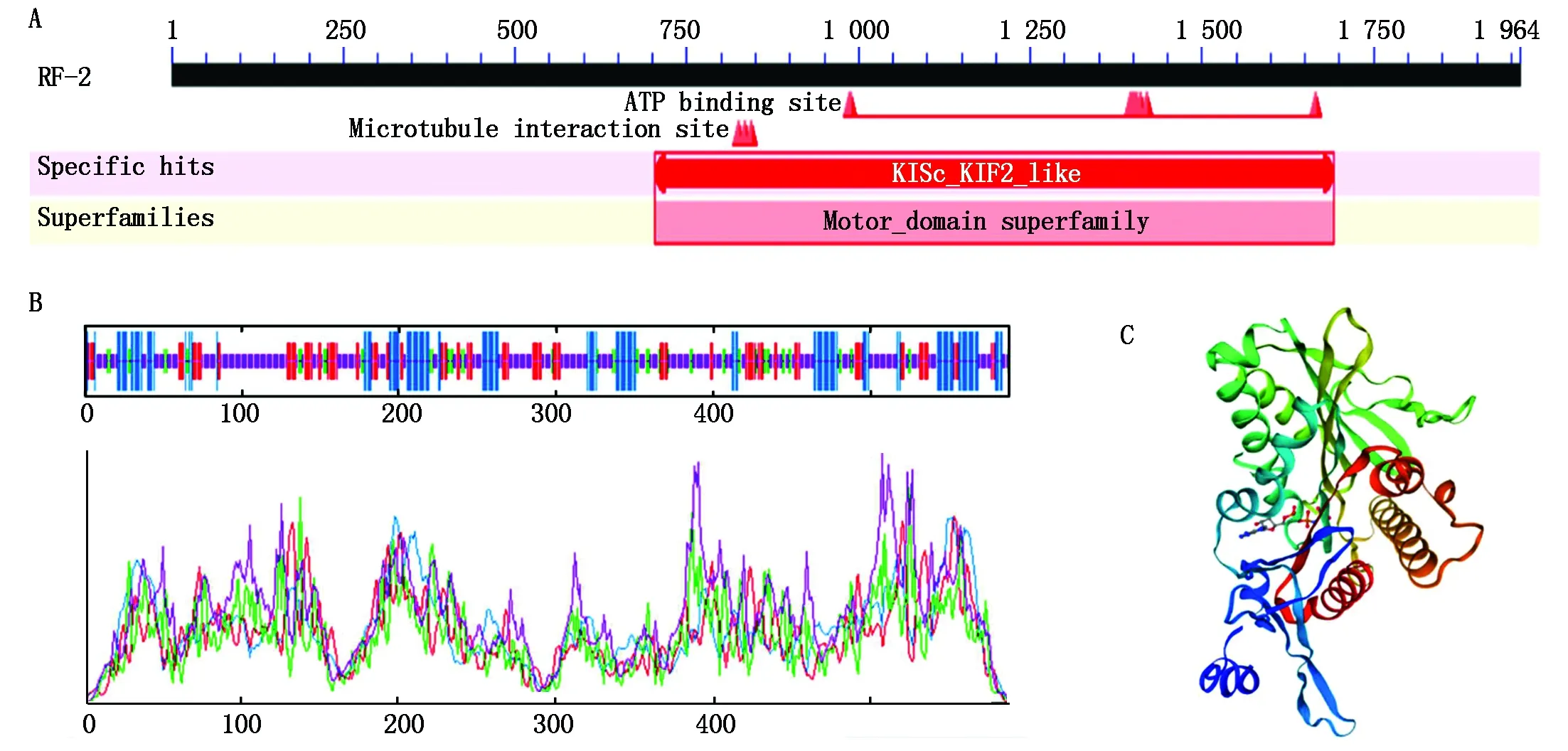
A.牦牛KIF2A蛋白功能结构域分析;B.牦牛KIF2A二级结构;C.牦牛KIF2A蛋白三级结构。A.Functional domain analysis of yak KIF2A protein;B.The secondary structure of yak KIF2A protein;C.The tertiary structure of yak KIF2A protein.

A.不同物种间KIF2A同源性分析;B.牦牛KIF2A系统发育树。A.Homology analysis of KIF2A among different species;B.Phylogenetic tree of yak KIF2A.
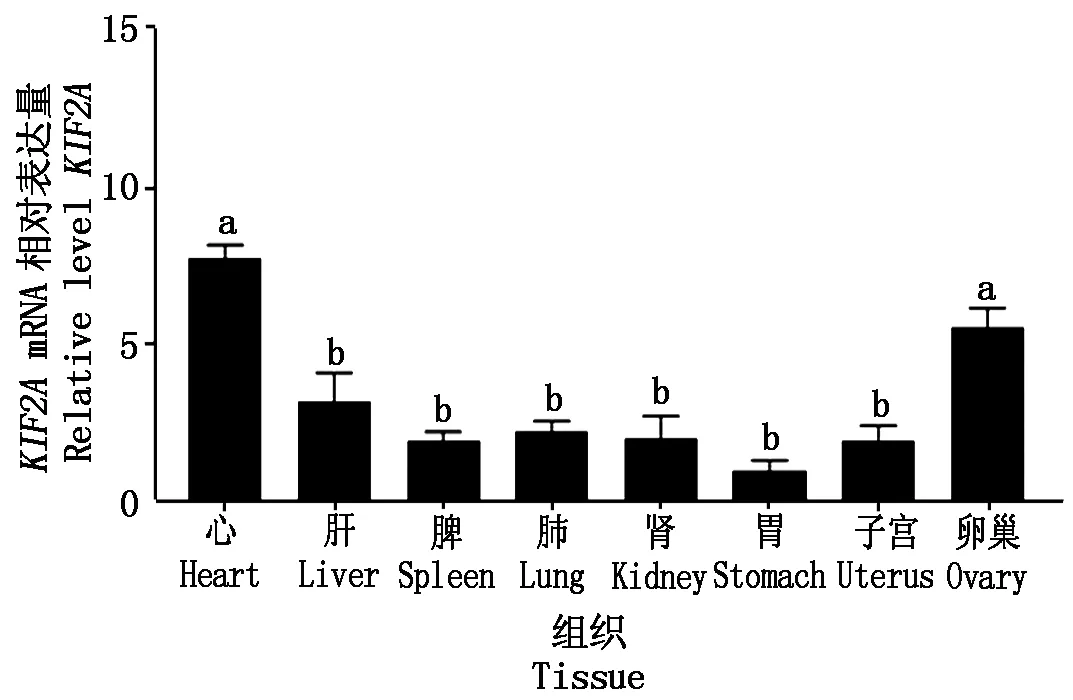
不同小写字母表示差异显著(P<0.05)。图7同。Different lowercase letters indicate significant difference(P<0.05).The same as Fig.7.
2.6 KIF2A在牦牛卵巢中的表达定位
通过免疫组织化学法检测牦牛卵巢中KIF2A表达及定位,如图6所示,KIF2A在牦牛各级卵泡中都有表达;其中有腔卵泡颗粒细胞的阳性信号最强,卵泡膜细胞和周围组织中有少量阳性信号,说明KIF2A主要定位于颗粒细胞中。
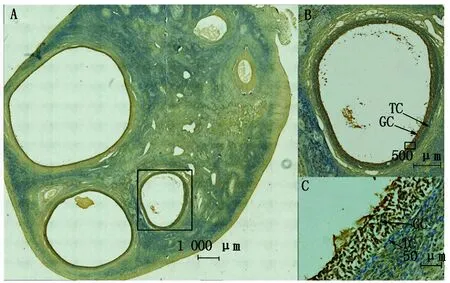
A.牦牛卵巢概览图;B.有腔卵泡;C.有腔卵泡局部放大:GC.壁层颗粒细胞,TC.膜细胞。A.General picture of yak ovary;B.Antral follicle,C.Local enlargement of antral follicle: GC.Granular cell,TC.Theca cells.
2.7 KIF2A在卵泡颗粒细胞、卵母细胞的表达分析
以GAPDH作为内参,使用RT-qPCR检测KIF2A基因在牦牛不同直径大小(小、中、大)卵泡颗粒细胞、不同成熟阶段卵母细胞(GⅤ、MⅠ、MⅡ)中的表达量。结果显示,KIF2A基因的相对表达水平伴随着卵泡发育呈上升趋势,在大卵泡中的表达水平显著高于小、中卵泡(P<0.05,图7-A)。KIF2A在牦牛卵母细胞成熟过程中,其表达量呈下降趋势,GⅤ期表达水平显著高于MⅠ期和MⅡ期(P<0.05,图7-B)。
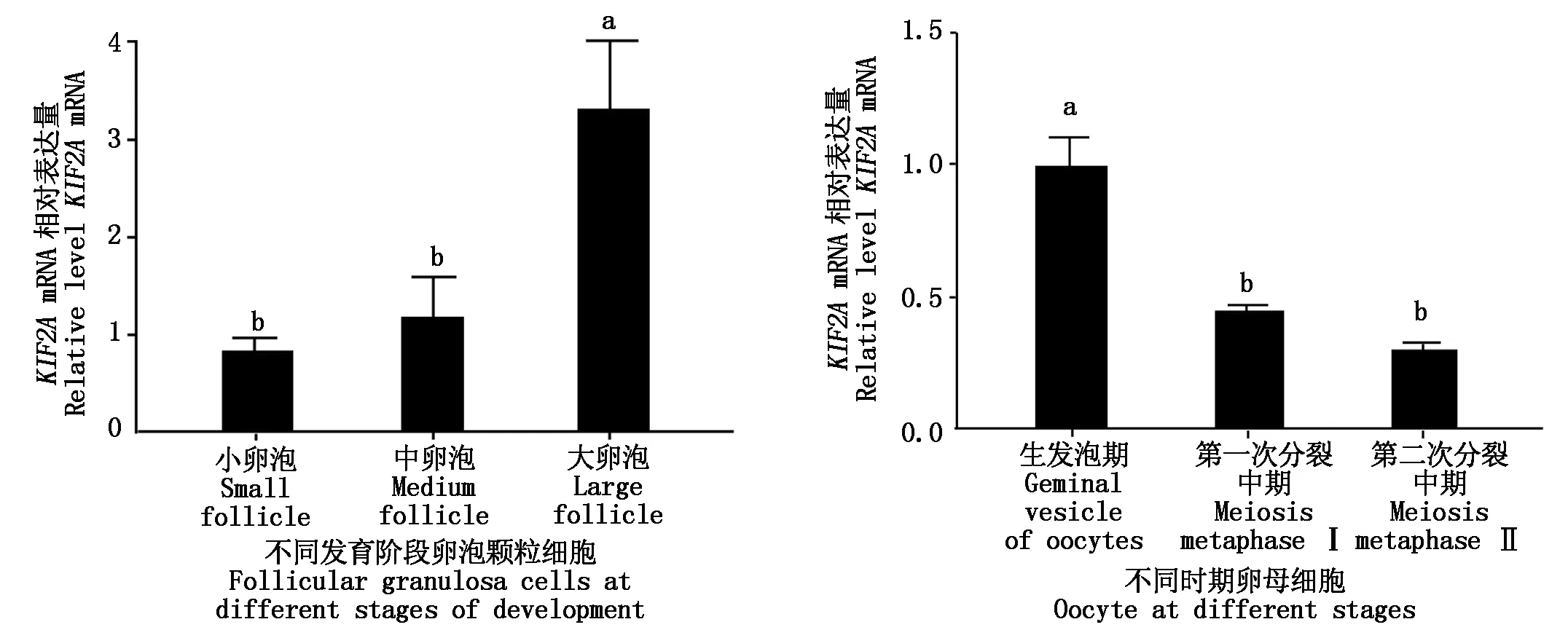
A.小、中、大卵泡颗粒细胞KIF2A的相对表达水平;B.不同时期卵母细胞KIF2A的相对表达水平。A.Relative expression levels of KIF2A in small,medium and large follicular granulosa cells;B.Relative expression levels of KIF2A in oocytes at different stages.
3 结论与讨论
雌性哺乳动物生殖发育是繁衍后代的重要生理过程,其中最为重要的事件即卵泡发育。虽然卵巢在胎儿时期就已经产生,出生前数百万个卵原细胞增殖分裂成初级卵母细胞,但直到初情期后原始卵泡才被逐渐激活,初级卵母细胞从卵泡中排出,减数分裂后成熟的卵子才具备受精能力[21-23]。细胞分裂时细胞核逐步凝集成染色体,排列于赤道,微管聚集在染色体周围不断重排形成纺锤体移向两极,极微管、动力微管连接两级纺锤体与动力马达分子配合,染色体上的动粒结构与多根微管结合,形成微管纤维,核膜解体后,姐妹染色单体分开移向两极[24-26],核质彻底分裂成2个子细胞。研究表明,纺锤丝或纺锤体异常会导致卵母细胞质量下降,进而导致不孕或流产[27-28]。在细胞分裂过程中PLK1被激活并结合MRN、KIF2A构成复合物,磷酸化KIF2A增强其解聚活性,调控卵母细胞减数分裂过程中微管细胞骨架、微丝的长度,确保纺锤体的生成、促进染色体分离[29]。因此,探究KIF2A在卵泡发育、卵母细胞成熟过程中表达规律具有重要意义。
为了探究牦牛KIF2A基因与卵泡发育、卵母细胞成熟的相关性,本试验克隆了牦牛KIF2A基因,并获得完整的CDS全长1 530 bp,编码509个氨基酸。本研究发现,牦牛KIF2A蛋白共有90个磷酸化位点,早期的研究表明,KIF2A微管解聚的活性是由一些蛋白激酶在特定位点磷酸化后被激活的[30-31]。通过物种间基因进化分析发现,KIF2A基因与黄牛、野牛的同源性较高,且亲缘关系较近,提示该基因在物种进化过程中高度保守。Gao等[32]研究表明,KIF2A在昆虫类与小鼠之间高度保守[33],其同家族基因KIF2C在人和斑马鱼之间也高度保守。另外测序所得牦牛KIF2A基因CDS序列与NCBI上黄牛CDS序列相比有2个碱基突变,其中1个导致了氨基酸改变,这种差异可能与牦牛长期生活在高原地区有关,但该氨基酸的突变是否影响到KIF2A蛋白的功能,而影响牦牛的繁殖性能还需要进一步研究。在功能结构域的预测分析过程中发现,牦牛KIF2A富含丰富的螺旋结构域,在700~1 700 bp处具有一个Kinesin动力结构域,该结构域具有水解ATP、运输物质和微管解聚功能。有研究表明,其他KIFs的动力结构域在N端或C端,KIF2A的动力结构域在蛋白质的中心部分[34],该结构域是精子鞭毛运动[35]、卵母细胞减数分裂、纺锤体组装、染色体的联会[36-37]动力来源之一。因此,推测KIF2A基因对牦牛卵泡发育以及卵母细胞的成熟有重要作用。
随着卵泡发育,卵泡膜分内外2层,卵泡腔内主要是壁颗粒细胞、卵丘颗粒细胞、卵母细胞,颗粒细胞合成分泌黏多糖包裹卵母细胞,颗粒细胞膜的突起是为卵母细胞提供营养和传递信息的重要枢纽[38-40]。免疫组织化学结果表明,KIF2A在牦牛卵巢组织各级卵泡中均有表达,阳性信号随着卵泡直径增加逐渐增强,主要定位于颗粒细胞中,提示KIF2A可能是通过颗粒细胞发挥其生物学功能。颗粒细胞与卵泡膜细胞通过分泌细胞因子、分泌蛋白以及类固醇激素等调控卵泡发育以及卵母细胞的成熟[41]。Zhang等[42]发现,KIF2A的同家族基因Oocyte-G1在不同年龄段小鼠卵巢组织中差异表达,在卵泡中主要定位于卵母细胞的细胞质及其周围一些颗粒细胞中,且过表达Oocyte-G1会使小鼠卵泡发育迟缓。综上,推断KIF2A可能通过颗粒细胞参与调控牦牛卵巢卵泡发育和卵母细胞成熟。
为了进一步探究KIF2A在牦牛雌性生殖细胞中的表达规律,本研究通过RT-qPCR检测牦牛不同发育程度卵泡颗粒细胞、不同成熟阶段卵母细胞KIF2A基因的表达量。结果显示,KIF2A在小、中、大卵泡颗粒细胞中差异表达,KIF2A在牦牛不同成熟阶段卵母细胞时序表达,其在GⅤ期的表达量显著高于MⅠ、MⅡ期。随着卵泡的发育,卵泡中颗粒细胞KIF2A的表达增加,可能是由于大卵泡时期卵母细胞需要积累大量营养,颗粒细胞分泌大量类固醇激素、细胞因子和蛋白[41-43],为减数第二次分裂做准备,因此,这一时期的卵母细胞对物质运输的需要尤为迫切,大量的酶被逐渐激活,尤其是卵泡发育与卵母细胞成熟过程中所需的蛋白因子;而KIF2A的Kinesin动力结构域可能为这一时期卵泡内诸多细胞的物质运输、分裂分化提供动力。据文献报道,细胞内Kinesin、Dynein和Myosin共同承担了细胞内物质运输的任务[44],KIFs的Kinesin动力结构域和丰富的螺旋结构域使得其易于折叠和改变形状,满足细胞内不同物质的运输需求。而卵母细胞成熟过程中KIF2A表达量逐渐下降的原因,可能与CyclinB1的降解和MPF活性(Maturation-Promoting Factor,MPF)的缺失有相关性,研究表明,卵母细胞从初级卵母细胞发育到次级卵母细胞必然会使CyclinB1降解和MPF活性缺失[45-46]。因此,推测KIF2A的表达下降可能是由MPF的上调导致的,但具体调控机制有待进一步研究。
本研究克隆得到牦牛KIF2A基因CDS序列全长1 964 bp,其中CDS为1 530 bp,编码509个氨基酸。KIF2A在物种进化过程中高度保守;KIF2AmRNA在牦牛各组织中广泛表达,并且在牦牛不同发育程度卵泡颗粒细胞、不同成熟阶段卵母细胞中时序表达。提示,该基因可能参与调控牦牛卵泡发育与卵母细胞成熟。以上研究结果可为牦牛卵泡生长发育调控机理及功能的研究提供可靠的理论依据。

