急性心肌梗死患者外周血单个核细胞miR-132、单核细胞趋化蛋白-1的表达及与预后的关系*
李晶瑾, 翟阳, 靳刚, 陈茜, 黄欣**
(1.西安交通大学第一附属医院 心血管内科, 陕西 西安 710061; 2.陕西省肿瘤医院 肿瘤内科, 陕西 西安 710061; 3.西安市华山中心医院 影像科, 陕西 西安 710061; 4.西安交通大学第一附属医院 生殖医学科, 陕西 西安 710061)
动脉粥样硬化是一种由内皮损伤和内皮下脂蛋白潴留引起的动脉壁慢性炎症性疾病,包括单核/巨噬细胞在内的多种细胞及炎症细胞因子参与了动脉粥样硬化的发生[1]。最近新发现的小分子物质——微小RNA (microRNA,miRNA) 作为细胞黏附、增殖、脂质吸收和流出以及炎症介质生成等病理生理过程的重要调节因子,为动脉粥样硬化发生、发展机制的研究提供了新的分子视角,并提供了新的治疗靶点;微小RNA还能够作为疾病诊断、评估预后和治疗反应的特异性生物标志物[2]。miR-132是一种炎症相关微小RNA,在炎症性疾病类风湿性关节炎患者的血浆中表达水平升高[3],在外周血单个核细胞(peripheral blood mononuclear cell, PBMC)中表达也明显升高[4],在前体脂肪干细胞中miR-132通过影响核因子κB(nuclear factor kappa-B, NF-κB)的活性来促进促炎细胞因子单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)的表达[5]。生物信息分析(http://www.targetscan.org)显示miR-132可以和细胞沉默调节蛋白1(sirtuin 1, SIRT1) 3′UTR特异性结合,同时有研究也进一步证实miR-132靶向SIRT1 3′UTR并降低其活性[6]。目前研究证实,SIRT1对内皮功能障碍和氧化应激起保护作用,低水平SIRT1与心肌梗死的病史显著相关,并且能够预测冠心病心肌梗死的发生[7]。但是,冠心病急性心肌梗死(acute myocardial infarction, AMI)患者PBMC中miR-132的表达是否发生改变,miR-132是否参与动脉粥样硬化及AMI的发生,是否能够成为诊断AMI及评价预后的指标目前尚不明确。因此,本研究旨在探讨AMI患者PBMC中miR-132、MCP-1的表达,与心肌损伤、心衰、左心室重构及AMI预后的关系。
1 对象与方法
1.1 研究对象
纳入2018年10月—2019年2月于西安交通大学第一附属医院住院患者共174例,其中男124例、女50例。患者临床症状、心电图、心肌损伤标志物及冠脉影像学检查等均符合《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》[8]及《2020年欧洲心脏病学会非ST段抬高型急性冠状动脉综合征管理指南》[9]诊断标准为AMI组,共84例;经冠状动脉造影或冠状动脉CTA排除冠心病患者为非冠心病(non-coronary heart disease, NCHD)组,共90例。排除标准:(1)近1月出现过明确感染者;(2)重度肾功能不全(基于MDRD方程计算得出的肾小球滤过率估计值<30 mL/(min·1.73 m2)或长期接受透析);(3)重度肝功能不全(ALT≥正常高限5倍);(4)近1月有外科手术史、活动性出血史者;(5)合并有结缔组织疾病、自身免疫性疾病、恶性肿瘤者。AMI组患者随访1年,收集主要不良心血管事件(major adverse cardiovascular events, MACE),包括心源性死亡、非致死性AMI、靶血管血运重建以及再住院(复发心绞痛和心力衰竭),按照是否发生MACE分亚组,1年内发生MACE为预后不良组,无MACE为预后良好组。所有研究对象均对相关研究知情同意。
1.2 研究方法
1.2.1一般资料、临床生化及左心室重构及左心功能指标 收集2组患者一般资料(性别、年龄、高血压及糖尿病史、吸烟史)和临床生化指标[白细胞计数(WBC)、淋巴细胞计数(LYM)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、高敏肌钙蛋白T(hs-cTnT)、N-末端脑钠肽前体(NT-proBNP)、甘油三酯(TG)、总胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]及1年随访时左心室重构及左心功能指标[左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室射血分数(LVEF)、左室短轴缩短率(LVFS)及心输出量(CO)]
1.2.2标本采集并提取PBMC 所有患者入院后采集空腹静脉血5 mL,2 000 r/min离心10 min分离血细胞和血浆,血细胞转入离心管加PBS至10 mL混匀。15 mL离心管加人外周血淋巴细胞分离液5 mL,将血细胞悬液铺于人外周血淋巴细胞分离液面上,室温下2 000 r/min离心20 min(升降速度均调为0),吸取中间云雾状的淋巴细胞层即为PBMC,用PBS清洗后无酶EP管-80 ℃冻存。
1.2.3逆转录-实时荧光定量聚合酶链式反应(RT-qPCR) PBMC冰上解冻,采用RNAfast200试剂盒提取总RNA。用Nano Drop 检测总RNA的浓度以及纯度,选取1.8≤A260/A280≤2.1的样本,用逆转录试剂盒将RNA及时逆转录为cDNA,-20 ℃冻存。miR-132上游引物为5′-ACACTCCAGCTGGGTAACAGTCTACAGCCA-3′,miR-132下游引物为5′-CTCAACTGG TGTCGTGGAGTCGGCAATTCAGTTGAGCGACCATG-3′;MCP-1上游引物为5′-AATCAA TGCCCCAGTCACCT-3′,MCP-1下游引物为5′-TCAGCACAGATCTCCTTGGC-3′。分别以 U6、GAPDH为内参照,每组数据取3个样本行RT-qPCR,反应条件:95 ℃ 10 s预变性,95 ℃ 5 s变性、60 ℃ 15 s退火、72 ℃ 10 s延伸,重复45循环,Real-time PCR Bio-Rad iQ5采集扩增产物的荧光信号并自动分析,获得扩增曲线、溶解曲线,并根据检测结果得出Ct值。
1.3 统计学分析
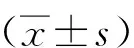
2 结果
2.1 一般资料和临床生化指标
研究共纳入174例患者,其中 AMI组 84例,NCHD组90例。2组患者在年龄、性别、合并高血压、糖尿病及吸烟史方面比较,差异无统计学意义(P>0.05)。入院时2组患者临床生化指标比较,AMI组患者的WBC、LYM、CK、CKMB、hs-cTnT、NT-proBNP、TG、CHOL、LDL-C均较NCHD组升高、HDL-C较NCHD组降低,差异有统计学意义(P<0.01)。见表1。
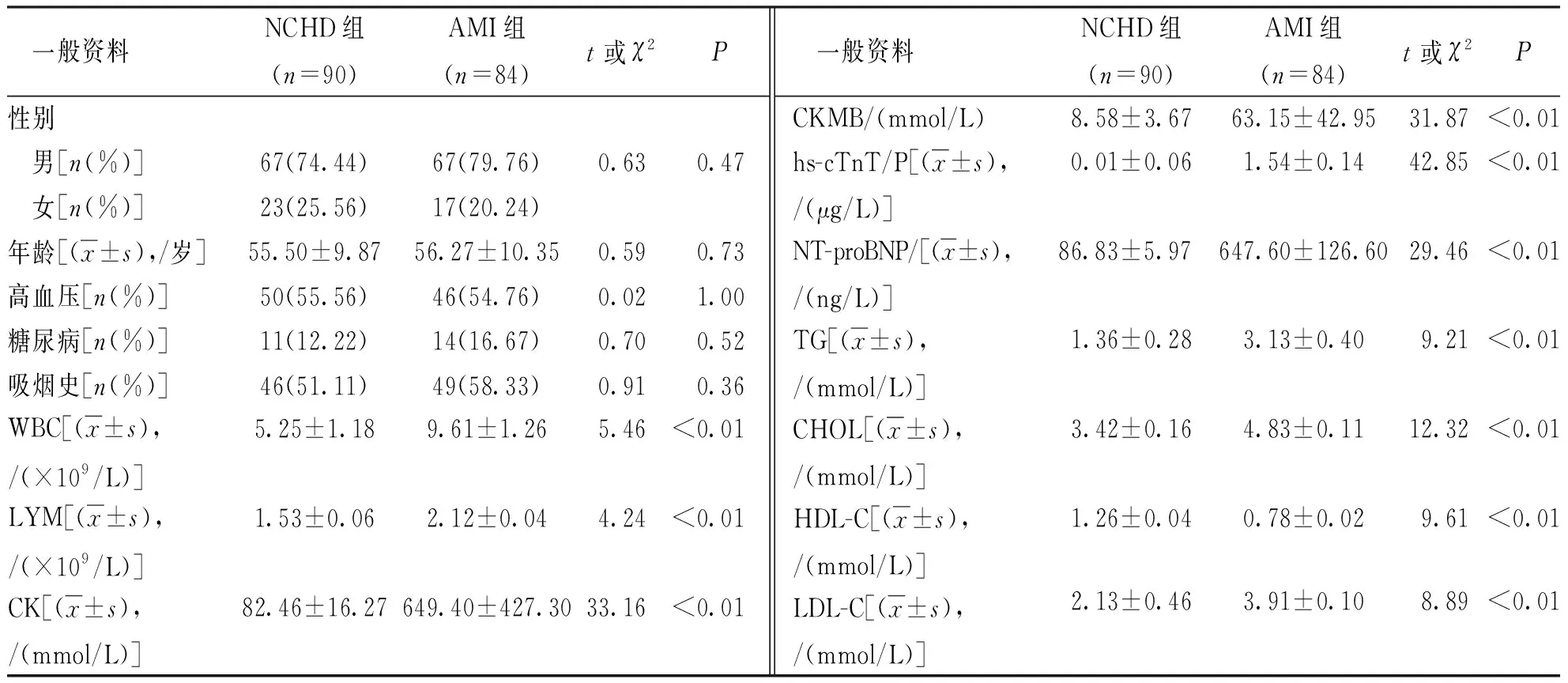
表1 AMI组和NCHD组患者一般资料和临床生化指标Tab.1 Clinical characteristics of NCHD and AMI groups
2.2 左心室重构及左心功能指标
1年随访时, AMI组LVESD、LVEDD较NCHD组升高,LVEF、LVFS、CO较NCHD组降低,差异有统计学意义(P<0.01)。见表2。

表2 AMI组和NCHD组患者1年随访时的左心室重构及左心功能指标Tab.2 Cardiac ultrasound indexes of
2.3 PBMC中miR-132和MCP-1的表达
AMI组患者PBMC中miR-132、MCP-1的相对表达水平明显高于NCHD组(t=10.37、10.59,P<0.01)。见图1。
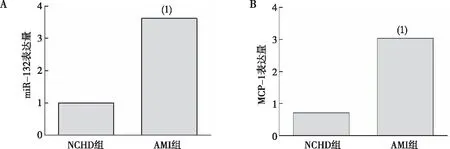
注:A、B分别为miR-132和MCP-1表达的定量结果;(1)与NCHD组比较,P<0.01。图1 AMI组和NCHD组患者PBMC中miR-132和MCP-1的表达Fig.1 Expression levels of miR-132 and MCP-1 in PBMCs of AMI and NCHD groups
2.4 PBMC中miR-132和MCP-1的相关性分析
AMI患者PBMC中MCP-1与miR-132表达呈正相关,差异有统计学意义(r=0.71,P<0.01);对所有患者MCP-1与miR-132表达量进行相关性分析,结果显示二者呈正相关且差异有统计学意义(r=0.82,P<0.01)。见图2。
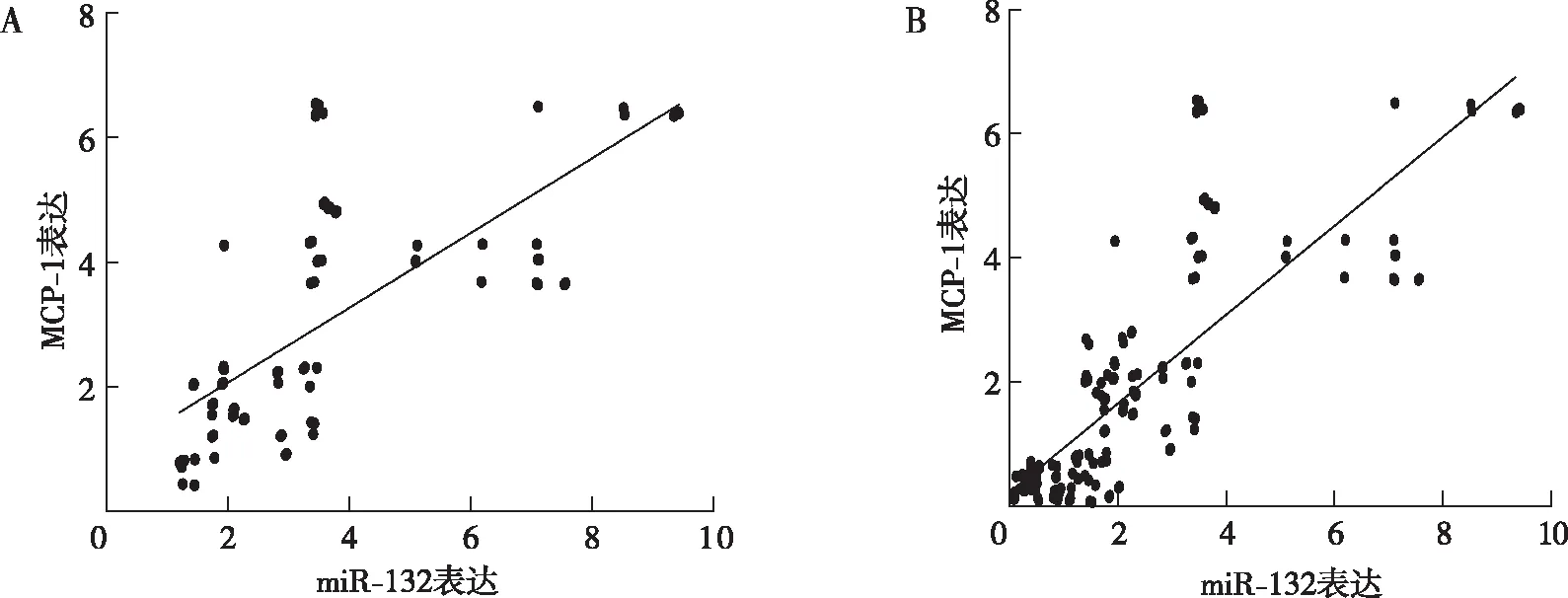
注:A为AMI患者,B为所有患者。图2 不同患者MCP-1与miR-132表达的相关性Fig.2 Correlation analysis of miR-132 and MCP-1
2.5 AMI患者miR-132、MCP-1与心肌损伤标志物、NT-proBNP及心脏超声指标的相关性
AMI患者PBMC中miR-132、MCP-1表达量,与血清CK、CKMB、hs-cTnT、NT-proBNP正相关且差异具有统计学意义(P<0.01);与心脏超声指标LVESD、LVEDD正相关且且差异具有统计学意义(P<0.01);与心脏超声指标LVEF、LVFS、CO负相关且差异具有统计学意义(P<0.01)。见表3。
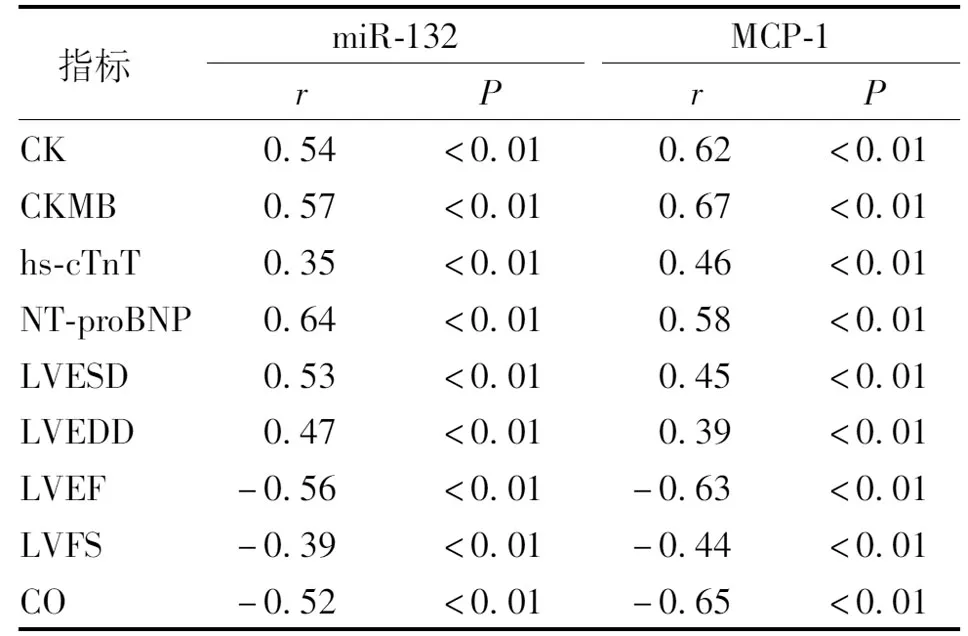
表3 miR-132、MCP-1与心肌损伤标志物、NT-proBNP及心脏超声指标的相关性Tab.3 Correlation analysis of miR-132, MCP-1 with myocardial injury markers, NT proBNP, and cardiac ultrasound indexes
2.6 miR-132和MCP-1对AMI的诊断价值
ROC曲线显示,PBMC中miR-132表达量诊断AMI的AUC为0.92(95%CI为0.88~0.96,P<0.01),诊断灵敏度为84.52%、特异度为82.22%;MCP-1表达量诊断AMI的AUC为0.90(95%CI为0.86~0.95,P<0.01),诊断灵敏度为96.43%、特异度为80.00%。二者联合诊断AMI的AUC为0.96(95%CI为0.94~0.98,P<0.01),诊断灵敏度为89.29%、特异度为85.56%。见图3。

图3 miR-132和MCP-1对AMI的ROC曲线Fig.3 ROC curves of miR-132 and MCP-1 for AMI
2.7 不同预后AMI患者miR-132、MCP-1与心肌损伤标志物、NT-proBNP及心脏超声指标
AMI患者依据随访1年是否发生MACE时间分为预后不良组(n=24)及预后良好组(n=60)。对2个亚组miR-132、MCP-1、心肌损伤标志物,以及反映左室重构和左心功能的超声指标进行分析发现:与预后良好组相比,预后不良组PBMC中miR-132、MCP-1表达量升高且差异有统计学意义(P<0.01);血清中hs-cTnT、NT-proBNP升高且差异有统计学意义(P<0.01);心脏超声指标LVESD、LVEDD升高,LVEF、LVFS、CO降低,且差异有统计学(P<0.01)。见表4。

表4 不同预后AMI患者miR-132、MCP-1与心肌损伤标志物、NT-proBNP及心脏超声指标Tab.4 miR-132, MCP-1,myocardial injury markers, NT proBNP, and cardiac ultrasound indicators in the patients with different
2.8 是否发生MACE的多因素回归分析
对AMI患者随访1年发生MACE的预后不良组及无MACE的预后良好组,两组间有差异的指标进行多因素回归分析,结果显示miR-132、MCP-1、NT-proBNP,以及心脏超声指标LVESD、LVEDD、LVEF、LVFS是AMI是否发生MACE的独立危险因素(P<0.05)。见表5。
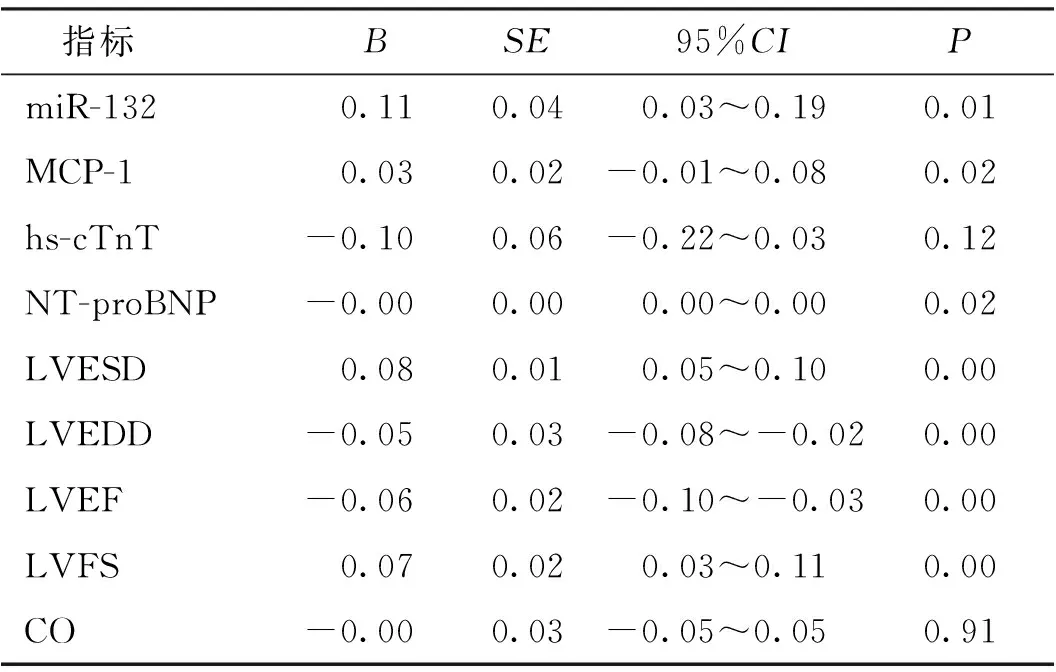
表5 MACE相关危险因素的多因素回归分析Tab.5 Multivariate regression analysis of MACE related risk factors
2.9 miR-132和MCP-1对AMI患者预后不良的评估价值
AMI组1年随访发生MACE提示预后不良。ROC曲线显示,PBMC中miR-132表达量预测AMI患者预后不良的曲线下面积为0.84(95%CI为0.76~0.93,P<0.01),诊断灵敏度为87.50%,特异度为75.00%; MCP-1表达量预测AMI患者预后不良的AUC为0.74(95%CI为0.62~0.87,P<0.01),诊断灵敏度为79.17%、特异度为68.33%。二者联合预测 AMI患者预后不良的AUC为0.85(95%CI为0.76~0.93,P<0.01),诊断灵敏度为79.17%,特异度为73.33%。见图4。
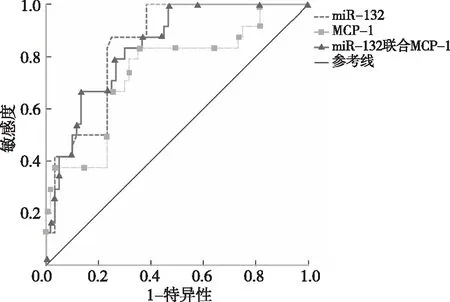
图4 miR-132和MCP-1对AMI预后不良的ROC曲线Fig.4 ROC curves of mir-132 and MCP-1 for poor prognosis of AMI
3 讨论
冠状动脉粥样硬化性心脏病是一种慢性炎症性疾病[10]。动脉粥样硬化的发生同代谢紊乱和炎症直接相关,微小RNA作为一种调节基因表达的小分子,能够结合到靶信使RNA的3′非翻译区或特异性抑制翻译,从而诱导生理过程或信号通路的调节,参与调节炎症反应、血管生成发育和脂质代谢,直接影响动脉粥样硬化的发生发展[11-13]。如:miR-145通过靶向CD137和活化T细胞的核因子1抑制NLRP3炎症小体活化[14];miR-19b可能通过下调ABCA1表达导致胆固醇紊乱[15];miR-132作为新的血管平滑肌细胞增殖调节因子,通过抑制TRAF作用蛋白的表达抑制新生内膜的形成[16]。微小RNA在转录后水平调控基因,参与病理生理过程,在冠状动脉粥样硬化性心脏病的发生和发展过程中发挥至关重要的作用[17]。
miR-132是一种炎症相关性微小RNA。脂多糖能够刺激单核细胞并诱导其高表达miR-132[18]。角质形成细胞中miR-132可以抑制NF-κB途径减少趋化因子的产生和吸引白细胞的能力,相反miR-132增加了STAT3和ERK通路的活性[19]。SIRT1减轻动脉粥样硬化大鼠血管内皮炎症改善内皮功能[20],研究发现miR-132靶向SIRT1 3′UTR并降低其活性,从而导致凋亡诱导剂p53乙酰化的增加[6]。原代人脂肪干细胞miR-132过度表达足以诱导NF-κB易位、p65乙酰化,从而激活NF-κB和IL-8和MCP-1的转录,最终导致IL-8、MCP-1表达增加[5]。系统性红斑狼疮和类风湿关节炎患者血清中miR-132、miR-143、miR-155、MiR-29a、表达水平明显升高[21],在类风湿性关节炎患者PBMC中观察到miR-132的表达明显升高[22]。miR-132靶向SIRT1 3′UTR可以促进动脉硬化的进展,同时也可作为炎症性疾病诊断新的生物标志物。
PBMC主要含有单核细胞及淋巴细胞,能够参与炎症过程,在炎症性疾病的调控中起到重要的作用,对动脉粥样硬化性心脏病的发生发展有直接的影响[23]。PBMC、巨噬细胞在免疫激发后能够合成大量NO,以对某些炎性细胞因子(包括IFN-γ、IL-6、IL-1β、TNF-α和IL-15)做出反应,PBMC相关的生物标志物为心血管疾病的发病机制和诊断提供了新的思路[24]。MCP-1作为单核细胞趋化因子的一员,在单核细胞募集、迁移,进而转化为巨噬细胞过程中发挥重要作用,直接参与动脉粥样硬化的进展,并且可能影响到动脉粥硬化斑块的稳定性[25],在AMI发生中具有重要意义。
本研究比较了AMI及NCHD患者PBMC中miR-132及MCP-1表达的差异,发现miR-132及MCP-1的表达量在冠状动脉粥样硬化性心脏病AMI患者PBMC中升高,提示二者与AMI的发生发展有关,miR-132与MCP-1表达量正相关,结合既往研究推测,二者有可能均通过SIRT1/NF-κB信号通路影响AMI的发生,有待细胞实验进一步证实。AMI的发生伴随着心肌坏死,引发心室重构及心功能下降。本研究分析了反映心肌坏死的心肌损伤标志物CK、CKMB、hs-cTnT,反应心功能的NT-proBNP、LVEF、LVFS、CO,以及反应心室重构的LVESD、LVEDD指标,发现AMI组患者CK、CKMB、hs-cTnT、NT-proBNP、LVESD、LVEDD水平均高于NCHD对照组,LVEF、LVFS、CO均低于对照组,提示了AMI患者存在心室的重构及心功能下降。对AMI患者随访收集MACE事件,进而按预后进行亚组分析显示,AMI预后不良亚组miR-132、MCP-1、hs-cTnT、NT-proBNP、LVESD、LVEDD明显高于预后良好亚组,LVEF、LVFS、CO明显低于预后良好亚组,提示AMI患者预后不良,与心肌坏死、心功能下降及左心室重构有关。多因素回归分析显示miR-132、MCP-1、NT-proBNP、LVESD、LVEDD、LVEF、LVFS为AMI患者1年是否发生MACE的独立危险因素。进一步研究显示,AMI患者PBMC中miR-132、MCP-1表达量与心肌损伤标志物CK、CKMB、hs-cTnT相关;与心衰指标NT-proBNP、LVEF、LVFS、CO相关;与左心室重构指标LVESD、LVEDD相关,提示miR-132、MCP-1可能与心肌损伤、心功能、左心室重构相互影响,从而协同AMI的发生、影响AMI的预后,机制尚需深入研究证实。miR-132 、MCP-1诊断AMI的AUC分别为0.92、0.90,联合AUC为0.96,两者联合可有效提高AMI的诊断效能;预测AMI预后不良的AUC分别为0.85、0.74,联合AUC为0.84,提示miR-132 、MCP-1对诊断AMI以及预测预后不良均有一定的价值,为临床上AMI的诊断、治疗和预后评估提供了新的思路。
本研究提示,miR-132与MCP-1在AMI患者PBMC中表达量升高,与心肌损伤的程度、左室重构及左心功能有关,有可能作为AMI诊断及预后评估的生物学新指标。

