PCR-电化学基因芯片法在人乳头瘤病毒感染检测中的价值*
黄姗, 任燕燕, 韦四喜, 毕瑩, 王焰, 马莉, 谭玉洁
(贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004)
人乳头瘤病毒(human papillomavirus, HPV)是一种属于乳多空病毒科的双链环状DNA病毒, 可通过皮肤或黏膜损伤而引起感染[1]。HPV可依据与宫颈癌发生危险性的高低而分为高低危型,HPV6和11等低危亚型可导致90%的肛门外生殖器疣和宫颈细胞低级别改变[2-3];高危型以HPV16和18最为常见,与宫颈癌及宫颈上皮内高度病变(CINⅡ/Ⅲ)的发生密切相关;其他致癌亚型还包括HPV31、33、35、39、45、51、52、56、58、59、66、68、73和82等,其中有12种致癌类型被归为第一类致癌类型[3-4]。根据2018年GLOBOCAN统计,全球估计有57万宫颈癌病例发生,约31万人因宫颈癌导致死亡[5]。高危型HPV持续感染是宫颈癌的重要危险因素,因此,HPV-DNA检测及分型对于宫颈癌早期筛查具有重要意义。目前常用的HPV检测方法有二代杂交捕获法、荧光定量PCR法和基因芯片法等[7-9],Sanger测序法作为基因检测中的参考方法,具有高度特异性,但因步骤繁琐、耗时长及成本较高等原因不能满足临床实验室的检测需要[10];PCR-电化学基因芯片法作为一种新的HPV分型检测方法,集合了电化学、基因信号放大、导流杂交及低密度基因芯片等技术的优点,具有潜在的应用价值,但尚无可靠的临床应用评估。因此,本文将PCR-电化学基因芯片法分别与金标准和临床常用方法在HPV检测结果进行了分析和比较,旨在评估新方法的临床应用价值,为临床HPV分型检测方法的选择和评估提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1标本 收集2019年6—9月于贵州省某三甲医院就诊的310例女性的宫颈脱落细胞,删去1例复检者,共采集309例宫颈脱落细胞样本,受检者年龄18~70岁。
1.1.2仪器与试剂 电化学基因芯片检测仪和人乳头瘤病毒(20个型)基因分型检测试剂盒(PCR-电化学基因芯片法)由中山大学达安基因股份有限公司提供,PCR扩增仪、全自动核酸提取仪和HPV核酸分型检测试剂盒(荧光PCR法)均购自江苏硕世生物科技股份有限公司。
1.2 研究方法
1.2.1取样方法 由专业医师用棉拭子轻轻擦去宫颈口多余分泌物,将宫颈采样刷伸入宫颈口鳞状上皮与柱状上皮交界处,顺时针旋转3~5圈采集宫颈脱落细胞,放入保存液管中密闭送检。
1.2.2样本DNA提取 在 96孔预封装的1号和7号深孔板槽位中加入200 μL样本,按照仪器说明书步骤进行全自动核酸提取。
1.2.3PCR-电化学基因芯片法 在PCR反应管中先后加入22 μL含有PCR缓冲液和引物的反应液和3 μL含有热启动酶、三磷酸脱氧核糖核苷和尿嘧啶糖基化酶的反应液,分别加入提取好的样本DNA和HPV阴、阳性质控品DNA溶液各5 μL,6 000 r/min瞬时离心后,将各反应管放入PCR仪, 50 ℃ 3 min,95 ℃预变性15 min,94 ℃ 45 s、55 ℃ 45 s、72 ℃ 45 s扩增50个循环,72 ℃延伸7 min。扩增结束后,依次将70 μL 含信号探针的HPV分型杂交液Ⅰ、10 μL含蛋白质的杂交液Ⅱ和20 μL含高氯酸钠的杂交液Ⅲ加入PCR产物中,充分混匀,将混匀的液体移入HPV分型电化学传感器(芯片)管中,在DA9100电化学基因芯片检测仪中检测。
1.2.4荧光PCR法 完成DNA提取后,每份待测样本核酸溶液、空白对照和阳性对照按照2 μL/管依次加入18 μL含有针对不同亚型的特异性引物和探针反应体系的PCR八联管中,低速离心。将反应管放入荧光PCR扩增仪进行扩增,按照50 ℃ 5 min酶处理、95 ℃ 10 min预变性、95 ℃ 10 s变性和58 ℃ 40 s退火、延伸及检测荧光,45个循环,反应结束后自动分析获得结果。
1.2.5Sanger测序 委托上海生工健康医学检验实验室有限公司完成。
1.2.6结果判定 PCR-电化学基因芯片法:当位点信号值<8 nA时,视该信号值为背景信号,报告单报告该位点型别为“Target Not Detected”;当位点信号值≥8 nA时,作为型别判定依据。荧光PCR法:在各探针组中的HPV亚型扩增曲线呈典型S型曲线、且CT值≤30,判断相应的HPV亚型为阳性;无典型S型扩增曲线或CT值>30,判断相应的HPV亚型为阴性。
1.2.7敏感性、特异性、阳性预测值、阴性预测值和符合率 敏感性即真阳性率,反映某种方法判定某病变的漏诊率;特异性即真阴性率,反映某种方法判定某病变的误诊率;阴性预测值反映得出阴性结果的样本总数中,真实健康样本数占阴性检测样本总数的百分比;阳性预测值反映出阳性结果的样本中,真实病人样本数占阳性样本检测总数的百分比;符合率又称一致率,是筛检实验判定的结果与标准诊断的结果相同的数占总受检数的比例[11-13]。各自计算公式分别为:敏感性(%)=真阳性/(真阳性+假阴性)×100%,特异性(%)=真阴性/(真阴性+假阳性)×100%,阳性预测值(%)=真阳性/(真阳性+假阳性)×100%,阴性预测值(%)=真阴性/(真阴性+假阴性)×100%,符合率(%)=(真阳性+真阳性)/(真阳性+真阴性+假阳性+假阴性)×100%。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。两种方法结果间差异和一致性比较采用McNemar卡方检验和Kappa一致性检验,P<0.05为差异有统计学意义;Kappa≥0.75为两者一致性好,0.4≤Kappa<0.75为两者一致性中等,Kappa<0.4为两者一致性较差[14]。
2 结果
2.1 3种检测方法的基因型
3种检测方法在309例样本中均可检测到20种HPV基因型,其中最常检测到的亚型为HPV52,其次依次为HPV58、16和53等。见表1。
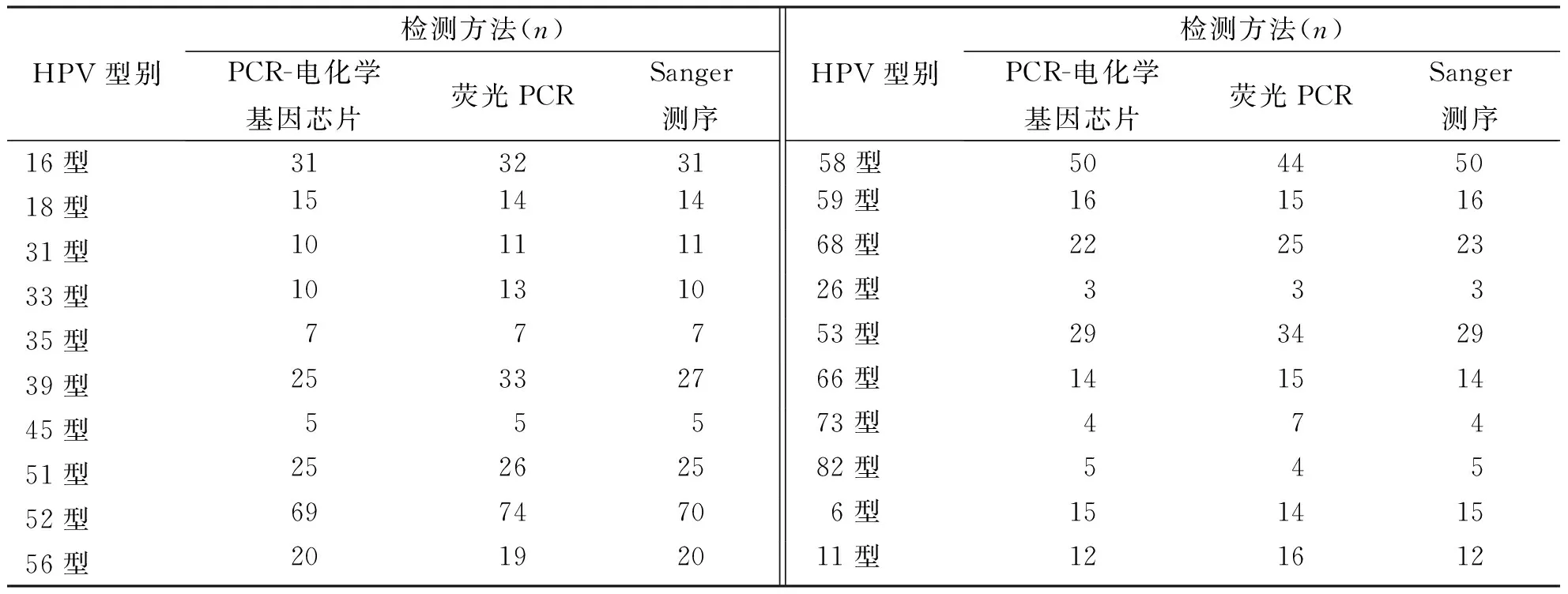
表1 3种检测方法检测人乳头瘤病毒分型结果Tab.1 HPV typing results by three methods
2.2 PCR-电化学基因芯片法与Sanger测序法检测结果比较
2.2.1PCR-电化学基因芯片法与Sanger测序法检测结果一致性分析 经Kappa检验一致性分析表明,两者一致性好(Kappa=0.955,P<0.001)。见表2。

表2 PCR-电化学基因芯片法和Sanger测序法检测结果一致性(n)Tab.2 The consistency of the detection results between PCR-electrochemical gene chip and Sanger sequencing(n)
2.2.2PCR-电化学基因芯片法与Sanger测序不一致结果 两种方法检测结果不一致的样本为5例。见表3。

表3 PCR-电化学基因芯片法与Sanger测序法不一致结果分析Tab.3 Analysis of inconsistent results between PCR-electrochemical gene chip and Sanger sequencing
2.3 PCR-电化学基因芯片法和荧光PCR法检测结果一致性分析
McNemar检验示χ2=309,P=0.063,两种方法的检测结果差异无统计学意义(P>0.05);Kappa检验一致性分析表明,两种方法检测结果的一致性好(Kappa=0.944,P<0.001)。见表4。

表4 PCR-电化学基因芯片法和荧光PCR法检测结果的一致性(n)Tab.4 Consistency of detection results between PCR-electrochemical gene chip and fluorescent PCR(n)
2.4 PCR-电化学基因芯片法与荧光PCR法的诊断效能评价
以Sanger测序法为金标准,分别计算PCR-电化学基因芯片法和荧光PCR法的敏感性、特异性、阳性预测值、阴性预测值和符合率。其中PCR-电化学基因芯片法敏感性为98.44%、特异性为100%、阳性预测值为100%、阴性预测值为92.86%及符合率为98.71%;荧光PCR法敏感性为100%、特异性为98.08%、阳性预测值为99.61%、阴性预测值为100%及符合率为99.68%。
3 讨论
Sanger测序法是基因检测中普遍认可的方法,但由于耗时长和成本高等原因未能在临床广泛开展。目前常用的荧光PCR法,在原有常规PCR基础上加入一条标记2个荧光基团的荧光双标记探针,减少了常规PCR扩增过程中因污染导致的假阳性,具有高扩增效率[20]。而PCR-电化学基因芯片法是一种新的HPV检测方法,将特异性捕获探针分别固定在特制的印刷电路板金电极表面,制备成HPV分型基因芯片,用于捕获PCR多重扩增产物,与信号探针特异结合,其信号探针上标记有二茂铁分子,通过夹心杂交产生电流的变化,进而通过电流信号进行人乳头瘤病毒分型,提高了检测敏感性和特异性。本文以Sanger测序法作为金标准,将PCR-电化学基因芯片法和临床常用的荧光PCR法结果进行了一致性比较和诊断效能评价。结果显示,PCR-电化学基因芯片法与荧光PCR法和Sanger测序法均有高度一致性,提示PCR-电化学基因芯片检测法亦具有较高的可靠性。比较而言,PCR-电化学基因芯片法具有较高的特异性、阳性预测值更高,而荧光PCR法具有更高的敏感度、阴性预测值和总符合率更高。
在将PCR-电化学基因芯片法与Sanger测序法的不一致结果比较发现,PCR-电化学基因芯片法,有4例假阴性,亚型分别为52型、68型和2次39型,分析原因可能为PCR-电化学基因芯片法对52型、39型和68型等亚型敏感性较低;1例检出阳性但与测序法亚型不一致,分析原因可能为出现了非特异性扩增。而荧光PCR法与测序法不一致的样本稍多,其中大多数为亚型分型与测序法不一致。基于本次实验结果中的HPV亚型检测分析,荧光PCR较易漏检HPV58、52、56、51、16、18、59、82、6和11等亚型;多次增加检出HPV39、52、53、81、68、33、73、68、51和11等亚型,有待扩大样本量进一步证实。分析可能的原因如下:(1)当同一样本中有多个亚型同时存在且各亚型含量有差异时,扩增时可能出现引物竞争,导致部分型别无法检出;(2)HPV浓度位于试剂盒检测限浓度附近及低浓度核酸提取效率差异;(3)荧光PCR法可能由于引物、探针和DNA聚合酶等浓度影响,导致PCR反应中出现引物错配以及样本混合其他病原体感染等原因而出现非特异性扩增[21];(4)同一份样本需先后进行3种不同实验方法的检测,实验后期含量少的样本可能出现了DNA降解。因此,本研究显示PCR-电化学基因芯片法和荧光PCR法均与Sanger测序法具有较高的一致性。荧光PCR法由于高敏感性和价格经济,适用于基层开展宫颈癌筛查,而PCR-电化学基因芯片法的高特异性使其有望联合p16/Ki-67、TESTIN和DMBT1等多种分子标志物实现对宫颈癌及癌前病变的精准化诊断[22-23]。临床可根据不同病患需求选择合适的HPV检测方法,减少因不必要的阴道镜检查和过度治疗而引起患者的负面心理影响[24-25],提高筛查效率。
综上,PCR-电化学基因芯片法与Sanger测序法和荧光PCR法一致性均好,且具有高特异性和阳性预测值,可作为临床HPV感染检测方法的补充。

