成人隐匿性自身免疫糖尿病患者发生糖尿病周围神经病变的影响因素*
田婷, 孙心怡, 余江毅, 李楠, 周静波, 徐巍龙
(南京中医药大学附属医院 & 江苏省中医院 内分泌科, 江苏 南京 210000)
成人隐匿性自身免疫糖尿病(latent autoimmune diabetes in adults,LADA)是最常见的成人免疫糖尿病(diabetes mellitus, DM)类型,具有1型DM(type 1 DM,T1DM)和T2DM之间的不同表型、基因型和免疫学特征[1],占所有 DM的2%~12%[2]。LADA易被误诊为T2DM,中国成人初诊T2DM患者中LADA患病率为5.9%[3]。DM周围神经病变(diabetic peripheral neuropathy,DPN)是DM最常见的微血管并发症,是导致DM足及截肢的重要原因,严重降低了患者的生活质量,加重了个人、社会的经济和医疗负担[4]。DPN起病隐匿,发病机制尚未完全明了,且缺乏客观、可靠的早期生物标志物,限制了对疾病的早期诊断和治疗[5]。目前关于LADA并发DPN的研究多集中在欧美人群,国内相关研究很少。因此,本研究回顾性分析102例住院LADA患者的临床资料,探讨DPN发生的危险因素,旨在为LADA患者DPN的早期干预提供依据。
1 对象与方法
1.1 研究对象
选择2013年1月—2020年12月住院治疗的LADA患者为研究对象,患者要求符合《中华医学会糖尿病学分会关于成人隐匿性自身免疫糖尿病诊疗的共识》中LADA的诊断标准[6]和《中国2型糖尿病防治指南(2017年版)》DPN诊断标准[7],排除DM急性并发症、感染、严重肝肾功能不全、妊娠哺乳期、甲状腺功能异常及其他病因引起的神经病变(如颈腰椎病变、格林-巴利综合征、严重动静脉血管性病变、维生素B12缺乏、外源性毒素及药物等)。 共纳入LADA患者102例,男59例、女43例,年龄24~75岁、平均(49.05±13.07)岁;分为未合并DPN者(非DPN组)53例和合并DPN者(DPN组)49例。选取同期住院的T2DM合并DPN患者49例作为对照组。DPN组、非DPN组及对照组患者的一般资料见表1。所有患者均签署知情同意书。
1.2 研究方法
1.2.1DPN检查及诊断 检测3组患者住院期间踝反射、针刺痛觉、震动觉、压力觉、温度觉,采用肌电诱发电位仪MEB-9200K(日本光电工业株式会社)检查神经传导功能。DPN诊断标准:(1)明确的DM病史;(2)诊断DM时或之后出现的神经病变;(3)有疼痛、麻木、感觉异常等临床症状者,踝反射、针刺痛觉、震动觉、压力觉、温度觉5项检查中任1项异常;无临床症状者,5项检查中任2项异常;神经肌电图检查示神经传导速度异常;同时排除其他病因引起的神经病变。
1.2.2一般资料 收集3组患者病史和体格检查资料(包括性别、年龄、病程、吸烟史、DM家族史、舒张压和收缩压、身高、体质量),并计算体质量指数[(body mass index,BMI;BMI=体质量(kg)/身高2(m2)]。
1.2.3空腹血样检测 取3组患者空腹肘静脉血5 mL,全血标本采用全自动糖化血红蛋白分析仪(高效液相色谱法,日本Tosoh公司)检测糖化血红蛋白(glycated hemoglobin A1c,HbA1c);分离血清,采用Olympus AU2700 全自动生化分析仪(日本Olympus公司)检测空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血尿酸(serum uric acid,SUA)、血肌酐(serum creatinine,Scr)、胱抑素C(cystatin C,CysC)及视黄醇结合蛋白(retinol binding protein,RBP),采用雅培I2000全自动化学发光免疫分析仪(美国雅培公司)检测空腹C肽(fasting C-peptide,FCP),采用化学发光法检测胰岛自身抗体3项[胰岛细胞抗体(islet cell antibody,ICA)、谷氨酸脱酸酶抗体(glutamic acid decarboxylase antibody,GADA)及胰岛素自身抗体(insulin autoantibody,IAA)]。
1.2.4餐后血样检测 3组患者空腹抽血后,进食标准馒头餐100 g,自第一口开始计时,于120 min取各组患者肘静脉血3 mL,分离血清,采用Olympus AU2700 全自动生化分析仪和雅培I2000全自动化学发光免疫分析仪分别检测餐后2 h血糖(2 h postprandial blood glucose,PBG)和餐后2 h C肽(2 h postprandial C-peptide,PCP)。
1.2.5并发症和合并症 收集2组LADA患者住院期间DM慢性并发症(包括DM视网膜病变、肾脏病变、周围血管病变)和合并症(包括高血压、脑梗死、冠心病及甲状腺疾病)的发生情况。
1.3 统计学分析
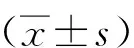
2 结果
2.1 一般资料
DPN组LADA患者DM病程大于非DPN组(P<0.05),但2组LADA患者性别构成、年龄、吸烟史、DM家族史、BMI、收缩压及舒张压水平比较,差异无统计学意义(P>0.05);DPN组LADA患者与对照组比较,年龄较小、DM病程较短、BMI及收缩压水平较低(P<0.05),但2组患者性别构成、吸烟史、DM家族史、舒张压水平比较,差异无统计学意义(P>0.05)。见表1。
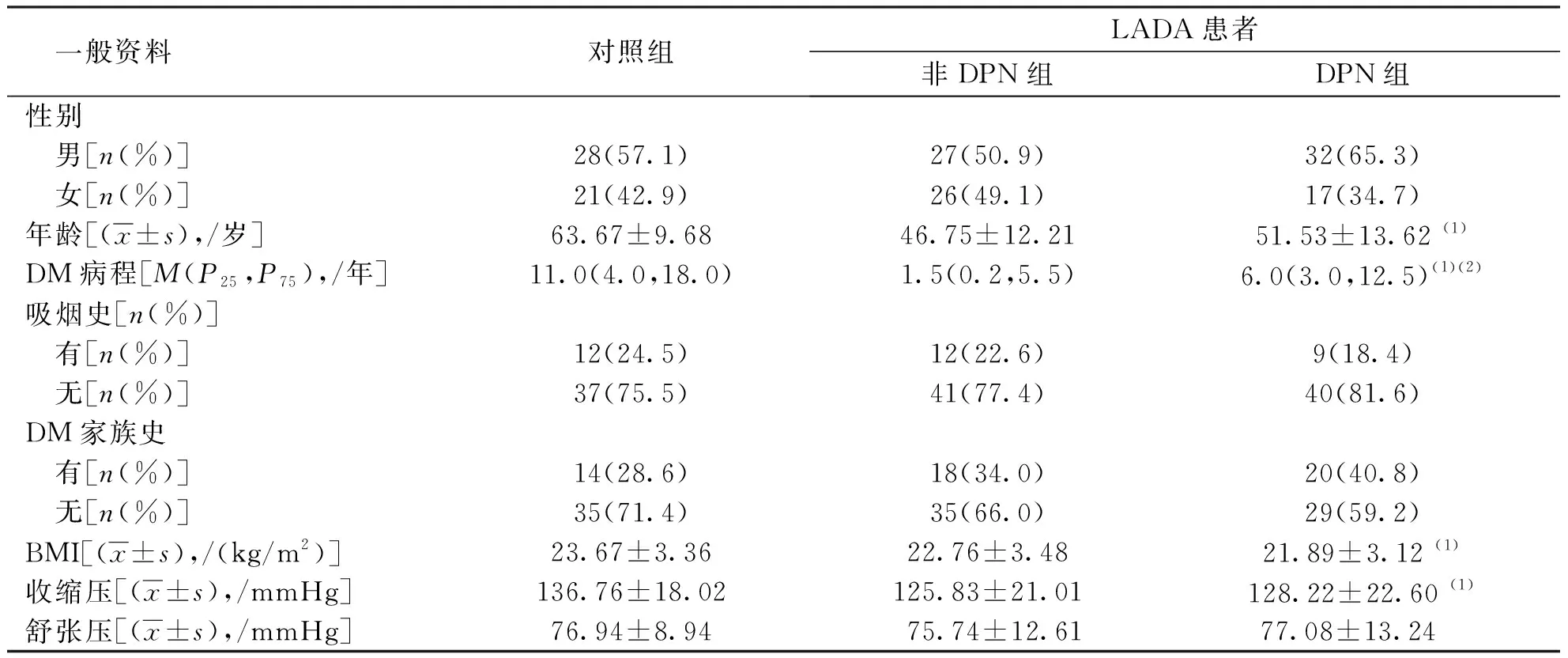
表1 各组患者的一般资料Tab.1 Comparison of general information in each group
2.2 临床生化指标
DPN组LADA患者PCP水平低于非DPN组(P<0.05),但2组LADA患者HbA1c、FBG、PBG、FCP、TC、TG、HDL-C、LDL-C、SUA、Scr、CysC及RBP水平比较,差异均无统计学意义(P>0.05);与对照组比较,DPN组LADA患者HbA1c、FBG、HDL-C水平较高(P<0.05),FCP、PCP、TG、SUA、CysC及RBP水平较低(P<0.05),但PBG、TC、LDL-C及Scr水平差异无统计学意义(P>0.05)。见表2。
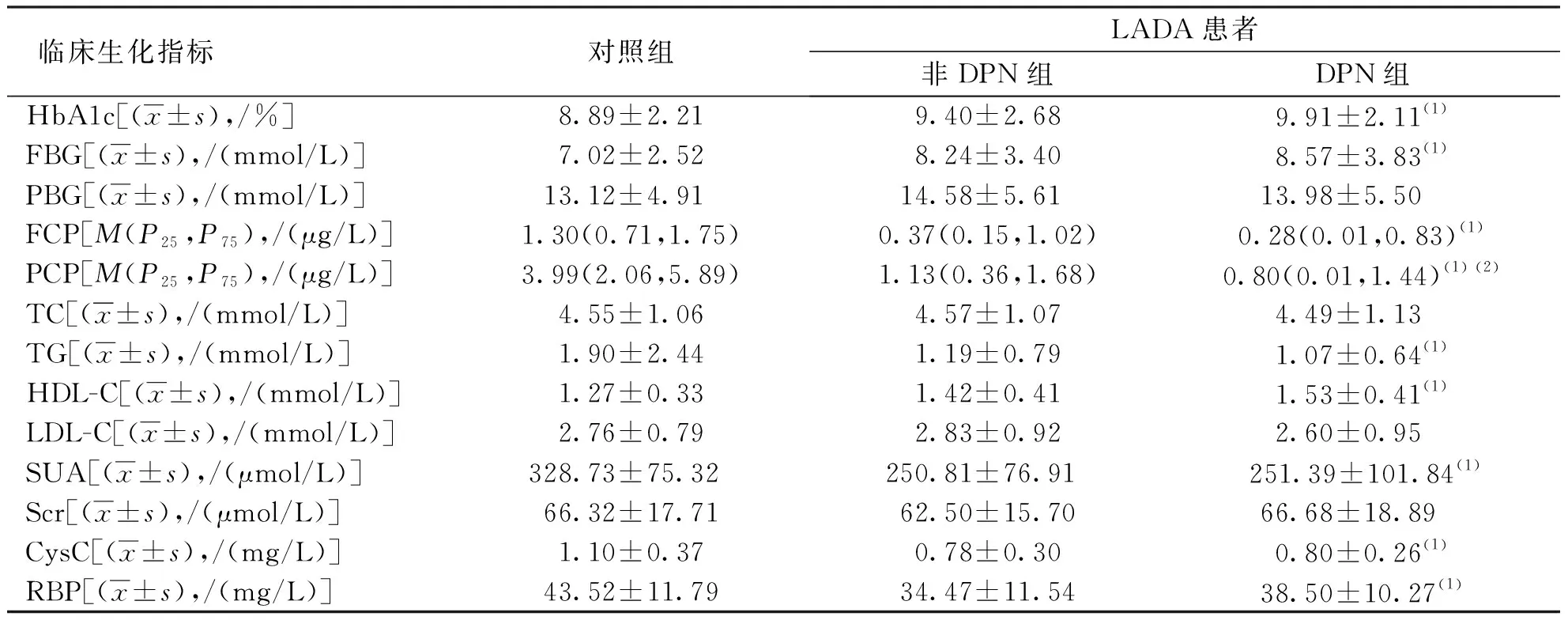
表2 各组患者的临床生化指标Tab.2 Comparison of clinical biochemical indicators in each group
2.3 LADA患者的并发症和合并症
DPN组和非DPN组LADA患者DM慢性并发症及合并症的发生比例比较,差异均无统计学意义(P>0.05)。见表3。
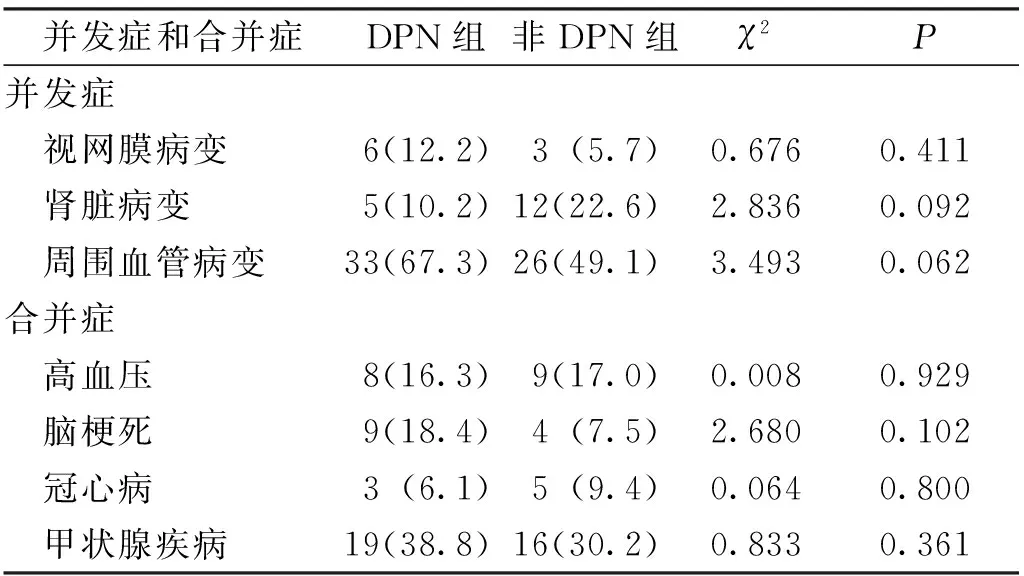
表3 DPN组和非DPN组LADA患者的并发症及合并症[n(%)]Tab.3 Comparison of complications and comorbidities between two groups of LADA patients[n(%)]
2.4 多因素logistic回归分析
以LADA患者是否合并DPN为因变量,以性别、年龄、DM病程、BMI、FCP、PCP、HDL-C及RBP为自变量,进行多因素logistic回归分析,结果显示,DM病程和PCP是 LADA患者DPN的影响因素(P<0.05)。见表4。

表4 LADA患者DPN影响因素的logistic回归分析Tab.4 Logistic regression analysis of influencing factors of DPN in LADA patients
3 讨论
DPN发病机制复杂,包括高血糖途径,如多元醇、己糖胺及蛋白激酶C通路的激活,晚期糖基化终产物的积累,氧化应激,以及血管损害和生长因子缺乏等,这些因素共同作用导致神经元功能障碍和神经损伤[4, 8]。国内外研究表明,与年龄、病程、血糖控制相匹配的T2DM相比,LADA患者表现出更严重的神经结构功能变化,尤其是小纤维神经病变,提示其不同的潜在病理生理机制[9-11]。除了代谢因素外,免疫介导的损伤和神经系统内胰岛素抵抗的增加,可能参与并加速LADA患者神经功能障碍的进展[12-13]。胰岛素是支持轴突生长和Schwann细胞生理的有效神经营养因子,同时胰岛素受体在周围神经、Ranvier节点和Schwann细胞膜上大量表达[14-16];LADA患者外周神经系统中胰岛素抵抗的早期发展将导致对胰岛素的神经营养特性无反应和Schwann细胞功能受损,可能导致外周神经损伤增加[9]。
T1DM和T2DM的大量研究表明,DM病程与DPN独立相关[17-19]。本研究结果也证实了这一点。与非DPN组比较,DPN组LADA患者病程更长;校正性别、年龄等混杂因素后,logistic回归分析显示,DM病程是LADA患者发生DPN的危险因素,病程越长,DPN发生率越高,与Wang等[11]研究一致。国外一项30年随访研究显示,LADA患者于诊断后的前9年中微血管并发症风险低于T2DM,随后微血管并发症风险却更高[20],这主要归因于LADA患者血糖控制更差[1]。本研究结果也显示,DPN组LADA患者病程较对照组短,胰岛功能更差,具有更高的血糖负荷(HbA1c及FBG水平更高)。尽管本研究中DPN组与非DPN组LADA患者HbA1c、FBG、PBG水平无差异,但这并不能否定血糖管理在防治DPN中的重要作用[19, 21]。此外,有研究显示,肥胖、高TG水平、低HDL-C水平与DPN相关[17, 22]。本研究未发现BMI、TG、HDL-C与DPN的发生风险有统计学意义(P<0.05),可能是由于LADA患者往往体型较瘦,具有较低的BMI、TG水平及较高的HDL-C水平有关[2-3]。
C肽又称连接肽,是胰岛β细胞中丝氨酸蛋白酶裂解胰岛素原的产物,其分泌量与胰岛素平行[23]。众多研究表明,C肽具有重要的生理作用,在体外和体内条件下通过抵抗高血糖途径引起的炎症反应而发挥细胞保护作用[24]。C肽通过激活腺苷酸活化蛋白激酶α(adenosine monophosphate-activated protein kinase α,AMPKα)和抑制转谷氨酰胺酶-2抑制内皮细胞中活性氧(reactive oxygen species,ROS)的形成,还可通过降低ROS介导的核因子-κβ(nuclear factor-kappabeta,NF-κβ)的激活来降低循环免疫细胞的促炎基因表达,从而抑制细胞因子、趋化因子及细胞黏附的表达,并通过抑制caspase-3减少内皮细胞凋亡[24-25]。此外,C肽是一种已知的内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性和表达的有效刺激因子,从而进一步有助于其抗炎作用[25]。本研究显示,PCP水平降低是LADA患者发生DPN的危险因素。Qiao等[26]关于中国社区T2DM患者的研究也表明,FCP、PCP水平与DPN呈负相关。人C肽的生物活性有助于预防DPN等血管并发症,在动物模型和T1DM患者中进行的研究表明,替代剂量的C肽可以改善DPN,防止甚至逆转神经结构变化的发展[27]。尽管实验研究取得了积极的成果,但迄今为止,临床尚未开发出成功的C肽替代疗法。
综上所述,DM病程是LADA患者并发DPN的危险因素,PCP为保护因素。因此,早期筛查和最大限度的保留残余β细胞功能是临床上预防和延缓LADA患者DPN的关键措施。目前普遍认为,胰岛素治疗对LADA患者有效且安全,除降糖作用外还可以发挥抗炎及免疫调节作用[28]。目前关于LADA免疫干预的数据非常有限,需要进行更广泛的研究。此外,受横断面设计、样本量较小的限制,本研究结论尚需要大样本前瞻性的研究来进一步证实。

