非洲猪瘟病毒360-12L蛋白的原核表达及其多克隆抗体制备
蒋亚君,陈世钰,鑫 婷,郭晓宇,王召阳,刘雪婷,崔 帅,王 洋,朱鸿飞,贾 红
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.华南农业大学,广州 510630)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的急性、热性动物传染病,是目前对家猪影响最大的疾病之一,具有高度传染性和致死性。1921年,Montgomery将其鉴定为不同于经典猪瘟病毒(Classical swine fever virus,CSFV)的一种病毒[1],在肯尼亚短暂流行后传入南非和安哥拉,在撒哈拉以南非洲国家、马达加斯加、撒丁岛形成大流行[2],自2007年以来,东欧国家及部分亚洲国家报道了大量ASF疫情[3],2018年8月中国首次报道,随后蒙古国、越南、日本、菲律宾、韩国、南非等均报道了相关疫情[4-5]。由于病毒本身复杂、基因多样性、与宿主互作机制不明等原因[6],目前仍缺乏特异性治疗方法和有效的商业疫苗,主要通过早期检测、严格的生物安全措施、扑杀感染动物等方法进行防控,对全球养猪业造成巨大经济损失。
ASFV是具有囊膜的双链DNA病毒,是非洲猪瘟病毒科、非洲猪瘟病毒属的成员[7]。根据毒株不同,病毒基因组长度为170~194 kb,可编码众多蛋白[8]。 ASFV Georgia 2007/1株多基因家族(MGF)360家族有15个成员,分布于基因组的两端,携带MGF多个拷贝的ASFV毒株基因组更大,毒力更强[9]。在稳定的细胞系中培养,基因组左侧的MGF360及其他病毒基因部分缺失,可导致毒力下降[10]。其中,12L基因位于基因组左侧末端的重复区域,可通过阻断importinα和NF-κB的信号通路,抑制IFN-Ⅰ的产生,可能是ASFV逃避宿主先天免疫的新策略[11],但其免疫调控机制仍需进一步研究。基于此,本研究拟构建12L基因的原核表达系统,优化其诱导表达温度,纯化获得重组蛋白,并制备鼠源多克隆抗体,以期为后续该蛋白的进一步生物学功能研究、血清学诊断方法的建立提供依据。
1 材料与方法
1.1 材料
pET-28a(+)载体、pEGFP-N1载体、HEK 293T细胞均由北京畜牧兽医研究所兽医公共卫生安全与管理创新团队保存;BamHⅠ和XhoⅠ限制性内切酶均购自TaKaRa公司;T4 DNA连接酶购自NEB公司;2×RapidTaqMax Master Mix、大肠杆菌BL21(DE3)和DH5α感受态细胞均购自南京诺唯赞生物技术有限公司;DNA Marker购自北京全式金生物技术有限公司;蛋白质分子质量标准(26616)购自Thermo公司;辣根过氧化物酶标记羊抗鼠IgG、Alexa Flour 594-Conjugated Goat anti-Mouse IgG(H+L)均购自北京中杉金桥生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司;异丙基-β-D-硫代半乳糖苷(IPTG)、Western blotting发光液均购自天根生化科技(北京)有限公司;考马斯亮蓝购自BBI公司;Ni Bestarose FF、DEAE Bestarose FF、BXK26/100层析柱、BXK16/20层析柱均购自博格隆公司;Omega质粒提取试剂盒、Omega胶回收试剂盒均购自宝林可(北京)生物科技有限公司;碳酸纤维素膜(NC膜)购自宝生物工程(大连)有限公司;SDS-PAGE预制胶及其缓冲液均购自南京金斯瑞生物科技股份有限公司。6周龄雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 引物设计与合成
根据GenBank ASFV参考序列(登录号:NC_044959.2)合成MGF 360-12L基因,合成基因全长1 053 bp;根据参考序列用Primer Premier 5.0软件设计引物,并在上、下游引物中分别加入BamHⅠ和XhoⅠ酶切位点及其保护性碱基,引物序列为:上游引物ASFV-12L-F:5′-CGCGGATCCATGTT-GCCTTCCCTGCAA-3′;下游引物ASFV-12L-R:5′-CCGCTCGAGTCATCTTAAATCATAGG-3′,下划线处分别为BamHⅠ和XhoⅠ酶切位点,目的基因及引物均送由生工生物工程(上海)股份有限公司进行合成。
1.3 重组质粒的构建
以合成的pCMV-3×Flag-12L为模板,利用设计的引物扩增目的片段。PCR扩增体系50 μL:2×RapidTaqMaster Mix 25 μL,引物ASFV-12L F/R各2 μL,阳性质粒模板 1 μL,ddH2O 20 μL;PCR反应条件:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,共35个循环;72 ℃延伸8 min。将 pET-28a(+)载体和pEGFP-N1质粒分别双酶切,回收的目的基因DNA片段分别与线性化的pET-28a(+)质粒、pEGFP-N1质粒过夜连接,将连接产物分别转化大肠杆菌BL21(DE3)和DH5α感受态细胞,涂布于LB固体平板(含卡那霉素50 μg/mL),37 ℃过夜培养,挑取单克隆接种于LB液体培养基(含卡那霉素50 μg/mL),37 ℃、200 r/min振荡培养,并由北京擎科新业生物技术有限公司测序,将测序结果正确的重组菌命名为pET-28a-12L/BL21和pEGFP-N1-12L/DH5α,提取的重组质粒进行双酶切鉴定。
1.4 12L重组蛋白的诱导表达及可溶性分析
将重组菌pET-28a-12L/BL21培养至D600 nm值为0.6~0.8时,加入终浓度为1 mmol/L的IPTG;分别于37和16 ℃进行诱导表达,每2 h取样一次,收集菌体,煮沸裂解,10% SDS-PAGE分析不同温度下重组菌的表达情况,取表达量较高的样品组,超声破碎,4 ℃、10 000×g离心10 min,收集上清及沉淀,SDS-PAGE对表达产物进行可溶性分析。
1.5 12L重组蛋白的纯化
根据1.4操作方法对重组菌pET-28a-12L/BL21进行诱导表达,37 ℃ 6 h后以8 000 ×g离心10 min收集菌体,超声破碎后离心收集沉淀,包涵体经变性、复性过程[12],复性蛋白经Ni柱亲和层析进行纯化;采用梯度洗脱方式,先用平衡缓冲液(20 mmol/L pH 8.0 Tris-HCl+300 mmol/L NaCl+30 mmol/L咪唑)平衡柱子;再用洗涤缓冲液(20 mmol/L pH 8.0 Tris-HCl+500 mmol/L NaCl+60 mmol/L 咪唑)洗脱杂蛋白;最后用洗脱缓冲液(20 mmol/L pH 8.0 Tris-HCl+300 mmol/L 咪唑)洗脱目的蛋白,将纯化后的蛋白命名为12L重组蛋白。采用BCA蛋白定量试剂盒进行定量,SDS-PAGE鉴定其纯度。
1.6 鼠抗12L重组蛋白多克隆抗体制备及12L重组蛋白鉴定
取50 μg 12L重组蛋白与等量弗氏完全佐剂混匀、乳化,采用腹部多点皮下注射方式免疫6~8周龄雌性BALB/c小鼠,对照组注射等体积的PBS,在首次免疫后2、4周时,将蛋白与等量弗氏不完全佐剂混匀乳化后加强免疫,三免后1周采血,收集血清。
取纯化的12L重组蛋白进行Wertern blotting鉴定,10% SDS-PAGE后转膜(NC膜),经5%脱脂乳37 ℃封闭1 h后,加入稀释的小鼠血清(1∶1 000稀释)为一抗,辣根过氧化物酶标记山羊抗鼠IgG(1∶5 000稀释)为二抗,鉴定蛋白反应原性。
1.7 12L重组蛋白多克隆抗体效价检测
采用方阵滴定法将纯化的12L重组蛋白倍比稀释后包被酶标板,4 ℃过夜孵育;PBST洗板(5 min/次,3次)后加入5%脱脂乳(PBS配制)于37 ℃封闭2 h;PBST再次洗涤3次,加入倍比稀释的免疫后小鼠血清为一抗,37 ℃ 孵育1 h,PBST洗涤3次;以加入辣根过氧化物酶标记山羊抗鼠IgG(1∶5 000稀释)为二抗,37 ℃孵育1 h,PBST洗涤后,加入TMB显色 20 min,用2 mmol/L HCl终止反应后读取D450 nm值。根据方阵结果筛选最佳包被浓度和反应条件,建立12L重组蛋白抗体间接ELISA方法,采用该方法测定免疫小鼠多克隆抗体的效价。
1.8 12L重组蛋白多克隆抗体的间接免疫荧光试验(IFA)鉴定
将HEK 293T细胞铺于24孔板,待细胞长至汇合度为70%~80%时,将pEGFP-N1-12L、pEGFP-N1分别转染至HEK 293T细胞(1 μg/mL质粒DNA),48 h后于荧光显微镜中观察。弃去上清,用PBS洗涤3次后,用预冷的无水乙醇固定30 min,PBS洗涤3次,加入0.1% Triton X-100 室温静置10 min,PBS清洗3次,1% BSA溶液封闭,以12L重组蛋白免疫的小鼠血清和PBS免疫的小鼠血清(1∶100稀释)为一抗,Alexa Flour 594-Conjugated Goat anti-Mouse IgG(H+L)(1∶50稀释)为二抗,37 ℃避光孵育 1 h;PBS洗涤5次后于荧光显微镜下观察荧光。
2 结 果
2.1 12L基因重组质粒的构建及鉴定
以合成的质粒为模板,扩增到约1 053 bp的目的片段(图1),经胶回收、酶切、连接、转化后,构建重组质粒,构建好的重组质粒pET-28a-12L和重组质粒pEGFP-N1-12L进行BamHⅠ和XhoⅠ双酶切,结果显示,获得大小分别约为5 000 bp的载体条带和1 053 bp的目的条带(图2A、2B)。阳性质粒测序显示,与ASFV参考株Georgia 2007/1的12L基因100%同源,表明重组质粒pET-28a-12L和pEGFP-N1-12L构建正确。
2.2 12L重组蛋白的诱导表达及可溶性分析
测序正确的重组菌pET-28a-12L/BL21经IPTG诱导,SDS-PAGE鉴定,结果显示,37 ℃诱导 6 h后表达量较高,表达产物在54.7 ku处出现目标条带(图3),与预期大小相符,表明重组蛋白诱导表达成功。
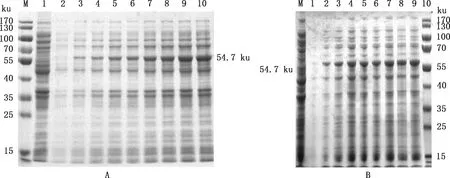
①A,16 ℃诱导重组蛋白的表达;B,37 ℃诱导重组蛋白的表达。②M,Thermo26616预染Marker;1,pET-28a/BL21;2,未诱导的pET-28a-12L/BL21;3~10,分别为诱导2、4、6、8、10、12、14和16 h样品①A,Expression of recombinant protein at 16 ℃;B,Expression of recombinant protein at 37 ℃.②M,Thermo26616 pre-dyed Marker;1,pET-28a/BL21 empty vector;2,pET-28a-12L/BL21 without induction;3-10,Samples collected at 2,4,6,8,10,12,14 and 16 h after induction,respectively图3 不同温度条件下12L重组蛋白诱导表达情况Fig.3 Expression of recombinant protein 12L at different temperature conditions
2.3 12L重组蛋白的纯化及鉴定结果
将诱导后的pET-28a-12L/BL21破碎上清及沉淀分别进行SDS-PAGE,对表达产物进行可溶性分析。结果显示,该蛋白在沉淀中出现,显示其为包涵体表达(图4A)。将表达的包涵体变性、复性后再进行Ni柱亲和层析纯化和SDS-PAGE鉴定,由图4B可知,在54.7 ku处出现目标条带,且较单一,表明12L重组蛋白纯化效果较好,纯度较高。BCA测定12L重组蛋白浓度为1.71 mg/mL。 Western blotting检测显示,在54.7 ku处出现目标条带(图5),表明12L重组蛋白反应原性较好。
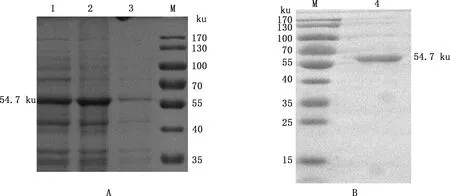
1,pET-28a-12L/BL21 37 ℃诱导6 h;2,pET-28a-12L/BL21 37 ℃诱导6 h破碎后沉淀;3,pET-28a-12L/BL21 37 ℃诱导6 h破碎后上清;M,Thermo26616预染Marker;4,纯化的12L重组蛋白1,Lysate of pET-28a-12L/BL21 after induced at 37 ℃ for 6 h;2,Supernatant of induced pET-28a-12L/BL21 at 37 ℃ for 6 h;3,Precipitation of induced pET-28a-12L/BL21 at 37 ℃ for 6 h;M,Thermo26616 pre-dyed Marker;4,Purified recombinant protein 12L图4 12L重组蛋白的表达(A)及纯化鉴定(B)Fig.4 Expression (A) and purification identification (B) of recombinant protein 12L
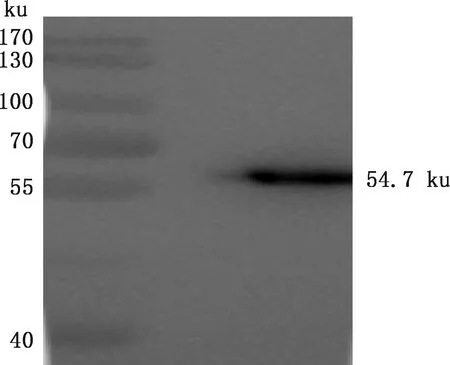
图5 12L重组蛋白Western blotting鉴定Fig.5 Detection of recombinant protein 12L by Western blotting
2.4 重组蛋白多克隆抗体效价检测结果
利用建立的间接ELISA方法对制备的12L重组蛋白的鼠源多克隆抗体进行效价测定,通过方阵测定法,将纯化的12L重组蛋白倍比稀释后包被酶标板,结果显示,12L重组蛋白的最佳包被浓度为2.5 μg/mL,制备的多克隆抗体稀释度为1∶512 000时,其阳性血清和阴性血清仍具有显著差异,阳性血清D450 nm值大于阴性血清D450 nm值2倍以上(图6),表明其效价较高。
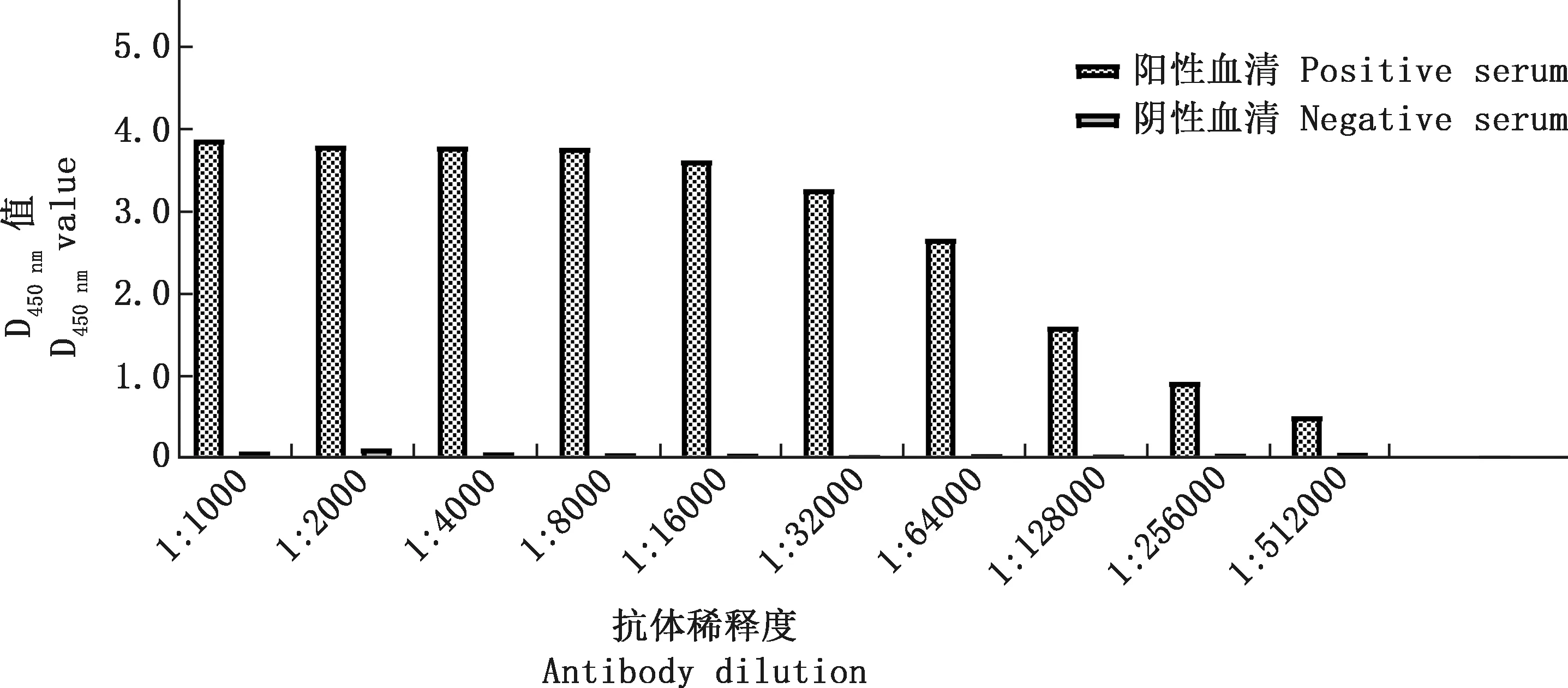
图6 12L重组蛋白鼠源多克隆抗体的ELISA效价测定Fig.6 ELISA titer determination of mouse polyclonal antibody against recombinant protein 12L
2.5 重组蛋白的IFA检测结果
采用IFA检测12L重组蛋白鼠源多克隆抗体的反应性,结果显示,转染48 h后pEGFP-N1-12L和pEGFP-N1转染后的HEK 293T细胞中均可观察到绿色荧光(图7A、7B),表明12L瞬时表达成功。将转染细胞用无水乙醇固定后经IFA检测,结果显示,12L重组蛋白免疫小鼠血清可特异性识别HEK 293T细胞中表达的12L蛋白,出现特异性红色荧光,而以未免疫小鼠血清为一抗的对照细胞无荧光(图7C、7D),表明所制备的鼠抗ASFV 12L多克隆抗体与真核表达的12L重组蛋白发生特异性反应,特异性较强。
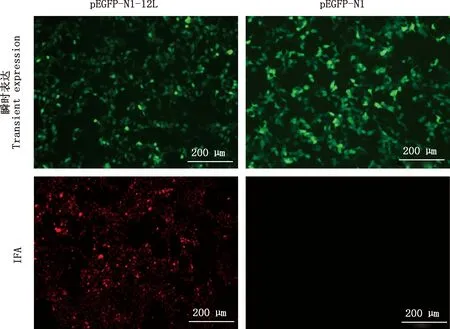
图7 融合蛋白瞬时表达及IFA鉴定结果(100×)Fig.7 Transient expression and IFA analysis of fusion protein (100×)
3 讨 论
ASFV高度稳定,可通过感染猪、污染的猪肉产品和饲料等多种途径传播[13],具有急性、热性、高度传染性的特点,对家猪的致死率可达100%[14],对全球养猪业和国民经济造成严重威胁。灭活苗不能提供保护,传代培养的弱毒疫苗安全性不够,因此,目前疫苗研究主要集中于开发靶向基因缺失或亚单位改良活病毒上[15]。其中,MGF家族是基因缺失疫苗中常用的靶点之一,研究显示,在Benin 97/1和Georgia株中敲除MGF家族基因可提供同源保护[16-19],但关于多基因家族和其他已知基因无序列相似性,关于其基因功能研究较少[17]。 ASFV 12L全长蛋白可显著抑制IRF9和IFN-β刺激介导的ISRE启动子活化,从而抑制IFN-β介导的免疫应答和抗病毒作用[20],可能是ASFV免疫逃逸策略之一。
目前大肠杆菌表达系统广泛应用于各类病原微生物蛋白的表达,是研究最为成熟的表达系统,易获得大量的高纯度蛋白及特异性高的抗体,该方法操作简单、高效。目前ASFV多种蛋白如CP204[21]、p30[22]、B438L[23]和EP153R[24]等均构建了原核表达系统。原核表达蛋白可用于血清学检测方法的建立,随着ASF疫情发展,抗体检测具有显著优势,可检出核酸检测中漏掉的样本,为疫情提供更全面的监测[25]。目前ASFV原核表达蛋白如p72、EP364R和pA104R等[26-28]均已建立ELISA检测方法。但关于ASFV 12L蛋白相关系统报道较少,因此,本研究选择在原核表达系统中诱导表达12L蛋白,并制备其鼠源多克隆抗体,以期为之后血清学诊断方法开发及360-12L基因功能研究提供生物材料。
本研究合成ASFV Georgia 2007/1株的360-12L基因,将其连接至pET-28a(+)和pEGFP-N1 2个载体,成功构建了12L基因的原核表达系统和真核表达系统,对比其他文献显示,这类高分子质量和低水溶性蛋白在原核表达过程中易聚集生成包涵体[29]。有研究人员将ASFV K205R和B602L蛋白与类弹性蛋白多肽(ELP)融合表达获得了可溶性表达,通过相变循环纯化,简单高效,且后期可切除ELP标签,避免了与带标签的亚单位疫苗检测的交叉反应[30-31],值得参考。可能由于蛋白表达量较高,缺少充足的时间进行蛋白折叠,在本试验中获得的蛋白也为包涵体蛋白,本试验通过降低诱导温度仍未获得可溶性表达产物,后期可尝试其他载体和标签方式构建表达系统。此次经变性复性后获得的12L重组蛋白,经试验证明具有良好的免疫原性,纯度较高,反应原性较好,表明纯化的重组蛋白具有一定的生物活性和应用潜力。同时,本试验所制备的鼠源多克隆抗体效价>1∶512 000,且具有较高的特异性,可用于后续试验。本研究构建的真核表达系统有助于进一步研究12L基因在病毒中的功能,可通过免疫共沉淀、酵母双杂交等试验筛选互作蛋白,进行蛋白生物学功能研究及病毒相关免疫保护性研究,进一步研究病毒复杂的致病机制。
4 结 论
本试验利用原核表达系统成功表达12L重组蛋白,筛选其最佳诱导温度并分析其在大肠杆菌中的表达情况,并制备了鼠抗ASFV 12L蛋白多克隆抗体,为进一步研究12L蛋白结构、生物学功能、ASFV疫苗研制及诊断方法开发提供生物材料。
——一道江苏高考题的奥秘解读和拓展

