15 株湖南省猪圆环病毒2 型全基因组测序与遗传进化分析
何世成,王紫微,2,丁朝阳,胡巧云,唐小明,王卫国,谢怡灵,王昌建
(1.湖南省动物疫病预防控制中心,湖南长沙 410014;2.衡阳技师学院,湖南衡阳 421101;3.娄底市动物疫病预防控制中心,湖南娄底 417000)
猪圆环病毒(porcine circovirus,PCV)是圆环病毒科圆环病毒属成员,具有环状单股负链DNA 基因组,是较小的动物病毒之一[1],目前已发现PCV1、PCV2、PCV3 及PCV4 等4 种血清型[2]。
PCV2 基因组全长1 767 或1 768 bp,包含11个潜在开放阅读框(ORF),其中ORF1、ORF2为主要的开放阅读框。ORF1 的主要功能是编码与复制酶相关的Rep 蛋白和Rep'蛋白[3],ORF2 主要编码衣壳蛋白(Cap 蛋白),而Cap 蛋白与病毒感染及免疫原性密切相关。PCV2 根据系统进化树,可分为PCV2a、PCV2b、PCV2c、PCV2d 等8 种基因亚型[4]。1991 年,Clark 等[4]在加拿大西部地区表现断奶仔猪多系统衰竭综合征的病猪体内分离出一种PCV,发现其与PCV1 的抗原性和致病性均存在差异,因此将该病毒命名为PCV2。此后,全球多国猪场发现了PCV2 感染。1995 年,我国台湾地区首次发现PCV2 感染[5]。目前我国PCV2感染率较高,流行广泛,其中PCV2d 为优势流行亚型[6-8]。
本研究通过了解湖南省PCV2 的遗传变异情况,以期为PCV2 感染的免疫防控、疫苗研究和实验室诊断提供依据。
1 材料与方法
1.1 材料
在湖南省821 份临床病料和屠宰场猪淋巴结样品中,通过检测获得30 份PCV2 阳性Ct ≤30的样品核酸。
1.2 主要试剂和设备
PCV1 和PCV2 型双重实时荧光PCR 检测试剂盒,购自北京世纪元亨动物防疫技术有限公司;2×TaqMaster Mix,购自安诺论生物科技有限公司;50×TAE 缓冲液,购自北京索莱宝科技有限公司;Agarose,购自BIOWEST 公司;Super GelRed 核酸凝胶染料10 000×,购自苏州宇恒生物科技有限公司;DL 2 000 DNA Marker 和DNA 凝胶回收试剂盒,购自东盛生物科技有限公司;PCR 扩增仪,购自西安天隆科技有限公司;琼脂糖凝胶电泳仪,购自北京六一仪器厂;紫外凝胶成像仪,购自北京赛智创业科技有限公司。
1.3 引物设计
PCV2 全基因P1 和P2 扩增引物对,根据Gagnon 等[9]设计的引物合成(表1)。

表1 PCV2 全基因PCR 扩增的引物信息
1.4 全基因组扩增及测序
PCV2 扩增反应总体系为25.0 μL:无菌无核酸酶水7.5 μL,2×TaqMaster Mix 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,DNA 模板3.0 μL。PCV2 扩增反应程序:95 ℃预变性10 min;95 ℃变性20 s,59 ℃(P1)/56 ℃(P2)退火30 s,72 ℃延伸1 min,共37 次循环;72 ℃延伸10 min。反应完成后取5.0 μL 扩增产物于1.0%的琼脂糖凝胶中电泳35 min,紫外凝胶成像仪中观察结果、拍照。阳性条带切胶回收后编号,送擎科生物有限公司进行双向测序。
1.5 遗传进化分析
将同一编号的4 个不同测序结果,通过DNAstar 中SeqMan 软件进行拼接获得全基因序列,选取国内外22 株PCV2 序列作为参考(表2),利 用NCBI 的BLAST 比对分析。PCV2 全基因及ORF2 的核苷酸序列同源性,利用DNAstar 中MegAlign 软件进行比对;系统遗传进化树,使用MEGA-X64 生物软件绘制,通过软件中Clustal W比对方法进行比对;采用Neighbor-Joining法构建进化树。

表2 PCV2 参考序列
2 结果与分析
2.1 全基因组扩增
使用P1、P2 引物,对PCV2 阳性样品进行全基因组扩增,成功扩增出亮带,产物与预期片段一致,分别为1 045、1 254 bp(图1)。共获得15株PCV2 全基因组(表3)。
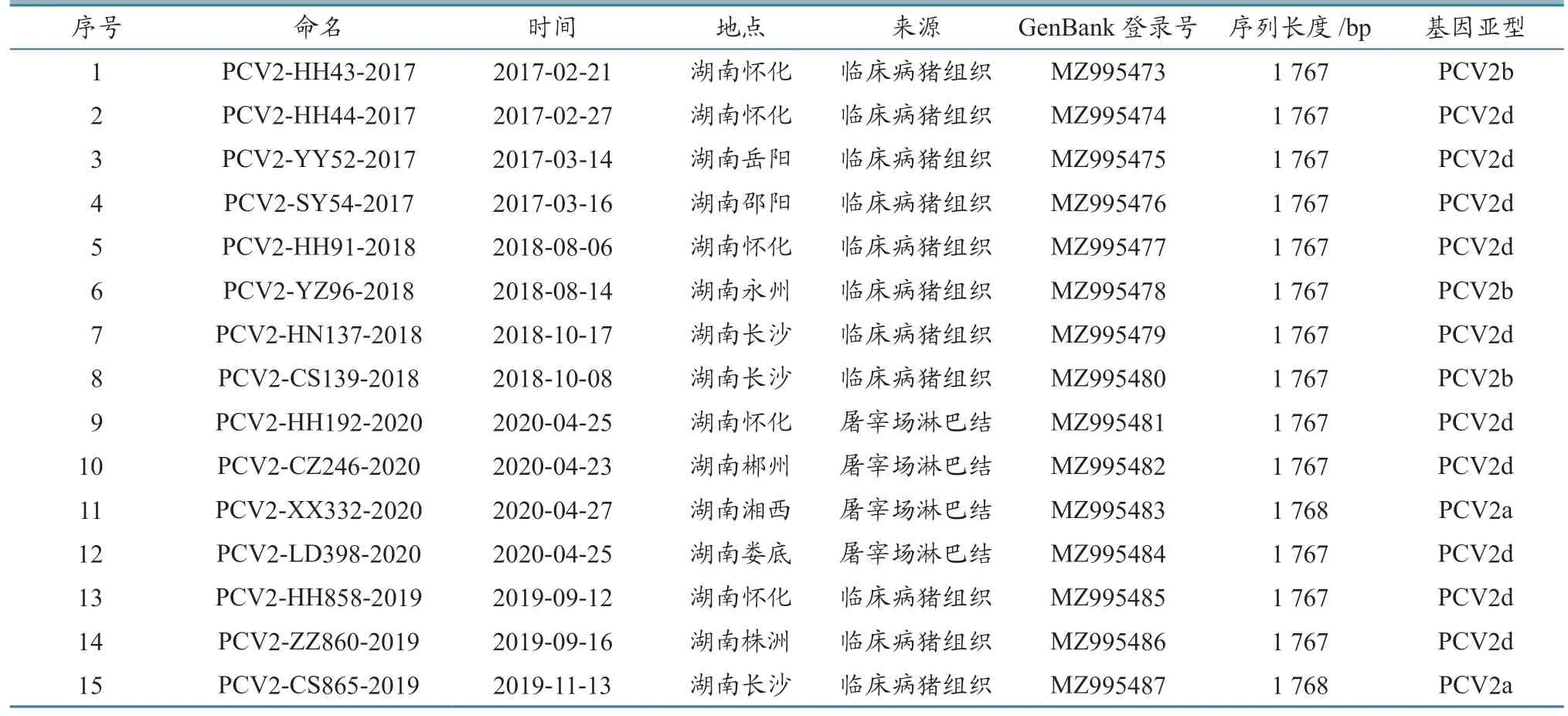
表3 PCV2 分离株的来源信息
2.2 遗传进化分析
对本试验中获得的15 株PCV2 全基因组与国内外上传至GenBank 中的22 株PCV2 全基因组序列及ORF2 序列使用MEGA-X64 生物软件绘制系统遗传进化树。
PCV2 全基因组遗传进化树(图2)可看出,所有序列分为了4 个分支,而本研究获得的15 株PCV2 全基因组分布在其中的3 个分支。其中:PCV2d 分支中的全基因组分布较散;PCV2b 中的PCV2-SY54-2017 全基因组单独分列1 个分支,PCV2-CS139-2018 与外国的Po/PCV2/KNA/K-TB60/2013(MN935183.1)遗传关系更近,另2株PCV2b 全基因组与国内分离株更接近;PCV2a中,本研究获得的2株PCV2a全基因组在同一分支,并与国外分离株分列2 个分支。
进一步构建ORF2 遗传进化树(图3)发现:PCV2 的ORF2 遗传进化树与PCV2 全基因组遗传进化树的分支基本相同,仅PCV2-SY54-2017 根据全基因组进化树分析位于PCV2b 分支,而根据ORF2 进化树分析位于PCV2d 分支中。最终以ORF2 进化树分析结果为标准,将其此归类为PCV2d分支,说明该毒株正在发生进化。根据ORF2 进化树进行分型,本研究获得的15 株全基因组可以分为10 株PCV2d、3 株PCV2b 和2 株PCV2a。
根据来源样品的采集时间,对本研究获得的15 株全基因组分析发现,2017 年分出3 株PCV2d亚型、1 株PCV2b 亚型,2018 年分出2 株PCV2d亚型、2 株PCV2b 亚型,2019 年分出2 株PCV2d亚型、1 株PCV2a 亚型,2020 年分出3 株PCV2d亚 型,1 株PCV2a亚型(表4),说 明2017—2020 年湖南省的PCV2 优势基因亚型是PCV2d,并可能继续保持下去。
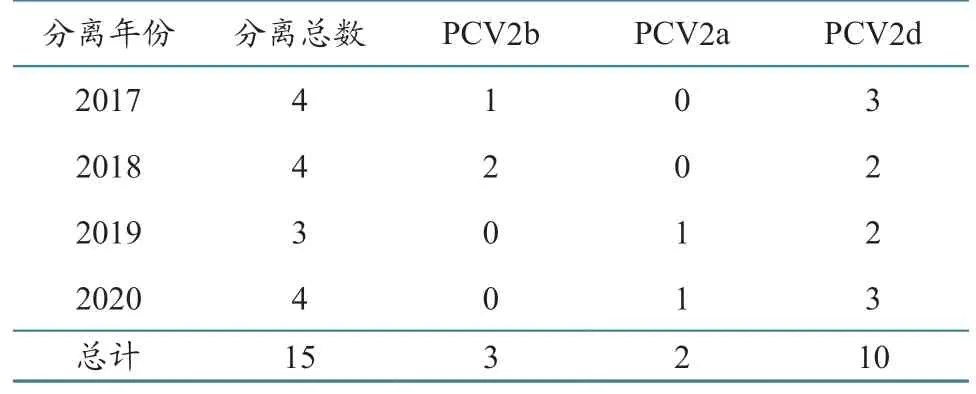
表4 根据年份统计的15 株PCV2 全基因组基因亚型结果 单位:株
2.3 全基因组同源性分析
对本试验获得的15 株PCV2 全基因组序列及国内外上传至GenBank 中的22 株PCV2 全基因组序列,运用DNAstar 软件中的MegAlign 软件进行同源性分析。
结果(图4)显示:本研究获得的15 株PCV2全基因组的核苷酸序列同源性为94.7%~99.9%,与国内外的PCV2 全基因组同源性为93.1%~100%。不同基因亚型之间的同源性相差较大,PCV2a 与PCV2c之间的遗传距离较远,同源性最低。本研究获得的2株PCV2a(PCV2-XX332-2020 和PCV2-CS865-2019)全基因组核苷酸大小均1 768 bp,与参考的国内外的PCV2a 分离株同源性为96.7%~99.9%。本研究获得3 株P C V 2 b 亚型基因组,大小均为1 767 bp,与参考的国内外PCV2b 亚型分离株同源性为98.4%~99.9%,其中PCV2-CS139-2018 与Po/PCV2/KNA/K-TB60/2013(MN935183.1)分离株同源性最高,为99.9%。本研究获得的10 株PCV2d亚型基因组,大小均为1 767 bp,与参考的国内外PCV2d 亚型毒株同源性为96.9%~100%,其中PCV2-LD398-2020 与2011 年河南登封分离的DF-1(JN119255.1)分离株同源性最高,为100%。
2.4 ORF2 氨基酸序列比对
本研究获得的15 株PCV2 全基因组中,ORF2编码的Cap 蛋白由233 或234 个氨基酸组成。PCV2 ORF2 氨基酸序列比对结果见图5。
从图5 可以看出,PCV2 的4 个亚型PCV2a、PCV2b、PCV2c 和PCV2d 都在部分位点具有保守的氨基酸。PCV2a 的第77、86~91、151、206 和222 位点的氨基酸与PCV2 其他亚型存在差异,第123、191 和206 位点仅在PCV2a 中存在部分全基因组的位点突变。PCV2b 在第57、89 及210 位点与其他亚型存在差异,在第59 位点存在K 和R 的差异。PCV2d 在第53、68、121、134 和215 位点上与其他亚型具有差异性,而在第169 位点存在不同方向的氨基酸突变,在最末端的234 位多1 个K。
本研究获得的2 株PCV2a 亚型ORF2 氨基酸与参考的PCV2a 分离株相比较为稳定,在第8、47、63、130 和133 位点与参考 株KX960947 具有相同的突变。本研究获得的3 株PCV2b 亚型的ORF2 氨基酸与其他参考分离株氨基酸序列无明显差异。本研究获得的10 株PCV2d 亚型中,除在第169 位点存在不同的氨基酸突变外,仅PCV2-HH192-2020 在第117 位点存在M →L 的突变;较为特别的是PCV2-SY54-2017,其在ORF2 遗传进化树分型中属于PCV2d,但在第63、68、90、190、210 和215 位点存在PCV2b 保守的氨基酸,在第121 和134 位点具有PCV2d 保守的氨基酸。
3 讨论
PCV2 可造成严重的临床症状,且阳性率较高,给生猪养殖业带来较大经济损失。PCV2 基因亚型较多[4],对其进行分子学研究可以为PCV2 疫苗开发及诊断技术建立提供依据。闫春春[10]扩增湖北省的部分PCV2 阳性样品,获得10 株PCV2分离株,其中有6 株PCV2d、4 株为PCV2b。夏德利[11]从2015—2018 年国内6 个省份的病料中,扩增了66 株PCV2 分离株,其中有40 株PCV2d、17 株PCV2b 和9 株PCV2a。李金凤[12]扩增2017—2019 年广西地区阳性样品,共扩增到18个PCV2 全基因组序列和26 个ORF2 序列,其中包 括25 株PCV2d、15 株PCV2b 和4 株PCV2a。而本试验获得的15 株PCV2 分离株中,10 株属于PCV2d 亚型,3 株属于PCV2b 亚型,另2 株属于PCV2a 亚型,并显示出地理差异。本研究表明,PCV2d 已成为目前湖南省的主要流行基因型,其次为PCV2b,与我国其他省份研究结论相同。
PCV2 中的衣壳蛋白(Cap)与病毒抗原性和致病性相关,不同基因型编码的氨基酸差异性较大[13-14],因此不同亚型的PCV2 的同源性也具有较大差异。本研究中也显示出不同亚型的PCV2 核苷酸之间的同源性差异较大。
调查[8]发现,目前市场上PCV2 商品化疫苗主要是基因亚型为PCV2a/b 的全病毒灭活疫苗。该疫苗对PCV2a 感染具有一定的交叉保护作用[15]。目前的研究[16-17]表明,存在对PCV2d 具有一定的交叉保护作用的疫苗。此外也有研究[18]证明,单独使用PCV2b 或PCV2d 的VLPs 时,针对PCV2b 和PCV2d 的交叉保护效果不明显,而在单独免疫时效果较好,但疫苗是否真正对PCV2d 存在交叉保护还需要更多研究去证实。目前PCV2d亚型已成为流行株,对其流行的控制就需要更加重视。
PCV2 的Cap 蛋白存在6 个抗原表位,分别位于第69~83、113~127、156~162、169~183、193~207 和231~233 位[19]。根据氨基酸序列比对可看出,PCV2 的4 个亚型PCV2a、PCV2b、PCV2c和PCV2d 都在部分位点具有保守的氨基酸,不同亚型之间差异较大。其中PCV2d 在C 端的234 位点多1 个K,这可能会导致PCV2 衣壳表面构象表位的改变,造成免疫失败[20]。本研究获得的毒株全基因组在所处亚型之间的差异不大,基因较为稳定,存在的部分位点突变在其他参考株中也有出现。
综上所述,PCV2d 已成为湖南省目前主要的流行基因亚型;PCV2 的4 个亚型PCV2a、PCV2b、PCV2c 和PCV2d 之间的差异较大,突变较为复杂;不同亚型之间的氨基酸序列差异较大,但在各亚型中,毒株间的ORF2 氨基酸序列无明显突变。

