基于基因组结构变异构建萝卜种质资源分子身份证
严承欢 崔 磊 任志勇 黄 燕,2 矫振彪 朱凤娟 张振兴 甘彩霞 邓晓辉 邱正明*
(1 湖北省农业科学院经济作物研究所,蔬菜种质创新与遗传改良湖北省重点实验室,湖北武汉 430064;2 华中农业大学园艺林学学院,湖北武汉 430070)
萝卜(L.)又名莱菔,属于十字花科萝卜属植物,富含维生素、膳食纤维、植物蛋白质、硫代葡萄糖苷等多种营养物质。萝卜的栽培历史超过4 500 年,最早由古埃及人将其驯化并栽 培(Becker,1962;Zhang &Wang,2017)。在我国,萝卜常年种植面积约120 万hm,总产量约4 000 万t(包崇来 等,2019)。肉质根是萝卜的主要食用器官,根据其皮色可分为白皮、绿皮、红皮以及黑皮等类型,其中白皮萝卜是目前最主要的栽培类型(崔志超 等,2020)。
随着生物技术的发展,已形成多种类型分子标记,如限制性内切酶片段长度多态性(restriction fragment length polymorphism,RFLP)、随机扩增多 态 性DNA 标 记(random amplified polymorphic DNA,RAPD)、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)、简单重复序列(simple sequence repeats,SSR)、插入/缺失标记(insertion/deletion,InDel)和单核苷酸多态性(single nucleotide polymorphisms,SNP)等(Toal et al.,2016)。其中,RFLP、RAPD、AFLP 和SSR分子标记在基因组中数目较少;SNP 分子标记数量最多,但开发成本和检测成本高昂。InDel 分子标记具有标记数目多、准确性高以及共显性等特点,但因其插入/缺失序列小于50 bp,需要采用聚丙烯酰胺凝胶进行检测(Shu et al.,2018)。若将插入/缺失变异提升至50 bp 以上序列,采用普通琼脂糖凝胶电泳即可完成检测,可显著提升该类型标记的检测效率。一般而言,50 bp 以上的插入/缺失变异属于基因组结构变异(structural variants,SVs)范畴(Alkan et al.,2011)。目前,基因组结构变异已广泛应用于人类的基因分型相关工作,但在植物中研究相对较少。在植物中,研究人员已利用SSR、InDel 等分子标记构建了甜高粱(王黎明等,2011)、甘蓝型油菜(马琳 等,2013)、水稻(陆徐忠 等,2014)、大白菜(刘栓桃 等,2019)和青花菜(管俊娇 等,2021)等多个物种的分子身份证。然而,采用较大片段(50~500 bp)的插入/缺失变异开发易于检测(如使用琼脂糖凝胶即可检测)的分子标记,并以此构建分子身份证的研究尚未见报道。
本试验采用最近报道的520 份萝卜简化基因组测序数据以及蔬菜种质创新与遗传改良湖北省重点实验室完成的4 份萝卜全基因组重测序数据进行联合分析,开发具有广泛通用性的萝卜分子标记。这些标记通过琼脂糖凝胶电泳即可完成基因型检测。采用以上分子标记对已收集的255 份萝卜种质资源进行基因分型,构建其相应的分子身份证,明确不同种质间的亲缘关系。本试验所得标记可用于育种材料的背景选择、杂种鉴定等基础性工作,为萝卜种质鉴定及分子育种工作提供技术支撑。
1 材料与方法
1.1 试验材料
供试材料为湖北省农业科学院经济作物研究所萝卜团队收集的255 份萝卜核心种质,主要包括优良地方品种自交系和育种材料等。2020 年9 月13日将上述材料播种于湖北省农业科学院蔬菜基地。每份材料6~10 株,株距25 cm,行距32 cm,常规种植管理。
1.2 DNA 提取
采用CTAB 法(Webb &Knapp,1990)提取植物基因组DNA,略加修改。每份萝卜种质选取6 株1 月龄幼苗,取等量叶片混合,放入2 mL 离心管;加入800 μL CTAB(1.5%,/)提取液,使用磨样机(TissueLyser-64,上海净信实业发展有限公司)磨样90 s,然后65 ℃水浴30 min,期间颠倒振荡3 次;加入600 μL 24∶1(/)的氯仿∶异戊醇,上下颠倒混匀5 min,室温10 000 r·min离心10 min;吸取500 μL 上清液,放入新的1.5 mL 离心管中,加入等体积异丙醇,上下颠倒混匀50 次,室温12 000 r·min离心15 min,弃上清液;加入1 mL 75%酒精清洗2 次,弃酒精,吸取多余液体,室温吹干;加入200 μL ddHO,室温溶解30 min,-20 ℃保存备用。
1.3 引物设计
为提高分子标记的通用性,采用蔬菜种质创新与遗传改良湖北省重点实验室完成的4 份萝卜全基因组重测序数据(ENA 登记号:ERP128830)和已公布的520 份萝卜简化基因组测序数据(Kitashiba et al.,2020)进行分子标记开发。全基因组重测序在北京贝瑞和康生物技术有限公司Illumina Novaseq 6000 测序平台完成,每份样品获得约6 GB 数据量。采用已公布的萝卜基因组QZ-16(ENA 登记号:PRJEB37015)为参考基因组,使用Bowtie 2(Langmead &Salzberg,2012)进行数据比对,利用GATK 4.0 进行插入/缺失位点鉴定,引物设计标准:①在520 份萝卜简化基因组测序数据以及4份萝卜全基因组重测序数据中选择含有0/0 和1/1两种不同的基因型类别,且4 份重测序材料基因型不同;② 插入/缺失位点序列差异大于50 bp;③变异位点在所有材料中的丢失率小于0.9,等位基因频率大于0.05,每1 Mb 选择1 个位点;④ 引物设计选择数据质量(quality)400 以上的插入/缺失位点;⑤ 设计引物尽可能均匀分布于每条萝卜染色体上。基于以上标准,采用Primer3Plus(https://primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计引物,一共设计了92 对分子标记,随机选取24 份萝卜种质用于分子标记筛选。
1.4 PCR 扩增及琼脂糖凝胶电泳检测
PCR 扩 增 采 用11 μL 反 应 体 系:2× EsMasterMix(北京康为世纪生物科技有限公司)5 μL,10 nmol·L正、反向引物各1 μL,基因组DNA 1 μL,ddHO 3 μL。PCR 扩增程序为:95 ℃预变性3 min;95 ℃变性20 s,50~63 ℃退火20 s,72 ℃延伸30 s,循环38 次;72 ℃延伸5 min。PCR 产物采用2%琼脂糖凝胶电泳检测,实时凝胶成像系统Gel Doc XR+(Bio-Rad 公司,美国)进行拍照。
1.5 数据赋值及分子身份证编码
对电泳条带进行赋值,规则如下:①若扩增产物为单一条带,将迁移率较大的条带赋值为0,迁移率较小的条带赋值为1;② 同时出现迁移率较大和较小的杂合条带时,重新选取6 个该样本单株材料,分别提取DNA,重新进行基因型鉴定,当50%以上植株均为杂合时确定其为杂合型,赋值为2;③若出现缺失条带类型时,重新提取该样本DNA,重新进行基因型鉴定,若结果仍为缺失带型,赋值为X。
按照萝卜染色体Rs1~Rs9 顺序对引物进行排序。同一条染色体上的引物,按照物理位置大小进行排序。依据上述赋值规则,采用24 对引物(表1)对255 份萝卜种质进行PCR 扩增并赋值,形成原始赋值数据。最后将24 位赋值结果数据进行合并,完成萝卜种质的分子身份证构建。

表1 构建萝卜分子身份证的引物信息
1.6 亲缘关系分析
使用NTSYS-pc(v2.1)软件对萝卜种质进行聚类分析。将基于PCR 赋值结果建立的0,1 矩阵导入到软件中,采用UPGMA 法进行聚类,最终绘制聚类图。
2 结果与分析
2.1 筛选目标分子标记
随机选取24 份萝卜种质,对初步设计的92 个分子标记进行筛选。琼脂糖凝胶电泳结果显示,92个分子标记中有25 个标记含有3 种或3 种以上条带,43 个标记无多态性或存在较多无PCR 产物情况,仅24 个标记含有2 种条带(图1)。最终,筛选24 个标记为目标分子标记。

图1 9 个分子标记在部分萝卜种质中的PCR 扩增结果
2.2 构建萝卜种质分子身份证
参照赋值标准,对255 份萝卜种质进行分子身份证构建。按照萝卜基因组QZ-16 上染色体顺序Rs1~Rs9 及其分子标记所在物理位置进行排序,获得由24 位数字编码组成的萝卜分子身份证(表2)。
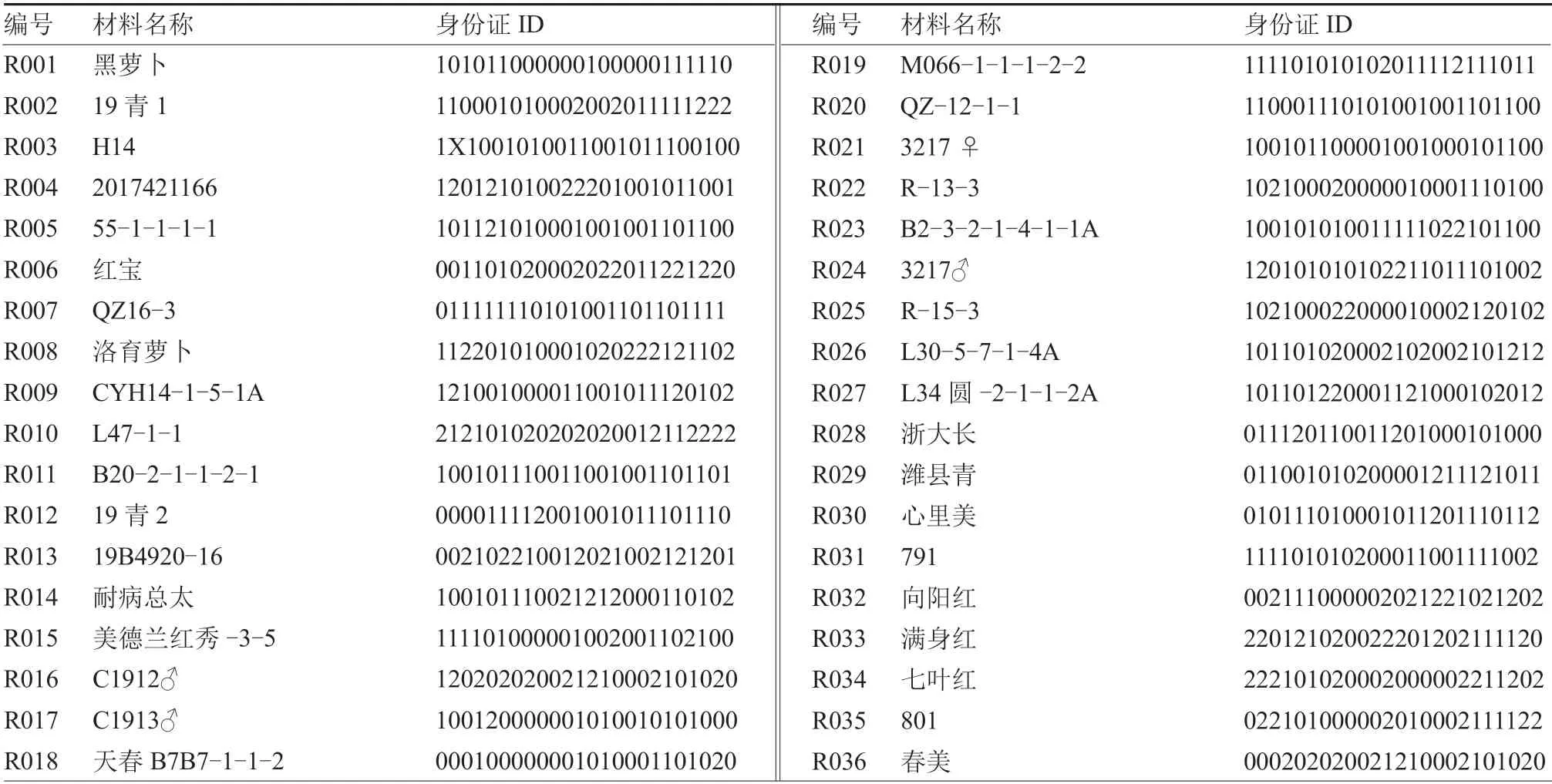
表2 255 份萝卜种质的分子身份证

续表
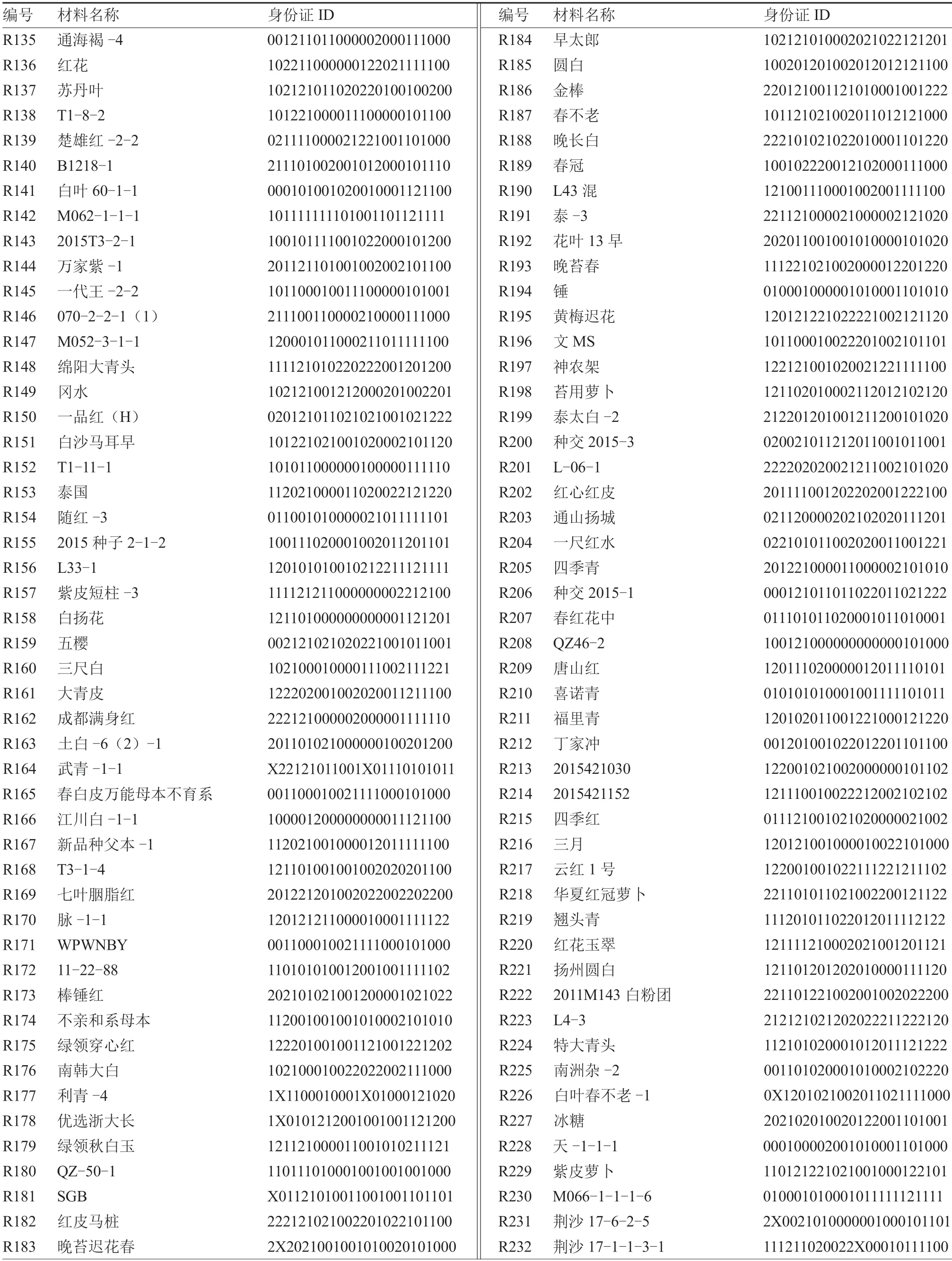
续表
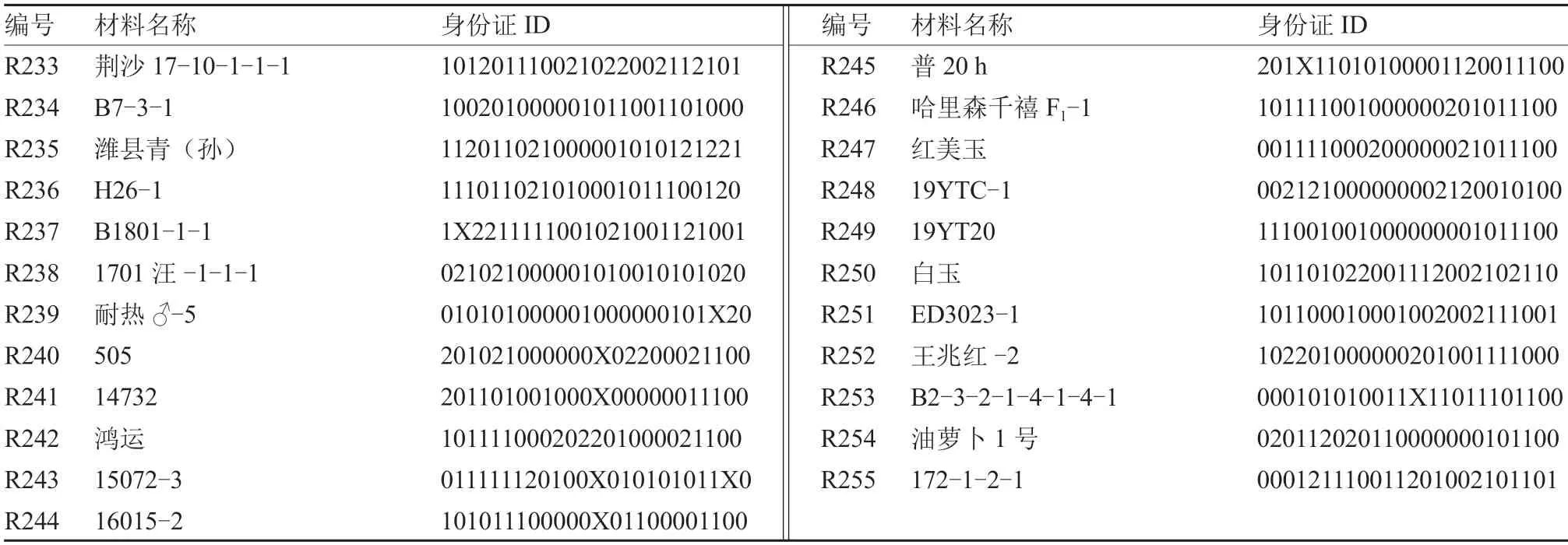
续表
参试255 份萝卜种质中,仅16 份材料的24 个标记均为纯合型(带型仅为0 和1);39 份材料在24 个SV 标记中有1 个位点为杂合型(带型为2),其余位点均为纯合型带型。此外,R033~R055 为商品种,采用24 个分子标记对其进行基因分型,发现商品种材料的杂合位点数目为4~11 个,其中R045(京红6 号)、R048(沙窝)和R051(短叶13)含有4 个杂合位点,是杂合等位基因较少的萝卜商品种,推测可能是由于父母本亲缘关系较近或者为多代自交所致。
1.3 萝卜种质聚类分析
使用NTSYS-pc(v2.1)软件对255 份萝卜种质进行聚类分析。结果表明(图2),在相关系数0.55 处可将参试萝卜种质分为4 个类群。其中,多个材料间具有较高的相似性,如R001 和R152、R107 和R125、R066 和R106 等。

图2 基于SV 标记的255 份萝卜种质聚类分析结果
3 结论与讨论
本试验利用520 份萝卜简化基因组测序数据和4 份萝卜全基因组重测序数据,开发了24 个具有通用性的分子标记,并以此构建了参试255 份萝卜种质的分子身份证。同时,利用以上分子标记的基因分型数据,完成了255 份萝卜种质的亲缘关系鉴定,在相关系数0.55 处将参试萝卜种质分为4 个类群,其中多个材料间具有较高的相似性,如R001 和R152、R107 和R125、R066 和R106 等。田间调查发现这些材料表型接近,推测以上高相似性种质可能为不同收集来源的同种材料。该结果将为后续萝卜核心种质的筛选及创制提供技术支撑。
随着分子生物学的快速发展,蔬菜作物已完成多个分子身份证的构建,如黄瓜(李斯更 等,2013)、菜薹(菜心)(郭培国 等,2014)、芥菜(王玉红,2016)、大白菜(刘栓桃 等,2019)等。萝卜的分子身份证研究起步较早,2014 年邱杨等利用SSR 标记对75 份萝卜种质进行基因分型,首次完成了萝卜分子身份证的构建(邱杨 等,2014)。以上研究中,多为基于SSR 标记技术的分子身份证构建,仅少数采用InDel 标记技术,如黄瓜、大白菜(李斯更 等,2013;刘栓桃 等,2019)。然而,在黄瓜和大白菜的分子身份证构建中插入/缺失序列的变异幅度较小(≈ 5 bp),须采用聚丙烯酰胺凝胶电泳进行检测。本试验利用生物信息学技术选择大于50 bp 的结构变异,开发并获得了24 个通用性的分子标记,均采用普通琼脂糖凝胶电泳即可完成基因分析和相关检测。可见,采用以上分子标记对不同萝卜种质进行基因分型以及背景选择,将极大地降低萝卜材料的分子检测成本,同时显著提升萝卜分子育种的效率。此外,SSR 分子标记具有高多态性特点,在1 个位点的多态性大于2 个,这对PCR 产物的赋值及标准化提出了挑战。基于物种水平的大数据分析,可在一个物种水平上鉴定通用性的分子标记,筛选多态性为2 个的分子标记,可以实现数据的标准化赋值,有利于构建统一的分子身份证数据库。
综上所述,基于基因组水平大片段序列插入/缺失变异,本试验开发了仅需琼脂糖凝胶电泳检测的24 个通用性分子标记,构建了255 份萝卜种质的分子身份证,并完成了其亲缘关系鉴定。本试验的开展,一方面将有利于提升萝卜分子标记的检测效率及其标准化赋值水平,另一方面将为萝卜新种质的鉴定与背景选择提供宝贵信息资源。

