乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA联合检测及其临床意义
于秀艳, 李 铤, 丛占杰, 王文龙, 张晓伟, 吴雪峰
(吉林省肿瘤医院检验科,吉林 长春 130012)
乳腺癌血行转移和复发与外周血中循环的肿瘤细胞有密切关联,监测外周血中的肿瘤细胞对早期发现乳腺癌微转移具有重要意义[1]。肿瘤在发生发展过程中需要以形成新生血管的形式来持续吸氧和吸收营养,由于新生血管管壁通透性大,也为癌细胞进入外周血提供了途径[2]。近年来,随着乳腺癌相关分子生物学研究的不断扩大,分子靶向治疗是目前最活跃的研究领域之一[3]。分子靶向在乳腺癌诊断、分期和综合治疗中发挥着重要作用。人乳腺珠蛋白(human mammaglobin,hMAM) 是1996 年WASTON 等[4]在乳腺癌组织中发现的一种具有高特异性的分泌性球蛋白。研究[5-6]表明:hMAM对于乳腺癌外周血微转移诊断具有重要临床意义。在乳腺癌组织中可以检测到乳腺上皮小黏蛋白(small breast epithelial mucin,SBEM),其与乳腺癌患者预后有关[7]。SBEM mRNA 也可以作为乳腺癌患者骨髓微转移的标志物[8]。SBEM 也是一个潜在的预测血行微转移和乳腺癌新辅助化疗反应的特异性标志物[9],国内外研究关于SBEM mRNA 在乳腺癌患者外周血中的检测报道甚少。癌胚抗原相关细胞黏附分子19 (carcinoembryonic antigen-related cell adhesion molecule 19,CEACAM19)是癌胚抗原(carcinoembryonic antigen,CEA) 家族的新成员,也称为CEA 样基因1 (carcinoembryonic antigen-like gene 1,CEAL1),在肿瘤患者中表达敏感性高[10]。研究[11]表明: CEACAM19 与乳腺癌预后有关联。有研究[12]表明:CEACAM19 mRNA 表达水平与乳腺癌患者雌激素受体(estrogen receptor,ER)表达水平有关。
单一的标志物诊断乳腺癌外周血微转移具有局限性,在国内外研究中,乳腺癌患者外周血中hMAM、 SBEM 和CEACAM19 mRNA 检测均有报道[13-14],但外周血中上述3 个指标的联合检测尚未见报道。本研究主要通过实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法联合检测乳腺癌患者外周血中hMAM、 SBEM和CEACAM19 mRNA 的阳性表达率,探讨其诊断乳腺癌外周血微转移的临床意义。
1 资料与方法
1.1 临床资料选择2020 年1 月—2021 年3 月在吉林省肿瘤医院乳腺治疗中心行手术治疗、术后经病理确诊且资料完整的乳腺肿瘤患者为研究对象。乳腺癌组患者104 例,均为女性,年龄30~80 岁,中位年龄52.5 岁;根据2013 年StGallen 乳腺癌国际会议专家共识进行乳腺癌分子分型,按照WHO 乳腺肿瘤组织学标准进行组织学分类:浸润性导管癌71 例,浸润性小叶癌20 例,黏液癌13 例;按照国际抗癌联 盟 (Union for International Cancer Control,UICC) 2003 年制订的乳腺癌TNM 分期标准进行分期:Ⅰ期13 例,Ⅱ期36 例,Ⅲ期39 例,Ⅳ期16 例。同期术后病理确诊的良性乳腺病组患者52 例,其中乳腺纤维腺瘤31 例,乳腺导管内乳头状瘤21 例,均为女性,年龄20~76 岁,中位年龄45.0 岁。健康对照组50 名,均为健康体检者,均为女性,年龄22~80 岁,中位年龄48.5 岁。乳腺癌组、良性乳腺病组和健康对照组研究对象年龄比较差异均无统计学意义(P>0.05)。
1.2 纳入标准和排除标准
1.2.1 纳入标准 乳腺癌组和良性乳腺病组患者均为女性,为乳腺癌或乳腺良性病首诊,有明确的病理学诊断依据,乳腺癌组患者TNM 分期明确为早期,均签署知情同意书,术前未接受过放疗、化疗、内分泌治疗和生物治疗等干预措施;健康对照组志愿者均为女性,来源于本院体检中心的健康体检者,均签署知情同意书,彩色超声和CT 等影像检查结果正常,血常规、尿常规、便常规、生化常规和肿瘤标志物检测结果均正常。
1.2.2 排除标准 乳腺癌组和良性乳腺病组患者有既往肿瘤病史,并发其他部位原发性肿瘤的患者,存在严重感染性疾病、糖尿病、心脏疾病、肝肾疾病和自身免疫性疾病,高血压病(收缩压≥140 mmHg 或舒张压≥90 mmHg),认知障碍和其他精神障碍,病历资料不完整,标本溶血、乳糜血和黄疸;健康对照组志愿者既往有肿瘤病史,既往有自身免疫性疾病,标本溶血、乳糜血和黄疸。
1.3 实验试剂、仪器和检测方法
1.3.1 主要试剂和仪器 人外周血淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司,血液RNA 提取试剂盒和FastKing 一步法反转录-荧光试剂盒(SYBR Green) 均购自天根生化科技(北京) 有限公司,hMAM、SBEM、CEACAM19 和β-actin 引物(表1) 由宝生物工程(大连) 有限公司设计及合成。ABI7500 型RT-qPCR 仪购自美国应用生物系统公司。

表1 PCR 引物序列Tab.1 Primer sequences for PCR
1.3.2 标本采集 所有入组研究对象于清晨空腹采集EDTA 抗凝静脉血5 mL,抗凝血用淋巴细胞分离液分离单个核细胞,提取总RNA 用DEPC 处理的无菌EP 管于-80 ℃条件下保存待检测。
1.3.3 RT-qPCR 法检测各组受试者外周血中hMAM、 SBEM 和CEACAM 19 mRNA 阳性表达率 按照RNA 提取试剂盒说明书提取单个核细胞RNA,NanoDrop 2000C 测定RNA 含量。总反应体系为50 μL:2×FastKing RT-qPCR Buffer(SYBR Green) 25 μL,25×RT-PCR Enzyme Mix 2 μL,上下游引物(10 μmol·L-1) 各1.25 μL,总RNA 1 μg,50×ROX Reference Dye 1 μL,最后加入RNase-Free ddH2O 至50 μL。混合后进行扩增,反应条件: 50 ℃、 30 min,95 ℃、 3 min,95 ℃、15 s、60 ℃、30 s,40 个循环。采用2-ΔΔCt法计算目的基因相对表达水平[15],测定值2-ΔΔCt>2 为表达阳性,hMAM 联合SBEM 和CEACAM19 检测中任意一个指标阳性即为阳性表达,计算各组受试者外周血中hMAM、 SBEM 和CEACAM19 阳性表达率。
1.4 统计学分析
采用SPSS 17.0 统计软件进行统计学分析。乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA 表达水平以±s表示。各组受试者hMAM、SBEM 和CEACAM19 mRNA 阳性表达率以百分率表示,组间比较采用χ2检验或确切概率法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA 表达水平
hMAM、 SBEM 和CEACAM19 mRNA 在乳腺癌患者外周血中均有表达(图1),其表达水平分别 为 3.79±7.16、 23.40±62.63 和 10.76±25.76。

图1 RT-qPCR 法检测乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA 表达水平的扩增曲线Fig.1 Amplification curves of expression levels of hMAM,SBEM and CEACAM19 mRNA in peripheral blood of patients with breast cancer detected by RT-qPCR method
2.2 不同临床病理特征乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA 阳性表达率
TNM 分期Ⅲ+ Ⅳ期乳腺癌组患者外周血中hMAM、 SBEM 和CEACAM19 mRNA 阳性表达率均高于TNM 分期Ⅰ+ Ⅱ期乳腺癌组(P<0.05);SBEM 和CEACAM19 mRNA 阳性表达率与乳腺癌患者淋巴结转移有关联(P<0.05),hMAM mRNA 阳性表达率与乳腺癌患者淋巴结转移无关联(P>0.05);3 项检测指标与患者年龄、肿瘤大小、病理类型和孕激素受体(progesterone receptor,PR) 表达均无关联(P>0.05);hMAM和SBEM mRNA 阳性表达率与ER 表达无关联(P>0.05),而CEACAM19 mRNA 阳性表达率与ER 表达有关联(P<0.05) ; SBEM 和CEACAM19 mRNA 阳性表达率与HER-2 表达无关联(P>0.05),而hMAM mRNA 阳性表达率与HER-2 表达有关联(P<0.05)。见表2。
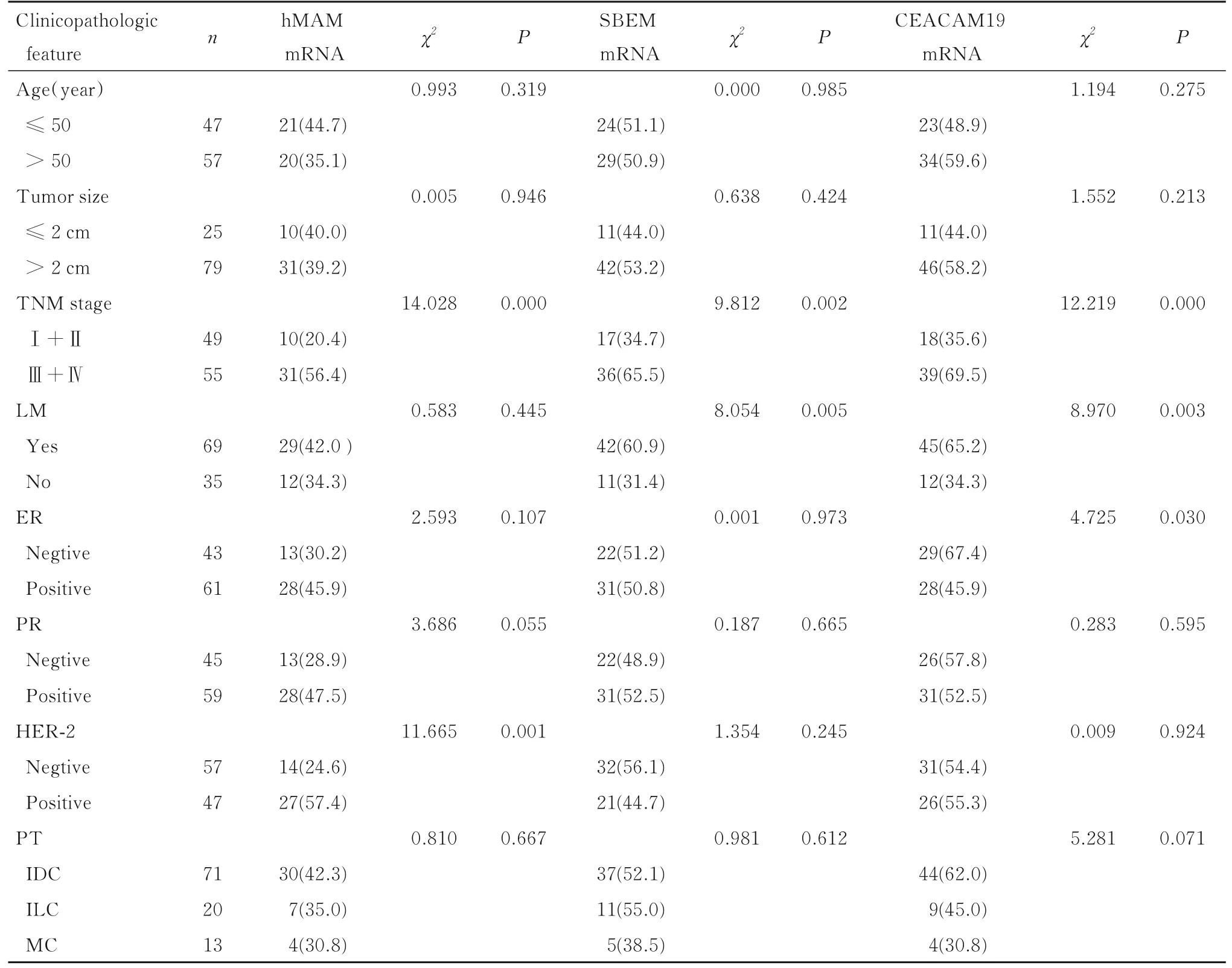
表2 不同临床病理特征乳腺癌患者外周血中hMAM、SBEM 和CEACAM19 mRNA 阳性表达情况Tab.2 Positive expressions of hMAM, SBEM and CEACAM19 mRNA in peripheral blood of breast cancer patients with different clinicopathologic features [n(η/%)]
2.3 3 组受试者外周血中hMAM 联合SBEM 和CEACAM19 mRNA 检测阳性表达情况
健康对照组中无hMAM mRNA 阳性表达者,良性乳腺病组hMAM mRNA 阳性表达患者3 例,阳性表达率为7.9%,健康对照组与良性乳腺病组受试者外周血中hMAM mRNA 单独及联合SBEM和(或) CEACAM19 mRNA 检测阳性表达率比较差异均无统计学意义(P>0.05)。与健康对照组和良性乳腺病组比较,乳腺癌组患者外周血中hMAM mRNA 单独或联合SBEM 和(或)CEACAM19 mRNA 检测阳性表达率均明显升高(P<0.05)。三者联合检测hMAM mRNA 阳性表达率从39.4% 增加到66.3%。见表3。

表3 3 组受试者外周血中hMAM 联合SBEM 和CEACAM19 mRNA 检测阳性表达情况Tab.3 Positive expressions in detection of hMAM combined with SBEM and CEACAM19 mRNA in peripheral blood of subjects in three groups [n(η/%)]
2.4 不同TNM 分期乳腺癌患者hMAM 联合SBEM 和CEACAM19 mRNA 检测阳性表达率
与TNM 分期Ⅰ+Ⅱ期乳腺癌组比较,TNM分期Ⅲ+ Ⅳ期乳腺癌组患者hMAM 单独或联合SBEM 和(或) CEACAM19 mRNA 检测阳性表达率均明显升高(P<0.01); 三者联合检测,TNM分期Ⅰ+ Ⅱ期乳腺癌组患者外周血中hMAM mRNA 阳性表达率从20.40% 升高至48.98%,TNM 分期Ⅲ+Ⅳ期乳腺癌组患者外周血中hMAM mRNA 阳性表达率从56.40% 升高至81.82%。见表4。
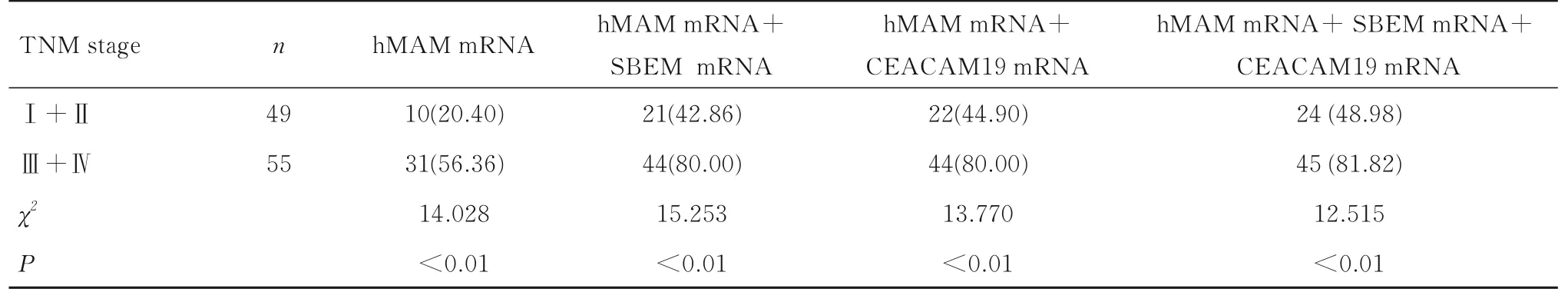
表4 不同TNM 分期乳腺癌患者外周血中hMAM 联合SBEM 和CEACAM19 mRNA 检测阳性表达情况Tab.4 Positive expressions in detection of hMAM combined with SBEM and CEACAM19 mRNA in peripheral blood of breast cancer patients at different TNM stages [n(η/%)]
3 讨 论
hMAM 在血液和骨髓中不表达,在正常乳腺上皮组织中表达较低,而在乳腺癌组织中高表达,其他肿瘤均不表达,具有乳腺组织表达特异性。乳腺癌常见转移部位有淋巴结、外周血和骨髓,常规方法很难检测到微小转移病灶,因乳腺癌组织高特异性,hMAM mRNA 检测已被国内外广泛用于诊断乳腺癌外周血微转移的研究[16-19]。一项纳入20 多个研究包含2 300 例乳腺癌患者的Meta 分析[20]显示:外周血中hMAM 表达是乳腺癌患者不良预后的一个预测指标。MIKSICEK 等[21]首次利用表达序列标签技术和基因表达分析数据库分离得到SBEM mRNA,SBEM 是一种可编码的低相对分子质量唾液酸糖蛋白,其仅在乳腺和唾液腺组织中表达,在其他组织中不表达,具有乳腺组织特异性,可用于乳腺癌微转移的检测。尤小兰等[22]对92 例乳腺癌患者外周血中hMAM mRNA 进行检测并进行临床随访,结果显示: 外周血中hMAM mRNA 检测有助于判断乳腺癌预后。CEACAM19是CEA 家族的成员,属于免疫球蛋白家族黏附分子,不具有乳腺癌组织特异性。研究[23-24]显示:CEACAM19 在阴茎癌和胃癌组织中表达,且CEACAM19 与乳腺癌的进展有关[25]。ESTIAR 等[13]在研究CEACAM19 表达与激素受体状态之间的相关性时发现:CEACAM19 可能是某些乳腺癌患者亚组(如ER/PR 阴性) 的新治疗靶点。
本研究结果显示:晚期乳腺癌患者外周血中hMAM、 SBEM 和CEACAM19 mRNA 阳性表达率均较早期乳腺癌患者高,其可能原因是由于乳腺癌患者TNM 分期越晚,肿瘤细胞侵袭能力越强,肿瘤微血管形成越多,扩大了肿瘤细胞与微血管的接触面积,从而增加了肿瘤细胞进入外周血的机会,出现转移[26]。本研究结果显示:乳腺癌患者外周血中SBEM 和CEACAM19 mRNA 阳性表达率与乳腺癌患者淋巴结转移有关联,hMAM mRNA 阳性表达率与淋巴结转移无关联;hMAM、SBEM 和CEACAM19 mRNA 阳性表达率与患者年龄、 肿瘤大小、 病理类型和PR 表达均无关;hMAM 和SBEM mRNA 阳性表达率与ER 表达无关联,而CEACAM19 mRNA 阳性表达率与ER 表达有关联;SBEM 和CEACAM19 mRNA 阳性表达率与HER-2 表达无关联,而hMAM mRNA 阳性表达率与HER-2 有关联。本研究中不同临床病理特征乳腺癌患者外周血中hMAM 检测结果与本课题组前期研究结果一致[27]。ZHANG 等[7]研究发现:SBEM mRNA 表达与乳腺癌患者的年龄、肿瘤大小和组织分级无关,但与TNM 分期和淋巴结转移有关;陶健等[27]研究发现:乳腺癌患者外周血中SBEM mRNA 表达与患者有无淋巴结转移和TNM分期有关联,而与患者年龄、肿瘤大小和激素受体差异无关联;LIU 等[9]研究发现:SBEM mRNA表达水平与乳腺癌患者TNM 分期和淋巴结转移有关联,与肿瘤患者年龄、肿瘤大小和激素无相关性。上述3 项研究报道与本研究结果一致。ESTIAR 等[13]研究发现: CEACAM19 在肿瘤样本中的表达与肿瘤患者临床病理特征无关,而CEACAM19 在ER/PR 阳性和ER/PR 阴性乳腺癌患者中的表达差异有统计学意义,与PR 关系的研究结果与本研究不同; 于洪涛等[12]在研究CEACAM19 与乳腺癌相关激素基因关系时发现:乳腺癌淋巴结转移癌组织中CEACAM19 mRNA表达水平明显高于原发癌组织,ER 阳性组乳腺癌患者癌组织中CEACAM19 mRNA 表达水平明显高于ER 阴性组,CEACAM19 mRNA 表达水平与PR 和Her-2 表达无相关性,结果与本研究结果一致。MICHAELIDOU 等[11]研究发现: 乳腺癌患者中CEACAM19 mRNA 表达与ER 有关联,与PR、 Her-2 及肿瘤TNM 分期无关联。CEACAM19 mRNA 表达结果存在差异可能是因样本量和纳入标准存在差异而产生,CEACAM19 在国内外的研究报道相对较少,应在大样本大数据前提下进行统计分析进一步证实。
本研究结果显示:健康人外周血中未检测到hMAM mRNA 表达,良性乳腺病组患者外周血中hMAM mRNA 阳性表达率仅7.9%,体现了hMAM 高特异度[6];健康对照组与良性乳腺病组受试者外周血中hMAM mRNA 单独及联合SBEM和(或) CEACAM19 mRNA 检测阳性表达率比较差异均无统计学意义;与健康对照组和良性乳腺病组比较,乳腺癌组患者外周血中hMAM mRNA 单独或联合SBEM 和(或) CEACAM19 mRNA 检测阳性表达率均明显升高,与以往报道[28]相符,三者联合检测hMAM mRNA 阳性表达率从39.4% 升高至66.3%。近几年国内外研究中,hMAM 在乳腺癌患者外周血中的阳性表达率为30%~60%[29-32],本研究中hMAM 阳性率处于该范围内。本研究结果表明: 随着乳腺癌患者TNM 分期增加,hMAM mRNA 阳性表达率升高,与TNM 分期Ⅰ+Ⅱ期乳腺癌组比较,TNM 分期Ⅲ+Ⅳ期乳腺癌组患者hMAM mRNA 单独或联合SBEM 和(或) CEACAM19 mRNA 检测阳性表达率均明显升高;三者联合检测,TNM 分期Ⅰ+Ⅱ期乳腺癌组患者外周血中hMAM mRNA 阳性表达率从20.40% 升高至48.98%,TNM 分期Ⅲ+Ⅳ期乳腺癌组患者外周血中hMAM mRNA 阳性表达率从56.40% 升高至81.82%。本研究结果显示:hMAM 联合SBEM 和CEACAM19 mRNA 检测阳性率与hMAM 联合SBEM 或CEACAM19 mRNA检测阳性率相差不大,其主要原因是乳腺癌患者外周血中单个基因单独表达的少,基本上都是两两表达或者三者同时表达,但与hMAM mRNA 单独检测时比较阳性表达率明显升高。
综上所述,本研究采用RT-qPCR 法检测乳腺癌患者外周血中hMAM mRNA 阳性表达率较低,但由于其高特异度,联合SBEM mRNA 和(或)CEACAM19 mRNA 检测可以提高hMAM mRNA检测阳性表达率,在提高灵敏度的同时,又保证了其高特异度,有望成为乳腺癌早期筛查和诊断的有效方法,对于诊断乳腺癌外周血微转移也具有一定临床意义。

