MMP-9 和TIMP-1 表达在胃癌根治术后患者预后评估中的作用
覃丽粒, 马小波, 赵天业, 陶雪蓉, 郑 敏, 王雪莹, 易嘉欣, 吴燕华, 姜 晶
(1.吉林大学第一医院临床研究部,吉林 长春 130021;2.吉林大学第一医院病理科,吉林 长春 130021)
胃癌是最常见的消化道恶性肿瘤之一,其发生率和死亡率均较高,患者就诊时多处于晚期,预后不佳,已经成为严重的公共卫生问题。寻找有效的胃癌预后评估的分子标志物,对胃癌的精准治疗、延长患者生存时间和提高患者生存质量具有重要意义。肿瘤的侵袭和转移是导致患者预后不良和死亡的主要原因,而细胞外基质(extracellular matrix,ECM) 降解是肿瘤侵袭和转移的关键步骤,该过程依赖于基质金属蛋白酶 (matrix metalloproteinases,MMPs) 和组织金属蛋白酶抑制 剂 (tissue inhibitor of metalloproteinases,TIMPs) 的调控[1]。其中,MMP-9 和TIMP-1 被认为是MMPs 和TIMPs 家族中最关键的蛋白酶,二者的蛋白表达变化和平衡在肿瘤的进展和预后评估中发挥重要作用,但其作用方式和作用结果尚无统一结论。MMP-9 是ECM 降解的关键蛋白酶,近年来研究[2-7]显示:MMP-9 具有非蛋白酶依赖活性,能介导宿主免疫防御反应,并激活细胞因子,调控关键的细胞信号转导通路,抑制肿瘤的发生发展,且MMP-9 在不同临床分期肿瘤中的调控作用具有异质性。TIMP-1 作为MMP-9 特异性的内源性抑制剂,不但能抑制MMP-9 的基质降解活性,还能激活细胞因子如转化生长因子α (transforming growth factor- α,TGF- α)、转化生长因子β(transforming growth factor-β,TGF-β)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、 细胞黏附分子(cell adhesion molecule,CAM) 和结合细胞表面蛋白CD63,激活黏着斑激酶-磷脂酰肌醇3 激酶/蛋白激酶B (focal adhesion kinase-phosphatidylinositol 3 kinase/protein kinase B,FAK-PI3K/AKT) 信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号通路,导致肿瘤细胞增殖失控和播散生长[8]。已有研究[9-11]证实:MMP-9 和TIMP-1 蛋白表达平衡随肿瘤进展而变化,两者的联合表达较单独的MMPs 或TIMPs 的变化意义更大,但其与胃癌的相关研究较少,尚缺乏人群验证。本研究拟利用胃癌患者生存队列,采用免疫组织化学方法检测胃癌患者癌组织中MMP-9 和TIMP-1 蛋白表达情况,探讨MMP-9 和TIMP-1 联合表达在胃癌患者生存中的预测价值。
1 资料与方法
1.1 研究对象本研究中选择2008—2018 年于吉林大学第一医院胃结直肠外科进行胃癌根治术且病理诊断确诊为胃癌的患者。纳入标准:①首发肿瘤为胃癌,并接受胃癌切除术;②手术切缘阴性且无远处转移;③签署知情同意书。排除标准:①第一次随访即失访;②死于围手术期并发症;③术前行放疗和化疗;④未明确浸润深度、淋巴结转移和肿瘤分期等基本临床病理特征;⑤确诊为其他癌症的患者。本研究最终纳入270 例胃癌患者,此方案通过了吉林大学第一医院伦理委员会的审批(审批号:2018-189)。
1.2 临床资料包括一般人口学资料(患者性别和年龄) 和临床资料[疾病诊断、手术日期、肿瘤类型、肿瘤大小、肿瘤组织学分级、肿瘤临床分期(TNM 分期)、术后化疗及其他治疗方案等信息]。TNM 分期按照国际抗癌联盟/美国癌症联合会(AJCC/UICC) 联合制定的TNM 分期系统第8 版进行划分。
1.3 随访 随访员于患者术后第1、3、6 个月和之后每年1 次对所有研究对象进行随访。随访内容包括: 患者术后及出院后的治疗情况和预后情况(复发、进展和死亡),若死亡需记录死因及死亡日期,若失访需定期到公安局人口管理系统查询核实,并记录患者生存状况、死亡原因和死亡时间。随访时间自患者接受治疗之日起,截止到2018 年8 月,中位随访时间为65.77 个月,随访时间最长为100.17 个月。随访期间患者共死亡160 例,健在99 例,失访11 例,失访率为4.10%。生存时间定义为患者自接受手术之日起直至患者死亡的时间(若死亡),或到末次随访时间(若存活),或到上一次随访时间(若失访)。
1.4 试剂、主要仪器和设备兔抗MMP-9 (货号:ab76003,浓度1∶150) 和TIMP-1 (货号:ab211926,浓度1∶150) 单克隆抗体(英国Abcam公司),乙二胺四乙酸(EDTA)、PBS 缓冲液、动物非免疫血清(羊) 和二氨基联苯胺(DAB) 显色试剂盒(福州迈新试剂生物技术有限公司),中性甲醛(长春赛默瑞特科技有限公司),石蜡(上海器械厂华灵康复有限公司),乙醇和二甲苯(北京化工厂),中性树脂封片剂(中国上海标本模型厂)。移液器(德国Eppendorf 公司),电磁炉(中国美的集团),切片机(德国莱卡公司),烘箱(上海一恒科学仪器有限公司),显微镜(日本奥林巴斯公司),冰箱(中国海尔集团)。
1.5 样本采集于患者胃癌根治术中留取肿瘤黏膜组织2~3 块,在离体30 min 内液氮速冻。样本于-80 ℃冰箱储存,同时制作保留石蜡包埋的癌组织切片,用于免疫组织化学染色。
1.6 免疫组织化学染色分别采用MMP-9 和TIMP-1 单克隆抗体对胃癌石蜡组织包埋病理切片进行染色。切片置于65 ℃烘箱中烘烤20 min;常规脱蜡,梯度水化,EDTA 修复液高温抗原修复20 min,冷却后PBS 缓冲液润洗3 次,每次5 min;滴加内源性过氧化酶阻断剂,湿盒室温孵育10 min;PBS 缓冲液润洗3 次后,滴加封闭液,湿盒室温孵育15 min;滴加稀释后的一抗,每张切片约60 μL,湿盒室温孵育1.5 h; PBS 缓冲液润洗3 次,各5 min; 滴加HRP 标记羊抗兔IgG 抗体,湿盒室温孵育25 min;PBS 缓冲液洗涤3 次,每次5 min;DAB 显色,苏木精复染1 min,梯度乙醇反向脱水,每次1 min ,二甲苯浸泡2 次,每次2 min,最后中性树脂封片后用显微镜进行观察。由2 位病理医生独立对免疫组织化学染色结果进行评估,当结果不一致时,由第3 位病理医生进行裁定。肿瘤细胞中MMP-9 和TIMP-1 表达部位为细胞膜或细胞浆,当呈现棕黄色染色时,计为MMP-9 或TIMP-1 阳性表达,不染色则计为阴性表达。当联合分析时,根据MMP-9 和TIMP-1 蛋白表达情况,可分为MMP-9-/TIMP-1-、 MMP-9+/TIMP-1-、MMP-9-/TIMP-1+和MMP-9+/TIMP-1+。
1.7 统计学分析采用SPSS 22.0 统计软件进行统计学分析。采用STATA12.0 统计软件绘制森林图。计数资料(患者年龄、性别、肿瘤大小、肿瘤类型、组织学分级、术后化疗、TNM 分期、结局、MMP-9 阳性表达率、 TIMP-1 阳性表达率和MMP-9/TIMP-1 表达情况) 以频数和构成比表示,组间比较采用χ2检验或Fisher精确概率法; 采用Kaplan-Meier 法绘制生存曲线,Log-rank 检验比较生存曲线的差异;采用多因素Cox 回归模型计算风险比(HRs) 及其95% 置信区间(95%CI),分析影响胃癌预后的独立影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌患者的一般特征本研究纳入270 例胃癌患者,其中年龄>65 岁108 例(40.0%),男性205 例(75.9%),肿瘤直径≥5 cm 患者188 例(69.6%),非印戒细胞型胃癌240 例(88.9%),组织学分级为高级别胃癌213 例(78.9%),术后未进行规范化疗者152 例(56.3%),TNM 分期Ⅲ期胃癌105 例(38.9%)。随访期间,99 例(36.7%) 患者仍然存活,11 例(4.1%) 患者失访,160 例(59.2%) 患者死亡,MMP-9 蛋白阳性表达率为30.4%,TIMP-1 蛋白阳性表达率为26.3%。见表1。

表1 胃癌患者的一般特征Tab.1 Baseline characteristics of gastric cancer patients
2.2 不同临床病理特征胃癌患者癌组织中MMP-9/TIMP-1 蛋白表达分布情况MMP-9 和TIMP-1 蛋白表达在不同年龄、性别、肿瘤大小、肿瘤类型、组织学分级、化疗和TNM 分期的胃癌患者中分布比较差异无统计学意义(P>0.05)。见表2。
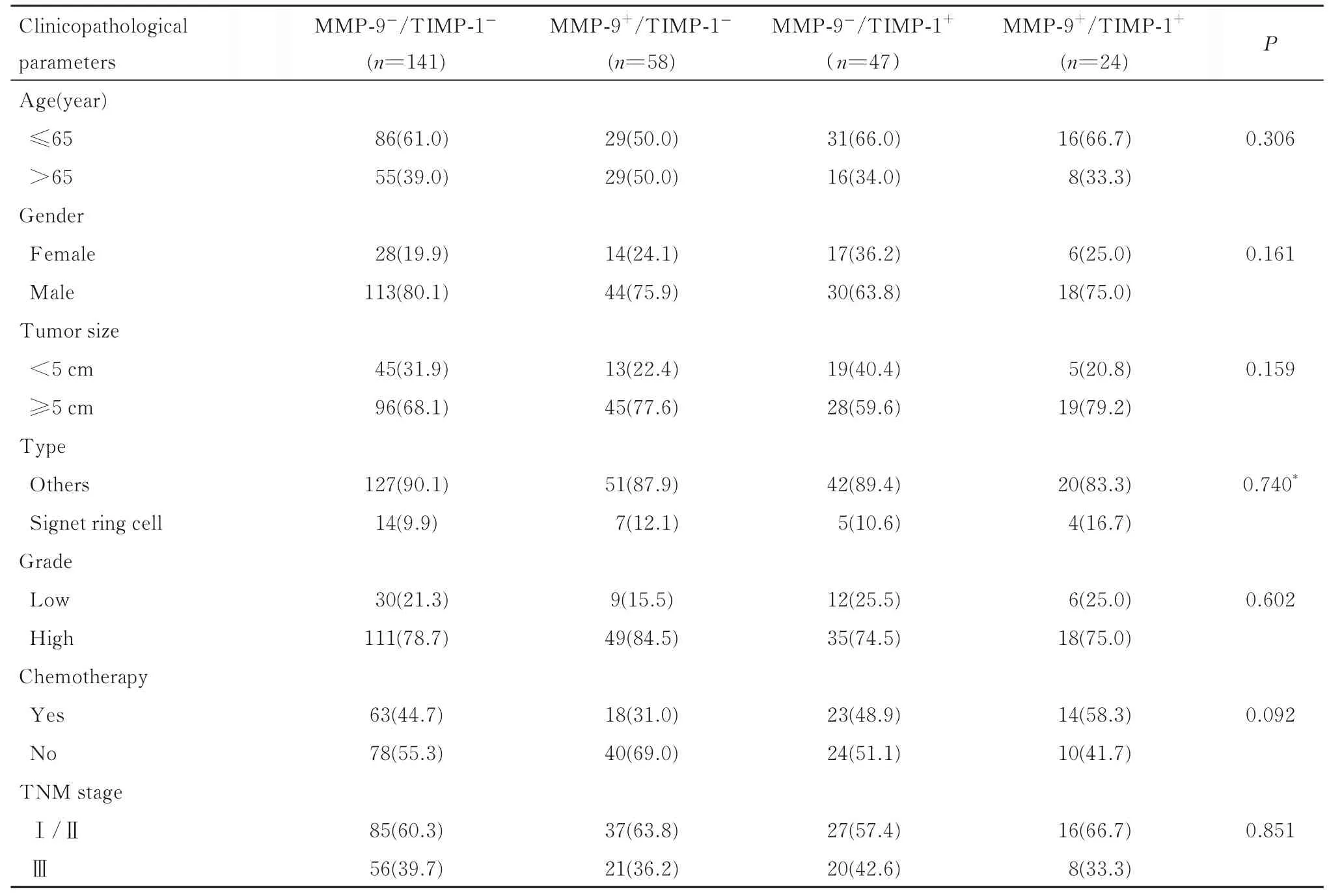
表2 不同临床病理特征胃癌患者癌组织中MMP-9 和TIMP-1 蛋白表达分布情况Tab.2 Distributions of MMP-9 and TIMP-1 expressions in cancer tissue of gastric cancer patients with different clinicopathological parameters [n(η/%)]
2.3 胃癌患者预后的单因素分析MMP-9+组胃癌患者的中位生存时间较MMP-9-组患者长(Log-rankP=0.044),MMP-9+/TIMP-1+组 与MMP-9+/TIMP-1-组胃癌患者生存时间比较差异无统计学意义(P>0.05),但MMP-9-组胃癌患者中位生存时间短,均表现出不良预后,因此本研究将MMP-9+/TIMP-1+和MMP-9+/TIMP-1-2 组曲线进行合并,着重探讨MMP-9+组、 MMP-9-/TIMP-1-组和MMP-9-/TIMP-1+组胃癌患者的预后情况,结果显示:MMP-9-/TIMP-1+组胃癌患者的中位生存时间最短,预后最差(Log-rankP=0.044)。见图1。组织学分级为高级别、术后未接受化疗和TNM 分期为Ⅲ期的胃癌患者中位生存时间明显缩短,预后更差(Log-rankP=0.007,Log-rankP<0.01,Log-rankP<0.001)。年龄、性别、肿瘤大小、肿瘤类型与胃癌患者预后无关联(P>0.05)。见表3。
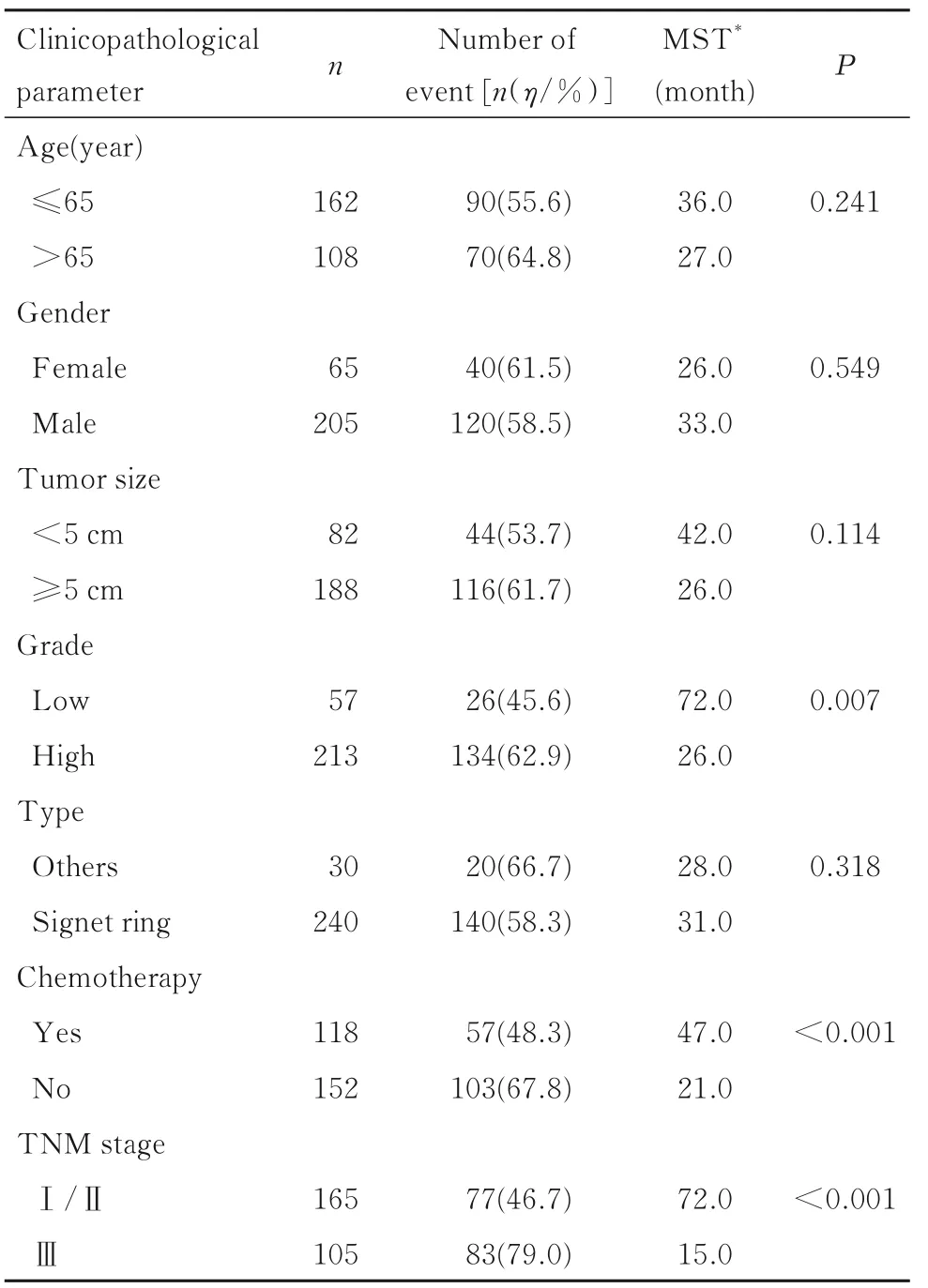
表3 胃癌患者预后的单因素Cox 回归分析Tab.3 Univariate Cox regression analysis on prognosis of gastric cancer patients [n(η/%)]

图1 不同MMP-9 和TIMP-1 蛋白表达胃癌患者的生存曲线Fig.1 Survival curves of gastric cancer patients with different expressions of to MMP-9 and TIMP-1 proteins
2.4 胃癌患者预后的多因素分析以患者生存状态为应变量(删失=0,死亡=1),以MMP-9/TIMP-1 蛋白表达(MMP-9-/TIMP-1+=1,MMP-9-/TIMP-1-=2,MMP-9+/TIMP-1+/-=3)、年龄(≤65=0,>65=1)、 性别(女=0 ,男=1)、肿瘤大小(<5 cm=0,≥5 cm=1)、肿瘤类型(非印戒细胞癌=0,印戒细胞癌=1)、组织学分级(低级别=0,高级别=1)、 术后化疗(化疗=0,未化疗=1) 和TNM 分期(Ⅰ/Ⅱ期=0,Ⅲ期=1) 为自变量纳入多因素Cox 回归分析,结果显示:MMP-9+与胃癌患者的良好预后相关;MMP-9-胃癌患者中,TIMP-1+患者的死亡风险明显 提 高,预 后 更 差(MMP-9+/TIMP-1+/-vsMMP-9-/TIMP-1+:HR=0.537,95%CI:0.338~0.851,P=0.008)。术后未进行化疗和较高的TNM 分期始终是胃癌患者预后的独立危险因素(HR=1.873,95%CI:1.334~2.631,P<0.001;HR=2.301,95%CI:1.656~3.197,P<0.001)。见表4。
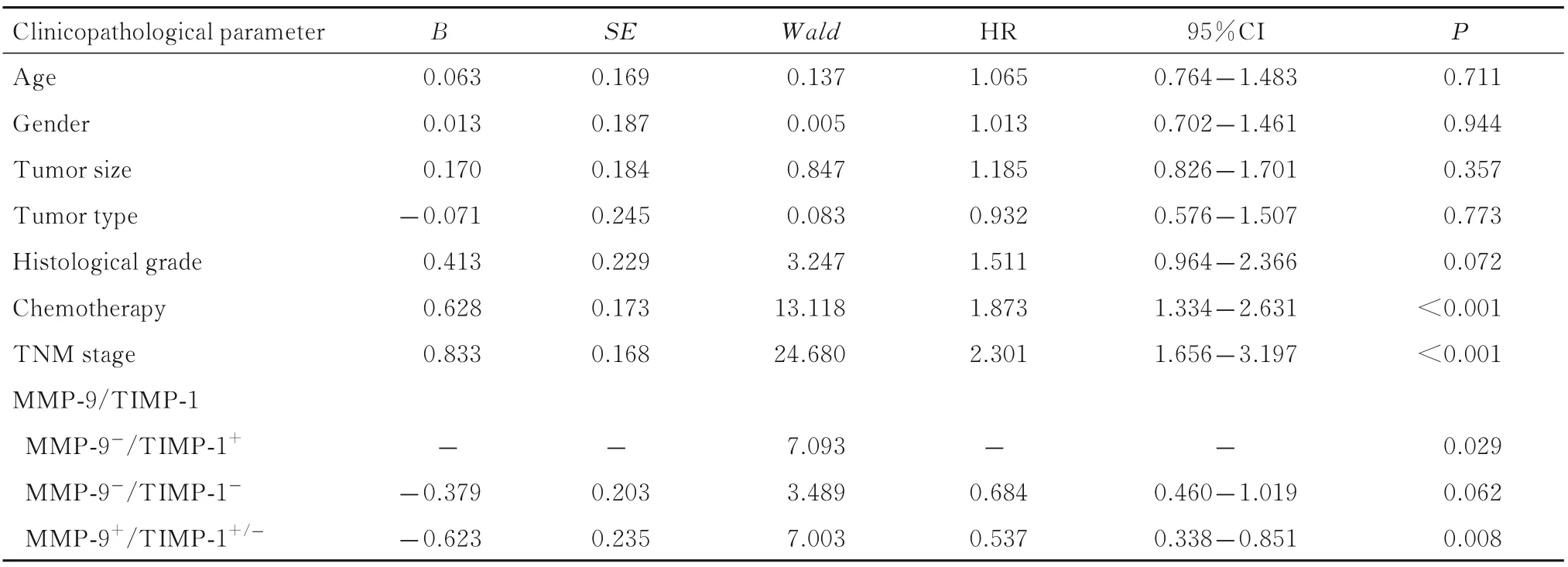
表4 胃癌患者预后的多因素Cox 回归分析Tab.4 Multivariate Cox regression analysis on prognosis of gastric cancer patients
2.5 MMP-9+和MMP-9-/TIMP-1+表达在胃癌患者预后评估中的亚组分析为了准确评估在不同化疗情况、 不同TNM 分期和不同类型胃癌患者中MMP-9+和MMP-9-/TIMP-1+表达的预后评估价值,本研究进行了亚组分析,结果显示:与TNM分期为Ⅲ期、未接受术后化疗和印戒细胞型的胃癌患者比较,MMP-9/TIMP-1 联合表达对TNM 分期为Ⅰ/Ⅱ期、接受术后化疗和非印戒细胞型的患者预后评估价值更大,其中MMP-9+组患者的预后优于MMP-9-/TIMP-1+组(P<0.05)。见图2。
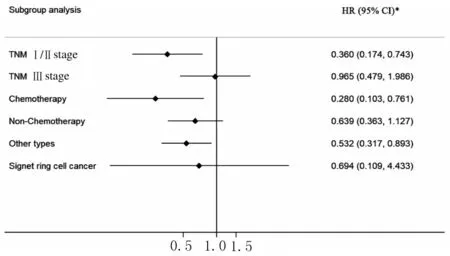
图2 MMP-9 联合TIMP-1 表达与胃癌患者预后的关系Fig.2 Relationship between expressions of MMP-9 and TIMP-1 and prognosis of gastric cancer patients
3 讨 论
本研究利用胃癌生存队列,评估了MMP-9 和TIMP-1 蛋白表达对胃癌患者预后的预测价值,以期为开展胃癌的精准治疗、延长患者生存时间和提高患者生存质量提供依据。
既往研究[1,12]结果显示: MMP-9 能降解ECM 和基底膜,促进肿瘤侵袭和转移,可作为肿瘤不良预后的预测标志物。近年来研究[2,13-16]显示:MMP-9 还具有非蛋白酶依赖性活性,能在多种肿瘤中发挥抑癌作用,其阳性表达与结直肠癌、乳腺癌和肺癌等的良好预后有关联,与本研究结果一致。一方面,MMP-9 可以促进机体抗肿瘤的免疫应答[17],同时激活AMP 依赖的蛋白激酶(adenosine monophosphate activated protein kinase,AMPK),调控Toll 样受体4 (Toll-like receptors 4,TLR4) 与脂多糖的结合,介导机体的天然免疫反应[18];另一方面,MMP-9 还可以激活细胞因子,如血管内皮抑素、肿瘤抑素和肿瘤坏死因子α 等,抑制肿瘤血管生成[19],并激活细胞信号转导通路[3,20-22],抑制癌细胞分化,促进细胞凋亡、细胞周期停滞和DNA 损伤。因此,MMP-9 在胃癌中可能更多地发挥了免疫调控和抗血管生成的作用,进而影响胃癌患者的预后。
本研究结果显示:MMP-9+胃癌患者的预后较好,MMP-9-胃癌患者中,TIMP-1+患者的预后最差。TIMP-1 作为MMP-9 特异性的内源性抑制剂,与其按照1∶1 的比例结合,进而参与一个涉及多细胞因子、多信号通路的蛋白互作网络,调控肿瘤的发生发展[23]。既往研究[9-11]显示: MMP-9 和TIMP-1 蛋白表达平衡随肿瘤的进展而变化,二者的联合表达较单独的MMPs 或TIMPs 的变化意义更大。在非侵袭性的肿瘤早期,肿瘤细胞或基质细胞[24]分泌的MMP-9 表达水平较低,尚不足以诱导TIMP-1 分泌,该阶段以MMP-9 阳性表达为主要表现[9,25],MMP-9 能介导宿主免疫防御反应[2,16],同时激活抗血管生成因子,发挥抑癌作用[26-27]。当MMP-9 分泌增多,肿瘤细胞或基质细胞就会诱导TIMP-1 分泌来调节蛋白酶反应,二者的表达量均呈现较高趋势[25]。随着肿瘤的进一步进展,MMP-9 可能被高水平的TIMP-1 所抑制,该阶段以TIMP-1 阳性表达为主要表现[9],高水平的TIMP-1 能激活TGF-α/β、 VEGF 和CAM,结合细胞表面蛋白CD63,激活FAK-PI3K/AKT 和MAPK 信号通路,导致肿瘤细胞增殖失控和播散生长[8,28]。
本研究中亚组分析结果也显示:对于TNM 分期为Ⅰ/Ⅱ期的胃癌患者,MMP-9+对预后的预测价值更大;对于接受术后化疗的胃癌患者,在肿瘤负荷降低或免疫状态改变后,MMP-9+可作为患者良好预后的预测标志物。在其他类型肿瘤中,MMP-9 对不同分期的肿瘤患者预后的预测价值可能不同[6,29],在早期直肠癌和乳腺癌中,MMP-9+与患者的良好预后有关联[14-15],但在进展期直肠癌中,则是患者不良预后的预测标志物[30]。上述研究结果均提示:MMP-9 的动态变化及其与TIMP-1的动态平衡,可能在胃癌进展的不同阶段发挥不同作用。目前,MMP-9 抑制剂已进入临床试验阶段,但效果并不理想。
本研究存在一定的局限性。首先,本研究的研究对象缺少TNM 分期为Ⅳ期或不能进行根治术的胃癌患者,因此MMP-9 和TIMP-1 联合表达对晚期胃癌患者预后的预测作用尚不明确,仍需进一步研究。其次,当联合分析时,MMP-9+/TIMP-1+组、MMP-9+/TIMP-1-组和MMP-9-/TIMP-1+组的样本量较小,未来需扩大样本量继续进行研究。最后,对肿瘤组织中MMP-9 和TIMP-1 的免疫组织化学染色法的评价尚无统一标准,未来需深入研究以建立标准化评价方案。
综上所述,MMP-9/TIMP-1 联合表达可作为胃癌根治术后患者预后的独立预测因子,MMP-9+是胃癌患者预后良好的独立影响因素,MMP-9-胃癌患者中,TIMP-1+患者的死亡风险更高,预后更差。深入探讨MMP-9 和TIMP-1 在胃癌组织中的表达模式和机制对实现胃癌患者的个体化预后评价和精准治疗具有重要价值。

