山姜素对来曲唑诱导的多囊卵巢综合征模型大鼠的治疗作用及其机制
孙艳敏, 胡俊攀, 王冰玉, 傅金英
(河南省中医院 河南中医药大学第二附属医院妇产科,河南 郑州 450002)
多囊卵巢综合征(polycystic ovary syndrome,PCOS) 是绝经前女性中发生的一种以稀发排卵、高雄激素血症、胰岛素抵抗和卵巢多囊样改变为主要特征的内分泌代谢紊乱性疾病[1]。虽然PCOS 的病因尚未明确,但目前普遍认为卵巢颗粒细胞损伤与PCOS 的卵泡发育异常/闭锁以及排卵障碍有关。孙春玲等[2]发现:PCOS 患者的窦状卵泡期颗粒细胞中B 细胞淋巴瘤2 (B-cell lymphoma-2,Bcl-2)蛋白表达降低,Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax) 和程序性细胞死亡分子5(programmed cell death 5,PDCD5) 蛋白表达水平升高,提示PCOS 患者窦状卵泡期颗粒细胞存在程序性细胞死亡现象。近来多项研究[3-6]显示: 在PCOS 患者和动物模型卵巢颗粒细胞中微管相关蛋白1 轻链3-Ⅱ(microtubule associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)、 自噬相关基因(autophagy related gene,ATG) 5、 ATG7 和Beclin-1 等自噬标记物蛋白的表达水平均升高,自噬底物p62 表达水平降低,细胞活性降低,提示抑制颗粒细胞的自噬有助于改善PCOS 症状。然而,目前并无特异性治疗PCOS 的药物,因此寻找一种可以针对抑制颗粒细胞自噬性死亡信号的药物,对PCOS 治疗药物的开发和筛选具有重要意义。
山姜素(alpinetin,ALP) 是一种主要从草豆蔻的根或种子提取的天然黄酮类化合物,已知其具有抗菌、消炎、抗氧化、抗肿瘤和降血脂等多种药理作用[7-8]。最近研究[9]显示:ALP 能增加高脂饮食诱导的非酒精性脂肪肝病模型小鼠的胰岛素敏感性。另外研究[10-12]显示:ALP 具有调节细胞凋亡、自噬和甾体激素的作用。基于ALP 的药理活性和PCOS 的症状和病理特征,推测ALP 可能具有治疗PCOS 的作用,但ALP 在PCOS 中的作用机制尚不清楚。因此,本研究旨在观察ALP 对来曲唑诱导的PCOS 模型大鼠的影响,并探讨其潜在机制。
1 材料与方法
1.1 实验动物、主要试剂及仪器4 周龄SPF 级未孕雌性SD 大鼠40 只,体质量75~85 g,购自河南省实验动物中心,动物生产许可证号:SCXK (豫)2017-0001。来曲唑(浙江海正药业股份有限公司),ALP (纯度>99%,湖北广奥生物科技有限公司),大鼠睾酮和17β-雌二醇的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(上海康朗生物科技有限公司),HE 染色试剂盒和生物素-链霉卵白素免疫组织化学染色试剂盒(北京中杉金桥生物技术有限公司),RIPA 裂解液和ECL 发光试剂盒(北京索莱宝生物技术有限公司),BCA 蛋白定量试剂盒、 甘油醛-3- 磷酸脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 抗体和辣根过氧化物酶(horse radish peroxidase,HRP) 标记的山羊抗兔IgG (上海碧云天生物技术有限公司),裂解的天冬氨酸特异性半胱氨酸蛋白酶-3 (Cleaved caspase-3) 抗体(美国Cell Signaling Technology 公司),Bax、Bcl-2 和LC3 抗体(美国Abcam 公司)。DNM-9602G 酶标仪(北京普朗新技术有限公司),BX53 显微镜(日本Olympus 公司),微型垂直电泳-电转仪(美国Bio-Rad 公司)。
1.2 实验动物分组及实验方案设计SD 大鼠饲养于河南省中医院中心实验室SPF 级动物房,温度22 ℃~24 ℃,湿度55%~65%,12 h 明暗循环,自由饮水摄食。大鼠经适应性饲养1 周后,随机分为对照组(n=9) 和造模组(n=31)。按照参考文献[13] 中的方法,以1 mg·kg-1·d-1来曲唑连续口服21 d 构建PCOS 大鼠模型。通过连续阴道涂片检查观察大鼠的动情周期,将表现出无/不规则卵巢周期大鼠定义为PCOS 阳性。取造模成功的27 只PCOS 大鼠随机分为模型组、低剂量ALP 组和高剂量ALP 组,每组9 只。低和高剂量ALP 组大鼠分别给予50 和100 mg·kg-1ALP 口服,每天1 次,连续给药14 d。对照组和模型组大鼠正常饲养14 d。治疗结束后,即刻测量大鼠体质量。连续14 d 用阴道涂片检测所有大鼠的动情周期,并计算发情间期(天数) 占整个动情周期(天数) 的百分率,即发情间期时像百分率。
1.3 标本采集50 mg·kg-1戊巴比妥腹腔注射麻醉大鼠后,用真空抗凝管收集眼眶血,将血样在室温静置10 min,2 500 r·min-1离心15 min 收集血清。迅速解剖并摘取大鼠双侧卵巢,在解剖显微镜下去除表面包膜和周围脂肪组织后,称双侧卵巢质量,并计算卵巢/体质量比(卵巢质量/体质量)。沿中轴切下一侧卵巢并用中性甲醛固定,常规石蜡包埋,用于后续HE 染色和免疫组织化学检测;另一侧卵巢用无菌生理盐水清洗后并将其置入DMEM/F12 培养基中,在解剖显微镜下刺破卵泡,收集颗粒细胞并过200 目细胞筛,收集细胞用于后续Western blotting 法检测。
1.4 ELISA 法检测各组大鼠血清中睾酮和17β-雌二醇水平按照试剂盒说明书步骤,采用ELISA试剂盒检测大鼠血清中样品中睾酮和17β-雌二醇水平,用酶标仪在波长450 nm 处记录每孔的吸光度(A) 值。然后根据绘制的标准曲线计算大鼠血清中睾酮和17β-雌二醇水平。
1.5 HE 染色观察各组大鼠卵巢组织病理形态表现将卵巢石蜡组织切为5 μm 厚度的组织切片,经脱蜡和水化后,行常规HE 染色,用显微镜观察大鼠卵巢组织病理形态表现并拍照。
1.6 免疫组织化学染色观察各组大鼠卵巢组织中Cleaved caspase-3 蛋白表达强度和分布情况每只大鼠任取5 个不同的卵巢组织石蜡切片(5 μm 厚度),经脱蜡、水化、阻断内源性过氧化物酶和封闭后,室温孵育Cleaved caspase-3 (1∶200) 1 h,并设置空白对照组(用PBS 缓冲液代替一抗),然后,按照生物素-链霉卵白素免疫组织化学染色试剂盒步骤依次孵育生物素标记的山羊抗兔IgG(1∶200)和HRP 标记的链霉卵白素(1∶200) 后,用DAB显色和苏木素复染后,在显微镜下观察并拍照。根据空白对照组判断各组大鼠卵巢组织中Cleaved caspase-3 是否呈阳性表达。每组任选5 个切片,根据每个切片的定位细胞中Cleaved caspase-3阳性着色程度(+,计1分;■,计2分;■,计3 分) 和阳性着色的定位细胞总数(+,5%<着色细胞总数<25%;■,25%≤着色细胞总数<50%;■,着色细胞总数≥50%) 判断Cleaved caspase-3阳性表达强度。
1.7 Western blotting 法检测各组大鼠卵巢颗粒细胞中Bax、Bcl-2、LC3-Ⅱ和LC3-Ⅰ蛋白表达水平用RIPA 裂解颗粒细胞,提取蛋白。采用BCA试剂盒对蛋白定量后,取等量的蛋白通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,并将其转移到聚偏二氟乙烯(PVDF) 膜上。采用5% 牛血清白蛋白封闭非特异性结合位点后,分别室温孵育一抗(1∶1 000 稀释比例的Bax、Bcl-2 和LC3,1∶8 000 稀释比例的GAPDH) 2 h,用TBST 缓冲液冲洗3 次后,室温孵育HRP 标记的山羊抗兔IgG二抗(1∶1 000) 1 h,TBST 洗涤3 次。通过增强的ECL 发光检测试剂盒使得条带曝光并显影于胶片。用Image J 软件对条带进行扫描并检测灰度值。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值;Bax/Bcl-2 比值=Bax 蛋白表达水平/Bcl-2 蛋白表达水平×100%,LC3-Ⅱ/LC3-Ⅰ比值=LC3-Ⅱ蛋白表达水平/LC3-Ⅰ蛋白表达水平×100%。
1.8 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组大鼠体质量,卵巢质量/体质量比,发情间期时像百分率,血清中睾酮和17β-雌二醇水平,卵巢颗粒细胞中Bax/Bcl-2 和LC3- Ⅱ/LC3-Ⅰ比值均呈正态分布,以-x±s表示。多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠体质量、卵巢质量/体质量比和发情间期时像百分率与对照组比较,模型组大鼠体质量、卵巢质量/体质量比和发情间期时像百分率均明显升高(P<0.01);与模型组比较,低和高剂量ALP 组大鼠体质量、卵巢质量/体质量比和发情间期时像百分率均明显降低(P<0.05 或P<0.01)。见表1。
表1 各组大鼠体质量、卵巢质量/体质量比和发情间期时像百分率Tab.1 Body weights, ovary weight/body weight ratios and percentages of diestrous phase of rats in various groups (n=9,-±s)
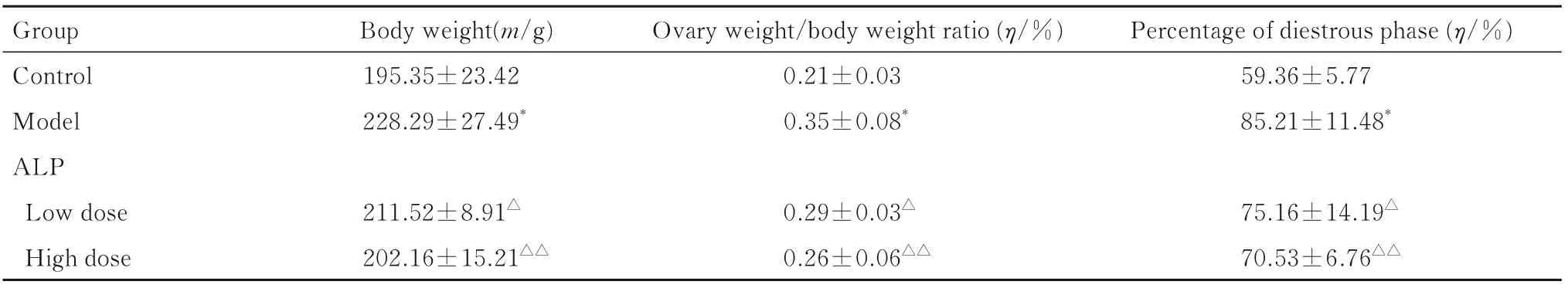
表1 各组大鼠体质量、卵巢质量/体质量比和发情间期时像百分率Tab.1 Body weights, ovary weight/body weight ratios and percentages of diestrous phase of rats in various groups (n=9,-±s)
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group.
Group Control Model ALP Low dose High dose Body weight(m/g)195.35±23.42 228.29±27.49*211.52±8.91△202.16±15.21△△Ovary weight/body weight ratio (η/%)0.21±0.03 0.35±0.08*0.29±0.03△0.26±0.06△△Percentage of diestrous phase (η/%)59.36±5.77 85.21±11.48*75.16±14.19△70.53±6.76△△
2.2 各组大鼠血清中睾酮和17β-雌二醇水平与对照组比较,模型组大鼠血清中睾酮和17β-雌二醇水平均明显升高(P<0.01);与模型组比较,低剂量ALP 组大鼠血清中睾酮水平明显降低(P<0.05),而17β-雌二醇水平无明显变化(P>0.05);高剂量ALP 组大鼠血清中睾酮和17β-雌二醇水平均明显降低(P<0.05 或P<0.01)。见表2。
表2 各组大鼠血清中睾酮和17β-雌二醇水平Tab.2 Levels of testosterone and 17β -estradiol in serum of rats in various groups (n=9,-±s,ρB/(μg·L-1)]
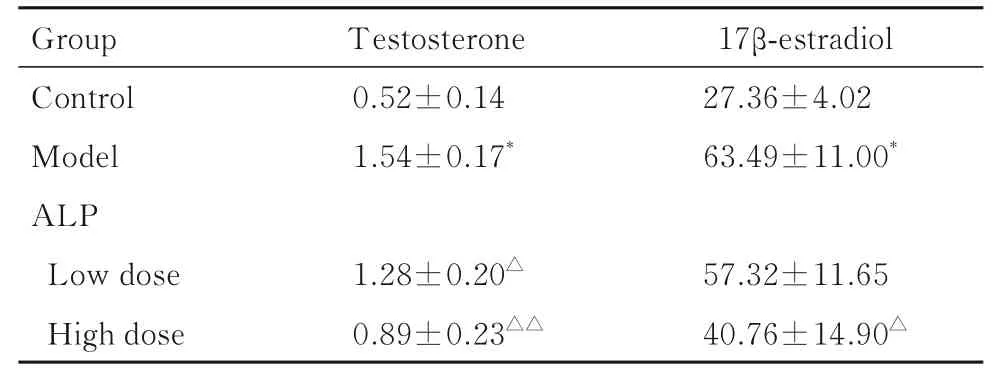
表2 各组大鼠血清中睾酮和17β-雌二醇水平Tab.2 Levels of testosterone and 17β -estradiol in serum of rats in various groups (n=9,-±s,ρB/(μg·L-1)]
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group.
Group Control Model ALP Low dose High dose Testosterone 0.52±0.14 1.54±0.17*1.28±0.20△0.89±0.23△△17β-estradiol 27.36±4.02 63.49±11.00*57.32±11.65 40.76±14.90△
2.3 各组大鼠卵巢组织病理形态表现对照组大鼠卵巢组织的颗粒细胞层结构正常,可见黄体和不同发育阶段的卵泡;模型组大鼠卵巢组织呈多囊性改变,黄体数量减少或消失,出现大量充液性大囊性卵泡和闭锁性卵泡,颗粒细胞层排列紊乱且层数减少;低和高剂量ALP 组大鼠卵巢组织中囊性卵泡和闭锁性卵泡变少,颗粒细胞层结构趋向正常。见图1。
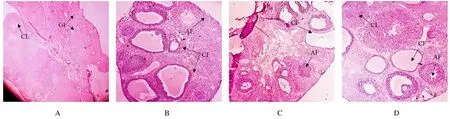
图1 各组大鼠卵巢组织病理形态表现(HE,×200)Fig.1 Pathomorphology of ovary tissue of rats in various groups (HE, ×200)
2.4 各组大鼠卵巢组织中Cleaved caspase-3 蛋白表达强度和分布情况对照组大鼠卵巢组织颗粒细胞层中Cleaved caspase-3 呈阴性表达;模型组大鼠卵巢组织中Cleaved caspase-3 蛋白呈阳性表达,且主要定位于颗粒细胞层;与模型组比较,低和高剂量ALP 组大鼠卵巢组织颗粒细胞层中Cleaved caspase-3 蛋白阳性表达强度明显降低。见图2。
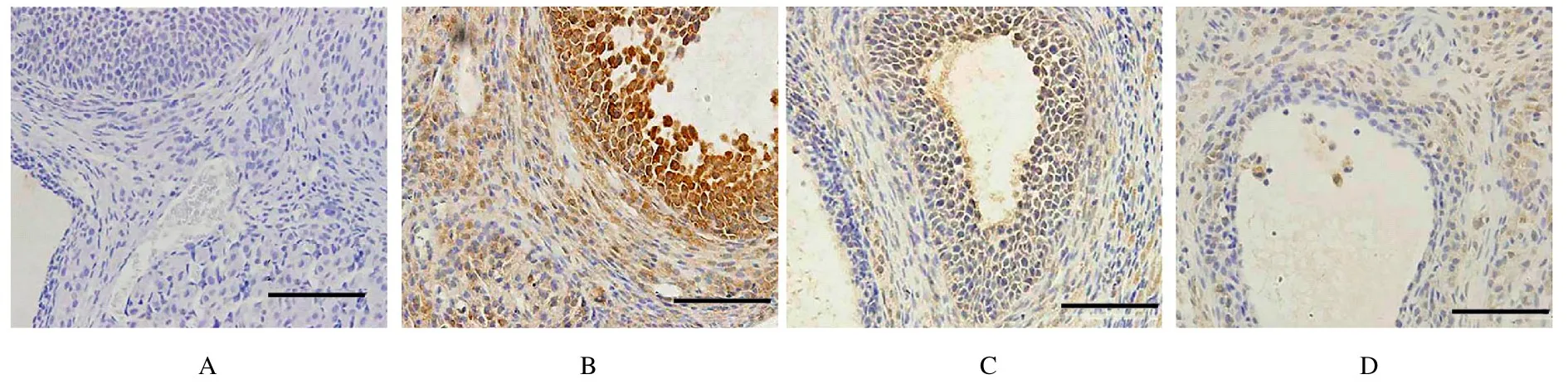
图2 各组大鼠卵巢组织中Cleaved caspase-3 蛋白表达情况(免疫组织化学,Bar=200 μm)Fig.2 Expressions of Cleaved caspase-3 in ovary tissue of rats in various groups(Immunohistochemistry,Bar=200 μm)
2.5 各组大鼠卵巢颗粒细胞中Bax/Bcl-2 和LC3-Ⅱ/LC3-Ⅰ比值与对照组比较,模型组大鼠卵巢颗粒细胞中Bax/Bcl-2 和LC3-Ⅱ/LC3-Ⅰ比值均明显升高(P<0.01);与模型组比较,低和高剂量ALP 组大鼠卵巢颗粒细胞中Bax/Bcl-2 和LC3-Ⅱ/LC3-Ⅰ比值均明显降低(P<0.05 或P<0.01)。见图3 和表3。
表3 各组大鼠卵巢颗粒细胞中Bax/Bcl-2 和LC3-Ⅱ/LC3-Ⅰ比值Tab.3 Ratios of Bax/Bcl-2 and LC3-Ⅱ/LC3-Ⅰin ovarian granulosa cells of rats in various groups (n=9,-±s,η/%)

表3 各组大鼠卵巢颗粒细胞中Bax/Bcl-2 和LC3-Ⅱ/LC3-Ⅰ比值Tab.3 Ratios of Bax/Bcl-2 and LC3-Ⅱ/LC3-Ⅰin ovarian granulosa cells of rats in various groups (n=9,-±s,η/%)
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group.
Group Control Model ALP Low dose High dose Bax/Bcl-2 96.73±29.58 312.69±24.29*244.32±13.74△197.54±17.65△△LC3-Ⅱ/LC3-Ⅰ102.75±16.35 464.16±50.42*354.75±66.20△206.83±43.16△△
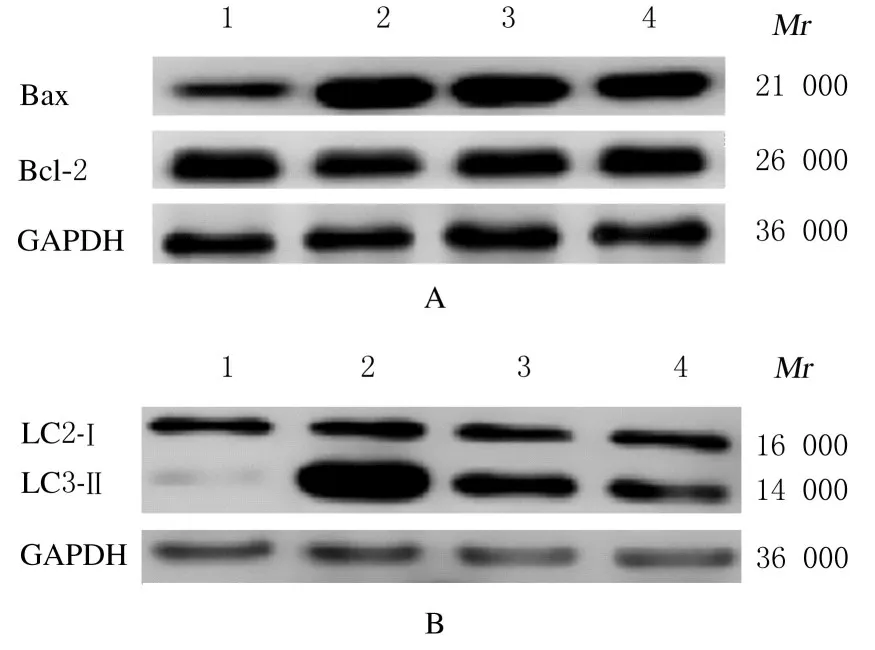
图3 各组大鼠卵巢颗粒细胞中Bax 、Bcl-2(A)和LC3Ⅰ、LC3Ⅱ(B)蛋白表达电泳图Fig.3 Electrophoregram of expressions of Bax, Bcl-2(A),and LC3Ⅰ,LC3Ⅱ(B)proteinsinovariangranulosa cells of rats in various groups
3 讨 论
研究[14]显示:育龄期女性中PCOS 患病率约为10%,且发病率呈逐年上升趋势。PCOS 不仅是造成育龄期妇女不孕的主要原因之一,还会大幅增加糖尿病、高血压、异常脂血症、高胰岛素血症和心血管疾病的患病风险[15-16]。目前关于PCOS 发病和进展机制并不清楚,临床常用的治疗策略也仅是对症治疗且效果不理想,因此筛选优良的PCOS 治疗药物具有重要意义。
现有研究[7-12]表明:ALP 具有抗炎、抗氧化、抗胰岛素抵抗、调节激素和细胞自噬等药理作用,提示ALP 可能具有抗PCOS 的作用,但ALP 在PCOS 中的作用尚不清楚。在本研究中,对照组大鼠遵从规律的动情周期,而来曲唑诱导的PCOS 模型大鼠表现为发情间期延长,ALP 治疗可以缩短PCOS 模型大鼠发情间期时像。已有研究[13,17]表明:动情周期的变化与睾酮浓度的变化有关,外周血睾酮水平增加能导致卵巢周期不规则、发情间期延长和体质量增加。因此,ALP 降低PCOS 模型大鼠的体质量和发情间期时像的百分率的作用可能与其降低外周血睾酮浓度有关联。
卵泡发育异常是引起PCOS 排卵障碍的主要因素[18]。卵巢颗粒细胞能合成和分泌的雌二醇、胰岛素样生长因子和其他细胞因子,表达诸如雌二醇、促卵泡激素和促黄体生成素等激素的受体,而上述激素和激素受体能介导卵泡生长发育、闭锁和排卵[19-21]。因此,颗粒细胞损伤是导致卵泡发育异常和闭锁的关键因素。在PCOS 中存在颗粒细胞自噬性死亡的现象,且其能加剧卵泡闭锁和排卵障碍[3-6]。本文作者观察到:PCOS 模型大鼠卵巢颗粒细胞的自噬性死亡增加,ALP 可以有效抑制PCOS 模型大鼠卵巢颗粒细胞的自噬性死亡,同时减少卵泡发育异常/闭锁,提示ALP 可对PCOS 模型大鼠的颗粒细胞起到保护作用。
综上所述,本研究结果表明:ALP 能改善来曲唑诱导的PCOS 模型大鼠的症状,包括降低大鼠体质量、卵巢质量/体质量比、发情间期时像百分率、血清中睾酮和17β-雌二醇水平,改善卵巢呈多囊性改变和减少闭锁卵泡数,并抑制颗粒细胞损伤,提示ALP 是潜在的治疗PCOS 的药物。

