桦木酸对胃癌MGC-803 细胞迁移和侵袭的抑制作用及其机制
许广松,蒋海兵, 盘 箐, 李国庆
(1.南华大学衡阳医学院附属第二医院普外科,湖南 衡阳 421001;2.南华大学衡阳医学院附属第二医院消化内科,湖南 衡阳 421001;3.永州职业技术学院病原生物与免疫学教研室,湖南 永州 425100)
胃癌是世界上常见的恶性肿瘤之一,也是全球癌症死亡的第二大原因。胃癌的治疗以手术切除为主,辅以化疗和放疗等综合治疗,但死亡率仍然很高[1-2]。晚期或转移性胃癌患者缺乏更好的治疗方法,全身化疗仍是主要选择[3-4]。但常规化疗药物具有较高耐药性、细胞毒性和严重不良反应[5-6],因此寻找一种高效且不良反应少的抗癌药物,对减少胃癌化疗引起的不良反应具有重要意义。
桦木酸(betulinic acid,BEA) 是一种来源广泛的五环三萜类化合物,具有抗肿瘤、抗炎和抗疟疾等多种生物活性[7-8]。有研究[9]表明:BEA 可抑制肝癌细胞的增殖。但到目前为止,BEA 在胃癌中的研究少见报道,其作用机制仍不清楚。转化生长因子β1(transforming growth factor-β1,TGF-β1)/SMAD 通路是一种广泛存在于正常细胞和肿瘤细胞的跨膜信号转导通路,可以激活上皮-间质转化(epithelial-mesenchymal-transition,EMT),引起肿瘤的发生,参与肿瘤细胞的增殖、侵袭、转移和凋亡等病理过程[10-11]。本研究观察BEA 对胃癌MGC-803 细胞TGF-β/SMAD 信号通路的影响,并进一步阐明其可能的作用机制,为BEA 的临床应用提供依据。
1 材料与方法
1.1 主要试剂和仪器BEA 购自美国Sigma 公司,CCK-8 试剂盒购自南京逸飞雪生物科技有限公司,AnnexinⅤ-FITC 凋亡试剂盒购自日本同仁化工公司,性别决定区Y 框蛋白4 (SRY-box 4,SOX4)、E 盒结合锌指蛋白2 (zinc finger E-box- binding protein 2,ZEB2)、 基质金属蛋白酶9 (matrix metalloproteinase-9,MMP-9) 及锌指转录因子Snail 和Slug 抗体购自美国CST 公司,转化生长因子β 受体1 (transforming growth factor-β receptor 1,TGF-βR1)、SMAD 同源物7 (SMAD homology 7,SMAD7)、 SMAD 同源物2 (SHAD homology 2,SMAD2)、 磷酸化 SMAD2 (phosporylated SMAD2,p-SMAD2)、 SMAD 同源物3 (SMAD homology3,SMAD3) 和磷酸化SMAD3(phosphorylated SMAD3,p-SMAD3) 抗体购自武汉博斯特生物技术公司,RIPA 裂解缓冲液、蛋白酶抑制剂和增强化学发光 (enhanced chemiluminescence,ECL) 试剂均购自南京诺唯赞生物科技有限公司。Transwell 小室购自美国Corning Costar 公司。
1.2 细胞培养人胃癌MGC-803 细胞株购自美国模式培养物研究所(American Type Culture Collection ,ATCC),用含10% 胎牛血清、100 U·mL-1青霉素和100 g·mL-1链霉素的DMEM高糖培养基,置于37℃、5% CO2培养箱中培养。
1.3 CCK-8 法检测各组细胞增殖率将MGC-803细胞(3 000 个/孔) 接种于96 孔细胞培养板中,预培养24 h 后,分为对照组和不同剂量BEA 组,分别采用含0、 2.5、 5.0、 10.0、 20.0、 40.0 和80.0 μmol·L-1BEA 的DMEM 高糖培养基常规培养,分别在24、48 和72 h 加入CCK-8 试剂,采用分光光度法检测波长450 nm 处各组细胞的吸光度(A) 值。细胞增殖率=(实验组A 值- 空白组A 值) /(对照组A 值-空白组A 值) ×100%。
1.4 流式细胞术检测各组细胞凋亡率将MGC-803 细胞接种于12 孔细胞培养板中,分为对照组和不同剂量BEA 组,分别采用含0、2.5、5.0、10.0和20.0 μmol·L-1BEA 的DMEM 高糖培养基常规培养。置于培养箱中72 h 后,收集各组细胞,PBS缓冲液洗涤2 次,采用Annexin Ⅴ-FITC/PI 凋亡试剂盒染色,于流式细胞仪上检测并计算细胞凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数) /细胞总数×100%。
1.5 细胞迁移实验检测各组细胞迁移率细胞分组同 “1.4”,当MGC-803 细胞融合率达95% 后,用移液枪尖端垂直于细胞培养板划出一条直线,然后用PBS 缓冲液冲洗,去除分离的细胞。加入无血清DMEM 高糖培养基,加入不同剂量BEA。MGC-803 细胞在细胞培养箱中培养,24 h 后拍照,计算细胞迁移率。细胞迁移率=(0 h 划痕宽度-培养24 h 后划痕宽度) /0 h 划痕宽度×100%。
1.6 Transwell 法检测细胞侵袭能力细胞分组同“1.4”,将100 μL 基质凝胶和无血清DMEM 培养基(1∶8) 的混合物涂布在上Transwell 室上。在基质凝胶凝固4 h 后,将MGC-803 细胞(5×104mL-1) 用不含血清的DMEM 接种于上室,下室加入含10% 胎牛血清的DMEM 培养基。培养24 h 后,用甲醇固定,结晶紫染色,在显微镜下对膜下表面的细胞进行拍照和计数,以侵袭细胞数代表细胞侵袭能力。
1.7 Western blotting 法检测各组细胞中SMAD7、TGF- βR1、p-SMAD2、p-SMAD3、SOX4、ZEB2、MMP-9、Snail 和Slug 蛋白表达水平将MGC-803细胞分为对照组和20.0 μmol·L-1BEA 组,分别采用含0 和20.0 μmol·L-1BEA 的DMEM 高糖培养基常规培养。细胞以5×105mL-1密度接种于培养皿,培养48 h 后用RIPA 裂解液提取各皿总蛋白质,采用BCA 法检测总蛋白含量,将等量的蛋白质在10 % SDS-PAGE 上电泳,然后在硝酸纤维素膜上进行免疫印迹,室温下用5% 脱脂牛奶封闭细胞膜2 h,分别加入一抗,4 ℃孵育过夜,TBST 洗膜3 次;加入山羊抗兔HRP 标记二抗(稀释比例为1∶5 000),室温孵育1 h,ECL 显色,凝胶成像系统观察蛋白条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值。
1.8 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组细胞增殖率、细胞凋亡率、细胞迁移率、侵袭细胞数及细胞中SMAD7、TGF-βR1、p-SMAD2、 p-SMAD3、 SOX4、 ZEB2、 MMP9、Snail 和Slug 蛋白表达水平,均符合正态分布,以±s表示,进行方差齐性检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验;2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组细胞增殖率与对照组比较,培养24、48 和72 h 后,2.5、 5.0、 10.0、 20.0、 40.0 和80.0 μmol·L-1BEA 组细胞增殖率明显降低(P<0.05),且呈剂量依赖性。但BEA 剂量在20 μmol·L-1以上时,20.0、 40.0 和80.0 μmol·L-1BEA组间比较差异无统计学意义(P>0.05),因此 后 续Western blotting 实 验 采用20 μmol·L-1BEA。见表1。
表1 各组细胞增殖率Tab.1 Proliferation rates of cells in various groups(n=6,±s,η/%)

表1 各组细胞增殖率Tab.1 Proliferation rates of cells in various groups(n=6,±s,η/%)
* P<0.05 compared with control group.
Group Control BEA[cB/(μmol·L-1)]2.5 5.0 10.0 20.0 40.0 80.0 Proliferation rate(t/h) 24 100.00±1.20 86.20±4.53*75.45±3.66*70.32±3.11*67.53±2.87*66.20±2.54*64.60±3.53*48 93.52±3.61 74.60±3.23*62.47±3.25*57.63±2.55*50.22±1.86*48.60±1.55*48.20±3.73*72 102.30±3.77 75.14±3.20*67.50±2.62*61.82±2.34*59.53±2.10*57.10±1.50*55.22±2.38*
2.2 各组细胞凋亡率与对照组(3.10%±0.21%) 比较,培养72 h 后,2.5、 5.0、 10.0 和20.0 μmol·L-1BEA 组细胞凋亡率(11.22%±0.32%、 15.32%±0.50%、 23.35%±1.20% 和30.20%±2.36%) 逐渐升高(P<0.05),且呈剂量依赖性。见图1。

图1 流式细胞术检测各组细胞凋亡率Fig.1 Apoptotic rates of cells in various groups detected by flow cytometry
2.3 各组细胞迁移率与对照组比较,培养24 h后,2.5、5.0、10.0 和20.0 μmol·L-1BEA 组细胞迁移率明显降低(P<0.05),且呈剂量依赖性。见图2 和表2。

图2 细胞划痕实验检测各组细胞迁移率(Bar=250 μm)Fig.2 Migration rates of cells in various groups detected by cell scratch assay(Bar=250 μm)
2.4 各组细胞中侵袭细胞数与对照组比较,培养24 h 后,2.5、5.0、10.0 和20.0 μmol·L-1BEA组细胞中侵袭细胞数明显减少(P<0.05),且呈剂量依赖性。见图3 和表2。

表2 各组细胞迁移率和侵袭细胞数Tab.2 Migration rate and number invasion of MGC-803 cells in each group (n=6,x±s)
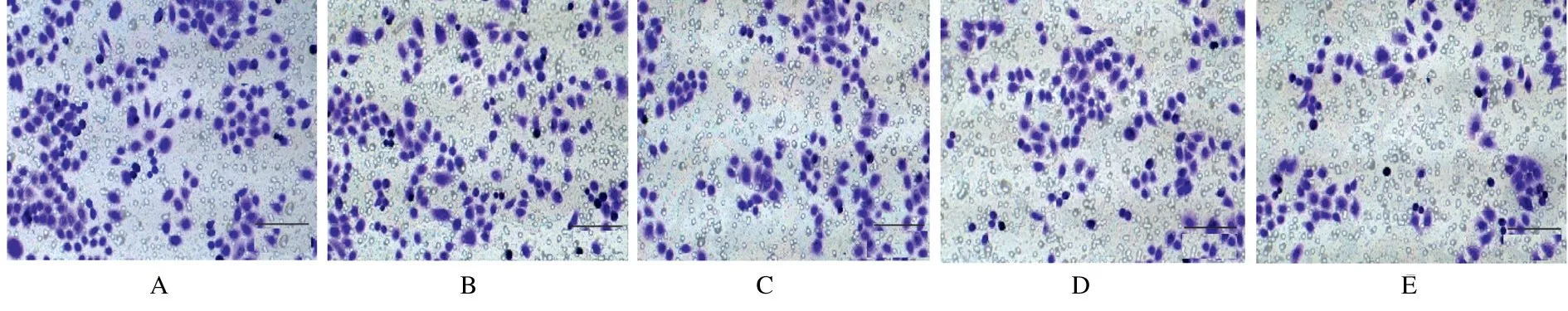
图3 Transwell 法检测各组细胞中侵袭细胞数(Bar=100 μm)Fig.3 Number of invasion cells in various groups detected by Transwell assay (Bar=100 μm)
2.5 2 组细 胞 中TGF- β/SMAD 信 号 通 路 及SOX4、ZEB2、MMP-9、Snail 和Slug 蛋白表达水平与对照组比较,培养48 h 后,20 μmol·L-1BEA组细胞中SMAD7 蛋白表达水平明显升高(P<0.05),TGF- β R1 、 p-SMAD2 、 p-SMAD3、SOX4、ZEB2、MMP-9、Snail 和Slug 蛋白表达水平明显降低(P<0.05)。见图4 和5。

图4 2 组细胞中TGF-β/SMAD 信号通路相关蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram(A) and histogram(B) of expressions of TGF- β / SMAD signaling pathway related proteins in cells in two groups
3 讨 论
目前,在世界范围内胃癌的发病率和病死率均处于较高水平,临床收治的胃癌患者以进展期为主。近年来随着新型药物的出现和治疗手段的多样化,对于无法手术晚期胃癌采取以药物治疗为主的综合治疗后,既可以提高胃癌患者的生存率,亦能改善患者的生活质量。中药蕴含的天然产物多样化、不良反应少且治疗效果明显,是寻找肿瘤多药耐药逆转剂的重要来源。研究[12]证实:BEA 具有多种生物活性,如抗癌、抗感染、免疫调节、抗病毒和抗炎等,并且对艾滋病的治疗有一定的辅助作用。因此,本研究通过观察BEA 对胃癌MGC-803细胞的作用效果,探讨其可能的作用机制。
本研究采用CCK-8 法检测结果显示:与对照组比较,MGC-803 细胞经不同浓度BEA 处理24、48 和72 h 后,细胞增殖率呈剂量依赖性降低,说明BEA 能抑制MGC-803 细胞增殖;流式细胞术检测结果显示: 经不同剂量BEA 作用72 h 后,MGC-803 细胞凋亡率随BEA 剂量增加而明显升高,表明BEA 可促进MGC-803 细胞凋亡;细胞划痕实验和Transwell 小室实验结果显示:与对照组比较,经不同剂量BEA 处理后MGC-803 细胞迁移率和侵袭细胞数均明显降低,说明BEA 能抑制MGC-803 细胞的迁移和侵袭。本研究结果表明:BEA 能明显抑制MGC-803 细胞的增殖、迁移和侵袭,并能促进MGC-803 细胞凋亡。BEA 对胃癌细胞有明显的抑制作用,可作为胃癌的化疗或辅助药物。
TGF-β 是一种多功能细胞因子,在多种肿瘤组织中高表达,与肿瘤的发生发展和预后有密切关联[13]。在大多数细胞中,SMADs 信号途径是TGF-β 发挥其生物学效应的经典途径,TGF-β/SMAD 信号通路分布于多种组织和细胞中,在调节细胞增殖、分化、代谢和迁移等功能中均发挥重要作用[14-15]。TGF-βR1 激活后,下游SMAD2 和SMAD3 被 磷 酸 化 激 活,激 活 的SMAD2 和SMAD3 继续与SMAD4 形成SMAD 复合物,该复合物转移到细胞核,与DNA 结合,调节靶基因的表达[16]。SMAD7 作为TGF-β/SMAD 信号通路的负调节因子,可与细胞质中的TGF-βR1 相互作用,导致TGF-βR1 降解[17]。本研究结果显示:BEA 可明显提高MGC-803 细胞中SMAD7 蛋白表达水平,抑制TGF- βR1 表达,从而降低TGF- βR1 下游SMAD2 和SMAD3 的磷酸化水平,表明BEA 可以通过上调SMAD7 的表达来抑制TGF-β/SMAD 信号通路的激活。
SOX4 基因是SOX 家族成员,属于编码转录因子,在促进骨及神经组织正常发育中发挥重要作用,还在多种恶性肿瘤中异常表达以及与肿瘤患者的预后及生存期有关联[18];MMP-9 是基质金属蛋白酶(matrix metalloproteinase,MMPs) 家族成员,在肿瘤血管生成、肿瘤细胞侵袭和转移过程中均发挥重要作用[19]; 转录因子Snail 和Slug 是EMT 过程中的重要分子,可以促进肿瘤的侵袭和转移,还可以通过调节细胞周期和凋亡促进细胞存活[20]。本研究结果显示:BEA 可降低MGC-803 细胞中SOX4、ZEB2、MMP-9、Snail 和Slug 蛋白表达水平,提示BEA 可能通过抑制MGC-803 细胞中TGF-β/SMAD 信号通路的激活,进而下调下游分子SOX4、 ZEB2、 MMP-9、 Snail 和Slug 蛋白表达,从而抑制胃癌细胞的增殖、 凋亡、 迁移和侵袭。

图5 2 组细胞中SOX4、ZEB2、MMP-9、Snail 和Slug蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A) and histogram(B) of expressions of SOX4, ZEB2, MMP-9, Snail and Slug proteins in cells in two groups
综上所述,本研究通过体外实验证实BEA 能抑制TGF-β/ SMAD 信号通路激活,从而抑制下游SOX4、 ZEB2、 MMP9、 Snail 和Slug 蛋白表达,起到调控胃癌细胞的增殖、凋亡、迁移和侵袭的作用,本研究结果为BEA 在胃癌治疗中的应用提供了理论依据。

