北柴胡多糖对D-gal 诱导的HK-2 细胞氧化损伤的保护作用
侯俊宇, 李明慧, 许梦然, 葛俊宏, 申 野, 李 坦, 孙 新
(1.北华大学基础医学院病理生理学教研室,吉林 吉林 132013;2.吉林医药学院药学院生物制药教研室,吉林 吉林 132013;3.北华大学公共卫生学院社会医学与卫生教研室,吉林 吉林 132013)
随着我国人口老龄化速度加快和程度加深,衰老相关疾病的研究已成为热点[1]。随着年龄的增长,以肾单位丢失和肾小球滤过率下降为特征的衰老现象,称为肾脏衰老。肾脏细胞衰老作为肾脏衰老和损伤的早期及晚期阶段的中心过程,在衰老负荷增加的过程中引起肾脏更严重的氧化损伤、炎症和纤维化,造成肾小管上皮增殖明显减少和肾脏修复能力降低,从而导致慢性肾脏疾病的发生[2-5]。研究[6-7]表明:除抑制肾小管间质的损伤、纤维化和炎症外,维持肾脏的氧化应激平衡亦能够延缓慢性肾脏疾病的进展。
北柴胡(Bupleurum Chinense DC.) 主要分布于中国东北地区,北柴胡多糖(Bupleurum chinensepolysaccharides,BCP) 是其主要生物活性成分之一,具有抗炎、抗氧化和抗衰老等药理作用[8-11]。近年来,多种植物多糖被应用于抑制肾脏的氧化应激的研究之中,如青钱子多糖和沙枣多糖等[12-13]。然而,有关BCP 抑制肾脏衰老和改善肾脏氧化应激平衡的机制尚不清楚。本研究通过综合测定BCP 体外抗氧化活性,采用D- 半乳糖(D-galactose,D-gal) 诱导人肾脏近曲小管HK-2细胞构建肾脏氧化损伤模型,探讨BCP 改善肾脏氧化应激环境进而保护肾脏的作用机制,为BCP的进一步开发利用提供理论依据。
1 材料和方法
1.1 细胞、主要试剂和仪器
HK-2 细胞(北京北纳创联生物有限公司)。北柴胡干燥根(长白山特色植物种植基地),乙醇(天津市大茂化学试剂厂),氯仿(天津凯信化学工业有限公司),正丁醇(国药集团化学试剂有限公司),胎牛血清、 高糖DMEM (DMEM-H) 培养基、F-12 细胞培养液、水溶性维生素E、D-gal 和二甲基亚砜(DMSO)(美国Sigma 公司),葡萄糖标准品、Bradford 蛋白检测试剂盒、FRAP 总抗氧化能力检测试剂盒和衰老相关β - 半乳糖苷酶(senescence-associated β -galactosidase,SA- β -gal)染色试剂盒(碧云天生物科技有限公司),抑制与产生超氧阴离子自由基测定试剂盒(南京建成生物工程研究所),MTT (美国Amresco 公司),其他化学试剂均为分析纯。EZ 台式冻干机(美国SIM公司),KQ-250E 超声波清洗器(昆山市超声仪器有限公司),TDL-5-R 低速离心机(上海安亭科学仪器厂),MDF-U4086S -80 ℃超低温冰箱(日本SANYO 公司),Infinite M200 PRO 酶标仪(美国Beckman 公司),MCO-18AI CUVL-PC 二氧化碳培养箱(日本Panasonic 公司),TH4-200 倒置荧光显微镜(日本Olympus 公司)。
1.2 BCP 的提取和纯化
将500 g 柴胡干燥根用体积分数为80% 的乙醇浸泡24 h,过滤后晾干用蒸馏水在80 ℃条件下提取3 次,每次3 h。将提取液过滤并离心,上清液通过减压蒸发浓缩处理,加入3 倍体积的乙醇密封后在4 ℃下沉淀过夜。离心获取沉淀后经过减压蒸发干燥,得到北柴胡粗提取多糖。将干燥的沉淀以5% 比例溶解在蒸馏水中,-80 ℃冷冻后在室温下解冻,12 000 r·min-1离心6 min 后,弃去蛋白后将上清于-80 ℃条件下冻存,经反复冻融至无蛋白沉淀析出;将氯仿和正丁醇分析纯按4∶1 比例配制Sevag 溶液,以糖溶液2 倍体积的比例混合,充分振荡1 h 后4 000 r·min-1离心15 min,回收上层糖溶液,重复操作直至中间层无蛋白析出;最后采用相对分子质量为3 500 的透析袋流水透析24 h,冷冻干燥后得纯化BCP。根据以下公式计算BCP得率[14]: BCP 得率=mBCP/m北柴胡×100%,mBCP为BCP 质量,m北柴胡为原北柴胡干燥根质量。
1.3 苯酚硫酸法测定BCP 多糖含量
采用苯酚硫酸法测定BCP 总糖和葡萄糖含量[15]。取干燥葡萄糖配制浓度为100 mg·L-1的葡萄糖标准液,配制成浓度为0、10、20、40、60、80 和100 mg·L-1葡萄糖溶液各1 mL; 在浓度为100 mg·L-1的BCP 溶液中先后加入15% 三氯乙酸(TCA) 1 mL 和5% TCA 5 mL 并研磨充分,3 000 r·min-1离心后向上清中加入6 mol·L-1盐酸(HCl) 2 mL,水浴加热(96 ℃、2 h) 后用流水冷却至室温,加入2 mL 氢氧化钠(6 mol·L-1) 摇匀,记为样品1;未经处理的100 mg·L-1BCP 溶液为样品2,将样品1、样品2 和不同浓度葡糖糖溶液依次加入6% 苯酚0.5 mL,浓硫酸2.5 mL,充分振荡置于沸水中加热10 min 后再室温静置30 min,于波长490 nm 处检测吸光度(A) 值。以A 值为Y 轴,葡萄糖浓度为X 轴,得到葡萄糖标准曲线,分别将样品1 和样品2 的A 值带入标准曲线方程,所得X 值与BCP 浓度的比值即为BCP 的总糖含量和BCP 的葡萄糖含量。
1.4 BCP 的体外抗氧化活性检测
1.4.1 检测BCP 的羟自由基清除率 首先配制浓度均为6 mmol·L-1的硫酸亚铁(FeSO4)、水杨酸和H2O2溶液,将BCP 和维生素E 分别稀释为不同浓度(50、100、200、400、800 和1 600 mg·L-1),在96 孔细胞培养板中进行操作。实验组:依次加入不同浓度BCP 或维生素E、 FeSO4、 水杨酸和H2O2,每孔50 μL; 对照组: 依次加入不同浓度BCP 或维生素E、 FeSO4、 蒸馏水和H2O2,每孔50 μL;空白组:依次加入蒸馏水、 FeSO4、水杨酸和H2O2,每孔50 μL,按公式计算羟自由基清除率[16]。羟自由基清除率=[1- (A1-A2) /A0] ×100%,A1为不同浓度BCP 或维生素E 加入FeSO4、水杨酸和H2O2后测得的A 值;A2为不同浓度BCP 或维生素E 加入FeSO4、蒸馏水和H2O2后测得的A 值;A0为蒸馏水加入水杨酸、FeSO4和H2O2后测得的A 值。
1.4.2 FRAP 法检测BCP 的总抗氧化能力FRAP 总抗氧化能力检测试剂盒的原理:抗氧化物能够将Ferric-triPyridyltriazine (Fe3+-TPTZ)还原为蓝色的Fe2+-TPTZ,通过测定其变色反应后A 值的大小评估样品中的总抗氧化能力。配制不同浓度(50、100、200、400、800 和1 600 mg·L-1)BCP 和维生素E 溶液,根据FRAP 试剂盒说明书进行操作,最后将各浓度BCP 及维生素E 的A 值带入标准曲线方程进行计算,即可得到BCP 的总抗氧化能力[17]。
1.4.3 检测BCP 的抗超氧阴离子活性 采用抑制与产生超氧阴离子自由基测定试剂盒检测BCP 清除超氧阴离子的能力,当被测样品中含有超氧阴离子抑制剂时,会使反应体系呈现的紫红色变浅,通过以维生素C 为标准,在波长550 nm 处测定样品中的A 值,计算超氧阴离子活性。取浓度为0.15 g·L-1的维生素C 作为标准品,BCP、维生素E 均配制为1、5、10、15、20 和25 g·L-1浓度,配制抗超氧阴离子工作液,将工作液与样品溶液在EP 管中混匀后,37 ℃恒温水浴40 min 后加入显色剂,室温静置10 min,检测其A 值,按照公式计算抗超氧阴离子活性[18]。抗超氧阴离子活性(U·g-1)=(对照A值-测定A值)/(对照A值-标准A值)×标准品浓度(0.15 g·L-1)×1 000 mL×样本测试前的稀释倍数。
1.5 MTT 法检测各组HK-2 细胞增殖率
1.5.1 不同浓度BCP 组HK-2 细胞增殖率 96 孔细胞培养板中DMEM-H/F-12 培养基培养处于对数生长期的HK-2 细胞( 每孔7 000 个细胞,200 μL),分为对照组,25、 50、 100、 200 和400 mg·L-1BCP 组,并设空白组,各组设置6 个平行复孔,在5% CO2、37 ℃恒温培养箱中孵育过夜。处理24 h 后,每孔加入5 g·L-1MTT 20 μL,置于培养箱中孵育4 h 后,弃去上清,加入DMSO(150 μL/孔),摇床混匀后,采用酶标仪在波长490 nm 处检测A 值。根据公式计算各组细胞增殖率,确定BCP 最适作用浓度。细胞增殖率=(A1-A0)/(A2-A0)×100%,A1代表实验组测定的A值,A2代表对照组测定的A 值,A0代表空白组测定的A 值。
1.5.2 不同作用时间不同浓度D-gal 组HK-2 细胞增殖率 96 孔细胞培养板中DMEM-H/F-12 培养基培养处于对数生长期的HK-2 细胞( 每孔7 000 个细胞,200 μL),分为对照组,5、 10、20、40、80 和100 g·L-1D-gal 组,并设空白组,各组设置6 个平行复孔,D-gal 组分别处理6、 12、24 和48 h 后,每孔加入5 g·L-1MTT 20 μL,置于培养箱孵育4 h 后,弃去上清,加入DMSO(150 μL/孔),摇床混匀后,采用酶标仪在波长490 nm 处检测A 值。根据公式(同 “1.5.1”) 计算各组细胞增殖率,确定D-gal 最适作用时间和浓度。
1.5.3 各组HK-2 细胞增殖率 96 孔细胞培养板中DMEM-H/F-12 培养基培养处于对数生长期的HK-2 细胞(每孔7 000 个细胞,200 μL),分为对照组、D-gal 组和不同浓度(25、50、100、200 及400 mg·L-1) BCP+D-gal 组,并设空白组,各组设置6个平行复孔,采用20 g·L-1D-gal 预处理HK-2细胞24 h 后,25、 50、 100、 200 和400 mg·L-1BCP+D-gal 组加入含不同浓度BCP 的完全培养液再处理细胞24 h,每孔加入5 g·L-1MTT 20 μL,置于培养箱中孵育4 h 后,小心吸取上清,每孔加入150 μL DMSO,摇床混匀后,采用酶标仪在波长490 nm 处测定A 值,根据公式(同 “1.5.1”)计算各组细胞增殖率。
1.6 SA-β-gal 染色法观察各组HK-2 细胞染色情况并计算衰老细胞百分率
采用SA-β-gal 染色试剂盒对细胞进行检测。HK-2 细胞分为对照组、 D-gal 组、 BCP+D-gal 组和维生素E+D-gal 组。将HK-2 细胞接种于6 孔细胞培养板(每孔15×104个细胞),正常培养至细胞密度为60%~70%,除对照组外其余各组细胞中加入40 g·L-1D-gal (至终浓度为20 g·L-1)处理24 h,然后BCP 组细胞中加入200 mg·L-1BCP处理,维生素E 组细胞中加入200 mg·L-1维生素E 处理。处理完成后吸去上清液,用PBS 缓冲液(1 mL/孔) 清洗细胞2 次,加入固定液室温固定15 min,PBS 缓冲液清洗3 次(每次3 min),加入染色工作液并将6 孔细胞培养板密封在不含CO2的37 ℃培养箱过夜孵育,荧光显微镜下观察各组HK-2 细胞染色情况。一次计数3 个随机同一视野内SA-β-gal 染色阳性细胞(蓝色) 和所有细胞的数量后分别取平均数(重复操作3 次),衰老细胞百分率为SA-β-gal 染色阳性细胞数与同视野下细胞总数比值的百分率。
1.7 统计学分析
采用SPSS 21.0 统计软件进行统计学分析。BCP 的葡萄糖含量、羟自由基清除率、总抗氧化能力和抗超氧阴离子活性,各组细胞增殖率和衰老细胞百分率均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 BCP 得率和含量
采用水提醇沉法,得到的水溶性粗多糖为深褐色粉末,质量为29.9 g。粗提取水溶性多糖的比重为干料的5.98%。经反复冻融处理并结合Sevag 法脱蛋白后,对纯化BCP 进一步分析其抗氧化活性。
计算并得到葡萄糖标准曲线的线性回归方程y=0.007 8x-0.029 4,R2=0.995 5。当BCP 浓度为100 mg·L-1时,样品1 的A 值为0.43±0.01,根据公式计算,提取的BCP 总糖含量为60.12%±2.01%;样品2 的A 值为0.11±0.02,根据公式计算,BCP 的葡萄糖含量为(17.96±1.93) % 。见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 BCP 的抗氧化活性
2.2.1 BCP 的羟自由基清除率 50~1 600 mg·L-1BCP 和维生素E 的羟自由基清除率呈浓度依赖性增加。与相同浓度维生素E 组比较,不同浓度BCP 组羟自由基清除率明显升高(P<0.05)。见图2。

图2 不同浓度BCP 组和维生素E 组羟自由基清除率Fig.2 Hydroxyl radical scavenging rates in different concentrations of BCP groups and vitamin E groups
2.2.2 BCP 的总抗氧化能力 FRAP 标准曲线为y=0.000 5x+1.125 3,R2=0.993 9,将不同浓度BCP 组的A 值带入标准曲线计算,BCP 和维生素E在50~1 600 mg·L-1范围内的总抗氧化能力呈浓度依赖性增强。与相同浓度维生素E 组比较,不同浓度BCP 组总抗氧化能力明显增强(P<0.05)。见图3。

图3 不同浓度BCP 组和维生素E 组FRAP 标准曲线(A)和总抗氧化能力(B)Fig.3 FRAP standard curve(A) and total antioxidant capacities(B) in different concentrations of BCP groups and vitamin E groups
2.2.3 BCP 的抗超氧阴离子活性 1~25 g·L-1BCP 和1~25 g·L-1维生素E 的抗超氧阴离子活性呈浓度依赖性增加。与相同浓度维生素E 组比较,不同浓度BCP 组抗超氧阴离子活性明显增加(P<0.05)。见图4。

图4 不同浓度BCP组和维生素E组抗超氧阴离子活性Fig.4 Anti-superoxide anion activities in different concentrations of BCP groups and vitamin E groups
2.3 各组HK-2 细胞增殖率
处理HK-2 细胞24 h 后,与对照组比较,25~400 mg·L-1BCP 组细胞增殖率呈浓度依赖性升高(P<0.05),且200 mg·L-1BCP 组HK-2 细胞增殖率最高。见图5。
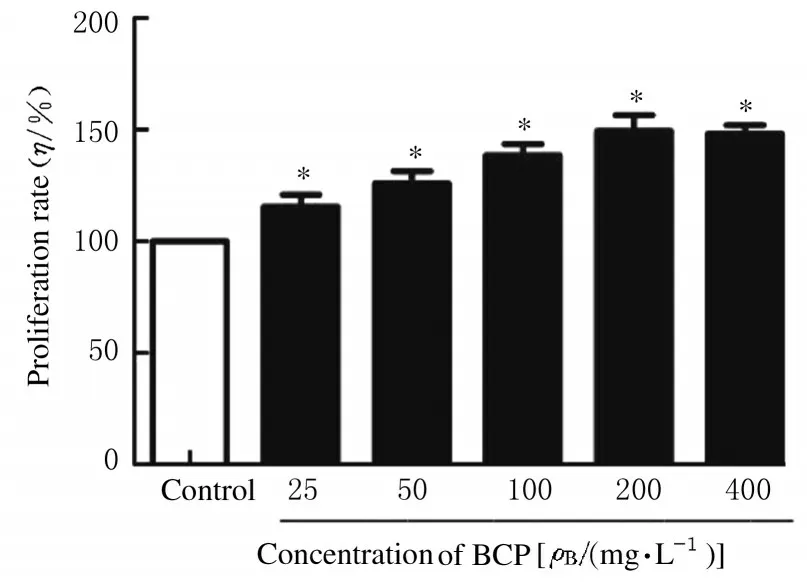
图5 不同浓度BCP 组HK-2 细胞增殖率Fig.5 Proliferation rates of HK-2 cells in different concentrations of BCP groups
加入5~100 g·L-1D-gal 分别处理HK-2 细胞6、12、24 和48 h 后,与对照组比较,不同浓度D-gal组HK-2 细胞增殖率明显降低,且呈时间-浓度依赖性降低(P<0.05),D-gal 浓度为20 g·L-1、作用时间为48 h 时,细胞增殖率降低至对照组的64.77%。本研究选用20 g·L-1D-gal 处理48 h 作为D-gal 诱导细胞损伤的条件。见表1。
表1 不同作用时间不同浓度D-gal 组HK-2 细胞增殖率Tab.1 Proliferation rates of HK-2 cells in different concentrations of D-gal groups at different time (n=3,±s,η/%)

表1 不同作用时间不同浓度D-gal 组HK-2 细胞增殖率Tab.1 Proliferation rates of HK-2 cells in different concentrations of D-gal groups at different time (n=3,±s,η/%)
*P<0.05 compared with control group.
Group Control D-gal(g·L-1)5 10 20 40 80 100 Proliferation rate of HK-2 cells(t/h) 6 100.00±2.97 93.59±3.94*89.97±1.64*85.82±2.18*81.03±2.79*75.13±2.16*69.64±3.20*12 100.00±2.08 92.39±1.88*87.59±1.35*85.92±1.68*81.01±1.24*71.06±0.93*64.30±1.27*24 100.00±0.02 90.87±2.02*82.72±2.27*74.41±1.57*68.42±1.60*58.92±0.78*53.36±1.09*48 100.00±0.04 85.28±3.54*75.90±2.04*64.77±1.31*58.24±3.44*37.08±1.07*27.81±0.81*
与对照组比较,D-gal 组HK-2 细胞增殖率明显降低(P<0.05); 与D-gal 组比较,100~400 mg·L-1BCP+D-gal 组HK-2 细胞增殖率呈浓度依赖性升高(P<0.05 或P<0.01),且200 和400 mg·L-1BCP 对D-gal 诱导后的HK-2 细胞损伤保护作用最明显,考虑减弱药物毒性作用的因素,因此选择200 mg·L-1作为BCP 后续相关研究的处理剂量。见图6。

图6 各组HK-2 细胞增殖率Fig.6 Proliferation rates of HK-2 cells in various groups
2.4 各组HK-2 细胞中衰老细胞百分率
与对照组比较,D-gal 组细胞中SA-β-gal 染色阳性细胞数明显增多,衰老细胞百分率明显升高(P<0.05);与D-gal 组比较,BCP+D-gal 组和维生素E+D-gal 组细胞中SA-β-gal 染色阳性细胞数明显减少,衰老细胞百分率明显降低(P<0.05)。见图7 和8。

图7 各组HK-2 细胞中衰老细胞形态表现Fig.7 Morphology of senescent cells of HK-2 cells in various groups
3 讨 论
氧化应激是指机体受到多因素的有害刺激(衰老过程) 时,体内高活性分子如活性氧簇(reactive oxygen species,ROS) 等产生过多,氧化系统产生大量自由基如超氧阴离子、H2O2、羟自由基和脂质过氧化物,自由基不断增加的累积趋势以及自由基清除机制的障碍或减弱导致细胞的抗氧化能力降低,进而引起不同程度的细胞毒性反应,造成DNA、蛋白质和膜脂质的过氧化,使细胞功能受损和活力减退,最终导致组织损伤,引起相关疾病[19-22]。本研究通过提取BCP,测定BCP 的体外抗氧化活性,同时利用20 g·L-1D-gal 构建细胞氧化损伤模型,采用SA-β-gal 染色实验探讨BCP对D-gal 诱导HK-2 细胞氧化损伤的保护作用。
本研究采用水提醇沉法提取BCP,粗提取多糖得率为5.98%,与卢娇娇[23]和TONG 等[11]的研究结果(5.6% 和6.3%) 相近;通过Seavg 法得到纯化BCP,葡萄糖含量为17.96%±1.93%,略高于关皎等[24]研究结果(15.76%±0.04%);检测羟自由基清除率、总抗氧化能力和抗超氧阴离子活力的体外抗氧化实验结果显示:同等浓度条件下,BCP 的抗氧化水平均明显高于维生素E。

图8 各组HK-2 细胞中衰老细胞百分率Fig.8 Percentages of senescent cells of HK-2 cells in various groups
研究[25-26]显示:D-gal 能够被半乳糖氧化酶分解成过氧化氢和醛糖,最终生成超氧阴离子。本研究结果表明:BCP 具有较明显的抗氧化活性和促进细胞增殖能力,与相关研究[27-28]结论一致。同时,本研究结果显示:BCP 在明显增强HK-2 细胞活性和促进细胞增殖的基础上,进一步改善了D-gal 处理48 h 模拟的氧化应激环境,保护HK-2 细胞维持细胞正常活性及生理功能。衰老状态的特征在于大量溶酶体蛋白的上调和溶酶体含量的增加,SA-β-gal 活性被用作替代标记物,用于检测衰老细胞的溶酶体含量[29]。本研究结果显示:BCP 具有较明显的抗衰老作用。细胞在衰老过程中会不断产生ROS 并引起积聚,而过多的ROS 破坏氧化应激平衡,影响细胞正常的生理结构及功能[30],因此本研究推测:BCP 通过延缓细胞衰老,恢复细胞活性,减缓ROS 对细胞所产生的损害,进而对氧化应激所致的HK-2 细胞损伤发挥保护作用。
研究[31]表明: BCP 在体内实验中通过抑制p53 和p16 信号通路的激活改善了D-gal 诱导衰老小鼠的肾脏指数下降。TONG 等[11]研究发现:对从BCP 中分离出的一种糖添加硫酸基团修饰,其抗氧化能力明显提升,抑制了过氧化氢诱导的小鼠肺内皮细胞的衰老。NEZU 等[32]研究表明:转录因子Nrf2 的激活,在保护肾脏减轻氧化损伤的过程中发挥着至关重要的作用。但是BCP 在延缓肾脏衰老的过程中的作用机制仍需进一步研究。
本研究证实:BCP 具有较强体外抗氧化活性,能够通过抗衰老作用抑制D-gal 诱导的HK-2 细胞氧化损伤。本研究为探索BCP 抑制氧化应激的作用机制奠定了理论基础,为长白山特色药物北柴胡的开发和利用提供了参考依据。

