TiO2改性的CaCO3热化学储热的反应性能
徐钿昕,田希坤,闫 君,叶 强,赵长颖
(上海交通大学工程热物理研究所,上海 200240)
随着人们日益增长的美好生活需求,我国能源消耗日益增多,对清洁能源的研究也得到迅速发展[1]。然而,清洁能源的不连续性与波动性使其发电难以实现稳定利用[2],不利于我国早日实现碳达峰、碳中和。而热能储存(TES)与清洁能源的耦合可有效缓解其间歇性和不稳定性[3]。
TES常见方法有显热储热、相变储热和热化学储热[4],而热化学储热具有高储能密度和广泛的储/放热温度区间[5]。常见的热化学储热材料中,CaCO3/CaO(CaCO3⇌CaO+CO2,=±178 kJ/mol)[6]在高温热化学储热领域极具应用前景[7],有高储能密度、来源广泛、价格低廉、安全无污染等优点。
关于CaCO3/CaO 应用于碳捕集、重整制氢领域的研究已经非常深入[8-9],但二者反应工况与储热领域存在显著差异,不同工况的反应性能被比较研究[10-12]。据研究,影响CaCO3/CaO反应的微观因素有颗粒粒径与孔隙分布[12-13],宏观因素有反应温度、气氛、时间[11-12,14]。不同的钙基前驱体被用于制备CaCO3储热材料,以获得更发达的孔隙[15];热预处理、酸预处理、水化处理和其他方法,也被用以提高CaCO3/CaO 的反应活性和循环稳定性[16-17]。此外,对石灰岩、大理石、白云石、方解石、白垩、电石渣和其他富含CaCO3物质的反应特征也进行了比较[14,16,18]。多数研究者选择添加惰性材料如,以起到抗烧结作用,提升循环稳定性与反应活性。
2001年,AIHARA等[29]通过粉末法和酒精盐法将CaTiO3作为惰性骨架来改性CaCO3储热材料,起到了抗烧结、提高循环反应稳定性的作用。然而,其碳酸化过程反应气氛为20%(体积分数)CO2和80%(体积分数)N2,与目前CaCO3/CaO 热化学储热体系研究中的常用气氛相差巨大,且两种制备方法中CaCO3和CaTiO3的掺杂比例都仅为1∶1,缺乏对最佳掺混比例的实验研究。
总体而言,目前关于TiO2作为掺杂材料应用于CaCO3储热领域的研究仍严重缺失。因此,本工作对TiO2掺杂改性进行了系统的实验研究,以探讨不同TiO2掺杂比例对材料循环稳定性的影响,并在热化学储热的工况条件下,对储放热反应过程进行了实验分析。
1 研究方法
1.1 材料制备
通过搅拌混合制备了掺杂TiO2的CaCO3复合储热材料。首先,配备1 mol/L 的CaCO3[≥99%,生工生物工程(上海)股份有限公司]悬浮液,按一定的摩尔比例将掺杂材料TiO2(AR,上海阿拉丁生化科技股份有限公司)加入到溶液中。在超声波清洗器中以40 kHz 超声30 min 后,将混合溶液以500 r/min 的转速进行磁力搅拌,保持溶液温度为60 ℃,直至蒸干。最后,在真空干燥箱中80 ℃干燥4 h,对样品进行研磨得到复合储热材料。制备过程所用仪器如表1所示,对于通过搅拌混合制备的复合储热材料,样品命名如表2所示。

表1 材料制备过程所用仪器Table 1 Instruments used in the material preparation process

表2 样品名称及掺杂比例Table 2 Samples’names and doping ratio
1.2 测试与计算方法
在同步热分析仪(STA8000,PerkinElmer)中进行复合材料的循环与储、放热特性研究。为减小仪器误差所造成的影响,每次在坩埚内放置约9 mg的样品。对纯CaCO3与不同TiO2掺杂比例的复合储热材料的循环性能进行测试,探究不同材料的循环反应活性与稳定性。设置储热温度为800 ℃,放热温度为750 ℃,升温、降温速率为40 ℃/min,储热、放热反应停留时间均为5 min。反应转换率计算方法如式(1)所示
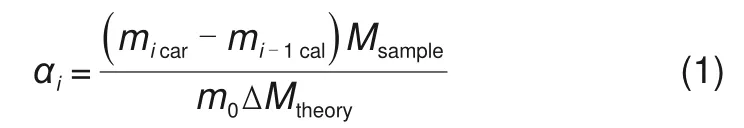
其中,i为循环反应次数(i≥1);αi为循环的反应转换率;micar和mical分别为碳酸化反应(放热过程)和煅烧反应(储热过程)后的样品质量;m0为循环开始时的样品初始质量;Msample为样品的理论摩尔质量;ΔMtheory为样品的理论失重摩尔质量。
进行放热实验时,在同步热分析仪中先将样品在N2气氛中(50 mL/min)快速升温到800 ℃,停留5 min 保证样品完全分解,然后快速降温至450~800 ℃,待样品温度稳定后,切换气流至CO2气氛(50 mL/min)进行碳酸化反应,观察纯CaCO3与掺TiO2的复合储热材料在不同温度下的放热过程。
在储热实验中,将样品放入同步热分析仪中,分别在N2与CO2气氛下以10 ℃/min 的速率进行升温,探究纯CaCO3与复合储热材料在不同气氛下的非等温储热过程。同样,在同步热分析仪中以40 ℃/min的速率分别快速升温至700 ℃(N2气氛)与900 ℃(CO2气氛),探究两种气氛下的等温储热过程。储热过程的反应转换率计算方法如式(2)

其中,t为反应时间;αt为反应转换率;m0为反应开始时样品的初始质量;mt为t时刻样品的质量;Δmtheory为样品的理论失重质量。
2 结果与讨论
2.1 最佳掺杂比例
2.1.1 循环稳定性
图1 为多种不同TiO2掺杂比例的复合储热材料15 次循环测试曲线。由图1 可知,复合储热材料的反应转换率始终高于CaCO3-TiO2-0。其中,CaCO3-TiO2-2.5展现出了最佳的反应活性和循环稳定性。在初次反应中,CaCO3-TiO2-2.5的反应转换率是CaCO3-TiO2-0 的1.29 倍,15 次循环后其转换率仍为CaCO3-TiO2-0 的1.65 倍。且经历15 次循环后,CaCO3-TiO2-2.5 的稳定性仍保有57.23%,而CaCO3-TiO2-0 的反应转换率仅为初始反应的44.96%。
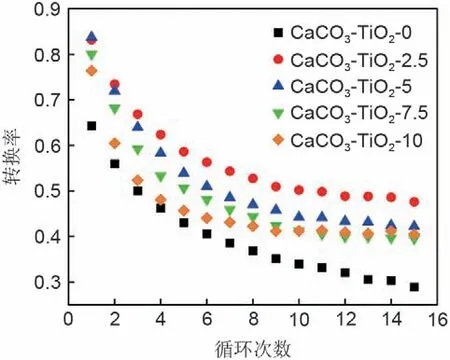
图1 不同TiO2掺杂比例下复合储热材料的循环曲线Fig.1 Cyclic curves of composite heat storage materials with different TiO2-doping ratios
图2 为CaCO3-TiO2-2.5 在15 次循环前后放大50000 倍的SEM 图像,可明显观察到循环后样品的微观表面存在明显烧结现象,说明在反应过程中材料已经发生团聚,因而材料的反应活性随循环次数的增加而衰减。此外,CaCO3-TiO2-2.5颗粒的微观表面可观察到细小的TiO2微粒,且在多次循环后,TiO2微粒一定程度上阻碍了CaCO3颗粒的团聚,避免CaCO3颗粒快速团聚成缺乏孔隙的大颗粒,保护了碳酸化反应过程中的CO2传质通道。在该掺杂比例(100∶2.5)下,TiO2对循环过程中材料烧结与颗粒团聚起到了良好的抵抗作用,因而CaCO3-TiO2-2.5具有更好的循环稳定性。

图2 CaCO3-TiO2-2.5循环前后的SEM图像Fig.2 SEM images of CaCO3-TiO2-2.5 before and after cycles
2.1.2 分析测试与表征
图3 为纯CaCO3和复合材料CaCO3-TiO2-2.5的X 射线衍射图谱(D8 ADVANCE Da Vinci)。在样品CaCO3-TiO2-2.5的衍射图谱中,可搜索到CaCO3(PDF# 85-1108)与TiO2(PDF# 73-1764)的衍射峰,说明复合材料中存在了混合的CaCO3与TiO2物相。

图3 CaCO3和CaCO3-TiO2-2.5的XRD图谱Fig.3 XRD patterns of CaCO3 and CaCO3-TiO2-2.5
对CaCO3和CaCO3-TiO2-2.5 进行了比表面积测试(Autosorb-IQ3),结果如表3 所示。根据测试结果,发现CaCO3-TiO2-2.5 具有更高的比表面积和更大的孔容、孔径,因而在反应过程中,复合材料中的CO2传质通道要优于纯CaCO3,更有利于储放热过程中CO2与材料的接触或脱离。

表3 CaCO3和CaCO3-TiO2-2.5的BET测试数据Table 3 BET test data of CaCO3 and CaCO3-TiO2-2.5
图4为物理混合法制备过程中CaCO3-TiO2-2.5样品的粒径分布对比图(Microtrac S3500)。可发现混合后,复合材料的粒度峰值为11.23 μm,与TiO2的粒度左峰值12.39 μm 接近,但远小于CaCO3的峰值(22.72 μm)。通过不断的机械搅拌混合后,CaCO3-TiO2-2.5 中未显现出TiO2的右粒度峰值(269.7 μm),且最小粒度仅为0.53 μm,说明该混合法能够在一定程度上削减材料的粒径,有利于在后续反应过程中起到抗烧结、抗团聚的作用。
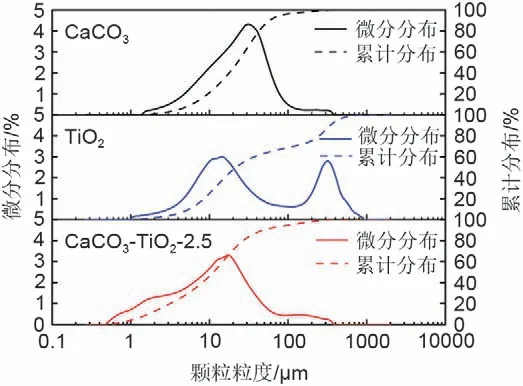
图4 混合前后样品的粒度分布图Fig.4 Particle size distribution of samples before and after mixing
2.2 放热过程分析
2.2.1 热重结果分析
由图5(a)可知,对于完全分解为CaO 的纯CaCO3材料,碳酸化温度越高,反应5 min后的样品转换率越高,快速反应阶段所占比例也越大。在碳酸化温度为600 ℃时,反应速率最快。低温下的碳酸化过程中(450~600 ℃),在延长反应时间后,样品进入了缓慢的慢速反应阶段,反应2 h 后,样品的整体转换率最终基本趋于一致(表4)。

图5 不同温度下的碳酸化过程Fig.5 Carbonation processes at different temperatures
对CaCO3-TiO2-2.5 样品,碳酸化过程的初始5 min内,750~450 ℃温度下的反应转换率随温度降低而下降,而800 ℃下的反应转换率要略低于750 ℃,说明在改性过程中,复合材料的反应特性发生了轻微的变化。但在整个碳酸化反应过程中,700~800 ℃反应温度下,复合材料具有比纯CaCO3更高的反应转换率(表4)。在高温区,反应转换率越高,即碳酸化过程越完全,对提高后续储热、放热过程的反应活性更加有益,这也是CaCO3-TiO2-2.5循环活性高的原因之一(2.1.1节)。
2.2.2 热流结果分析
对碳酸化过程的热重数据及热流曲线进行计算,结果如表4 所示。对纯CaCO3与CaCO3-TiO2-2.5,在750 ℃碳酸化反应时,放热/储热焓值的比值均为最高,说明750 ℃是一个合适的碳酸化过程反应温度。对储热材料进行TiO2掺杂改性后,发现复合材料的储、放热的焓值均有所下降,这是由储热材料引进惰性改性材料后造成的有效反应物质的减少所导致的。
根据实验结果可知,碳酸化过程的放热主要集中在快速反应阶段。对低温碳酸化反应(450~600 ℃),发现反应由快速阶段向慢速阶段的转变,是限制反应放热的重要因素。而根据表4 统计数据,低温区的快速反应阶段所占比例较高温区有明显下降。因此,即便CaO 的碳酸化过程具有广泛的反应温区(从室温到800 ℃),但为获得更多的可用热能和更高的反应效率,650~800 ℃是较好的放热反应温度区间。

表4 不同温度下碳酸化过程的反应特性Table 4 Reaction characteristics at different carbonation temperatures
2.3 储热过程分析
2.3.1 非等温分解
由图6可知,相比N2气氛,在CO2气氛中复合材料的分解过程更迅速,反应时间更短。在N2气氛下,CaCO3-TiO2-2.5 的分解过程仅略快于纯CaCO3;但 在CO2气氛中,CaCO3-TiO2-2.5 的起始分解温度(870.92 ℃)低于纯CaCO3的897.16 ℃[图6(b)],说明TiO2能够降低CaCO3在CO2气氛下的储热温度。在实际的储热反应系统中,由于储热材料的大量堆积,CaCO3分解产生的CO2气体很难及时从反应体系中排出,因而CO2极易分散于传热传质通道中,导致材料周围的气氛近乎于CO2气氛。因此,降低储热材料在CO2气氛中的分解温度也具有重要意义。

图6 非等温分解过程(10 ℃/min)Fig.6 Non-isothermal decarbonation process at 10 ℃/min
2.3.2 等温分解
根据图6可知,N2气氛中,CaCO3与复合材料的分解温度区间为600~780 ℃,而CO2气氛中,分解温度区间分别为890~925 ℃(CaCO3)和870~900 ℃(CaCO3-TiO2-2.5)。因此,选择N2气氛700 ℃和CO2气氛900 ℃作为等温分解的反应温度,图7为CaCO3与CaCO3-TiO2-2.5 在N2及CO2气氛下的等温分解过程。可明显发现在N2气氛下,两种材料几乎同时开始发生分解反应,但CaCO3-TiO2-2.5的分解速率要明显快于CaCO3,显现出了相对优秀的低温分解能力。而在CO2气氛下,虽然CaCO3-TiO2-2.5 的反应起始时间更早,但二者的反应速率基本相同。
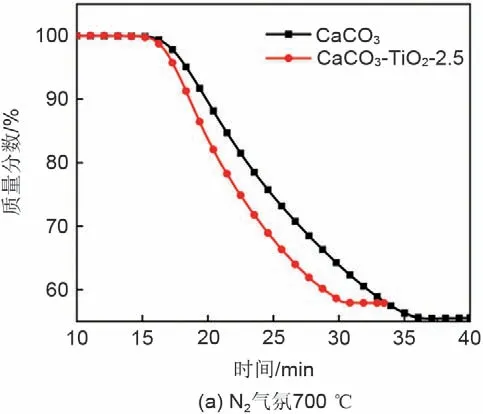

图7 等温分解过程Fig.7 Isothermal decarbonation process
3 结 论
本文通过物理混合法制备了掺杂TiO2的CaCO3/CaO 复合储热材料,系统性地研究了TiO2掺杂对CaCO3/CaO 反应体系的循环稳定性、放热过程、储热过程的影响,主要结论如下。
(1)多种不同TiO2掺杂浓度的复合储热材料均改善了CaCO3的循环反应活性,其中最佳掺杂比例为100∶2.5(CaCO3∶TiO2,摩尔比)。15次循环后,CaCO3-TiO2-2.5的转换率为CaCO3-TiO2-0的1.65倍,反应稳定性仍保留有57.23%,展现出了最佳的反应活性和循环稳定性。
(2)对完全分解为CaO 的纯CaCO3材料,碳酸化温度越高,反应5 min 后的样品转换率越高,快速反应阶段所占比例越大。对分解的CaCO3-TiO2-2.5 样品,800 ℃下碳酸化过程的反应转换率略低于750 ℃,其余温度下的反应换转率随温度的下降而降低,同样遵循纯CaCO3材料的反应规律。在700~800 ℃,复合材料具有比纯CaCO3更高的反应转换率。
(3)对纯CaCO3与CaCO3-TiO2-2.5,由于惰性材料的改性造成储热材料中有效反应物质的减少,CaCO3-TiO2-2.5 的储、放热焓值均有所下降。但在750 ℃碳酸化温度下,两种材料的放热/储热比值均为最高。为获得更多的可用热能和更高的反应效率,700~800 ℃高温区是CaCO3/CaO 反应体系较好的放热反应温度区间。
(4)在N2气氛非等温分解过程中,TiO2对CaCO3的分解温度与反应速率无明显改善作用,但在CO2气氛中,TiO2将纯CaCO3的起始分解温度从897.16 ℃降低至870.92 ℃,对CaCO3/CaO 反应体系的实际应用具有重大意义。
(5)700 ℃N2气氛下的等温分解过程,CaCO3-TiO2-2.5的分解速率明显快于CaCO3。而在900 ℃CO2气氛下,二者的反应速率基本相同,但CaCO3-TiO2-2.5的反应起始时间更早。

