废磷酸铁锂正极材料资源化回收工艺
王子璇,李俊成,李金东,易 娟,石 霖,吴 旭
(1华中科技大学环境科学与工程学院,湖北 武汉 430074;2湖北华德莱节能减排科技有限公司,湖北 武汉 430070)
1997 年,Padhi 等[1]首次报道橄榄石结构的磷酸铁锂可以作为锂离子电池的正极材料,磷酸铁锂具有170 mA·h/g的理论比容量和3.5 V的对锂充电平台,与传统锂离子电池材料相比,具有原料来源广泛、安全性能突出、循环性能好、热稳定性好、成本低、无环境污染等特点,是动力锂电池的理想材料[2-3]。我国是世界上最大的锂离子电池生产国,铁锂电池在国内电动汽车的市场占有率约为45%左右[4-6]。锂离子电池经过500~2000次循环充放电后,电池内部结构会发生不可逆的改变,会堵塞Li+扩散的通道,最终导致锂离子电池的失活报废[7-8]。
虽然磷酸铁锂电池是一种绿色能源,不含有镉、镍、铅等有毒重金属,但是如不妥善处理,仍会造成严重的环境问题[9-10]。目前废磷酸铁锂电池回收的研究主要集中在正极材料上[11]。放电完全的锂离子电池中锂元素主要存在于电池的正极,同时在电池生产过程中产生的正极废料也有重要的回收价值[12]。因此对磷酸铁锂电池中正极废料的处理工艺研究是磷酸铁锂电池及其生产废料的回收与资源化的关键问题[13]。目前对废正极活性物质的回收的主流工艺为湿法工艺[14-15],主要思路为将废料中的金属离子浸出,然后通过分步沉淀分离转化为纯度较高磷酸铁、氢氧化铁、碳酸锂、磷酸锂等工业原料。
按照湿法浸出使用的酸的种类可以分为无机酸浸出体系和有机酸浸出体系。无机酸主要包括H2SO4[16-17]、HNO3[18]和HCl等。Li等[19]使用0.3 mol/L硫酸和过氧化氢在60 ℃浸出2 h实现选择性浸出锂离子。Wang等[20]在600 ℃灼烧处理后使用4 mol/L盐酸实现铁离子和锂离子的同时浸出。有机酸主要有CH3COOH、草酸、柠檬酸和甲基磺酸等。Yang等[21]在0.8 mol/L CH3COOH,6% H2O2,固液比120 g/L 条件下,锂的浸出回收率可达95.05%;Li等[22]在草酸浓度为0.3 mol/L,温度为80 ℃,反应时间为60 min,固液比为60 g/L的条件下,有效地从LiFePO4中析出FeC2O3·2H2O;Li 等[23]在添加柠檬酸和过氧化氢的条件下球磨2 h 选择性浸出锂离子,在添加柠檬酸和水的条件下球磨8 h 实现铁离子和锂离子的全部浸出。Yadav 等[24]以甲基磺酸(MSA)、对甲苯磺酸(TSA)等弱有机酸为原料,使锂的浸出率达95%。
目前湿法工艺存在的问题为工艺流程较长,影响因素较多,产生大量废酸碱溶液,造成二次污染,增加后续处理难度,成本高[25]。使用磷酸体系浸出[26],以磷酸铁和磷酸锂形式回收金属元素的方法可以大幅度减少混合酸的产生,但是由于磷酸根影响磷酸铁锂的溶解平衡,使铁离子和锂离子的浸出率偏低,需要添加浸提剂和球磨、涡流[27-28]等方式提高金属离子的浸出率,将进一步提高药剂成本、设备成本和电力成本。
在当前湿法工艺的基础上,本研究提出了一套采用固相电解技术的废磷酸铁锂正极废料的回收与资源化工艺路线,工艺流程如图1所示。本工艺采用磷酸体系,全程没有引入其他酸根,无废水产生,通过电解方法提高磷酸体系中锂离子的浸出率,然后通过氨水调节溶液pH进行铁与锂的分离,分步沉淀法制备二水合磷酸铁与磷酸锂,最终剩余废液采用蒸发结晶获得副产物磷酸二氢铵,实现磷酸铁锂废料的高效、绿色、经济回收。

图1 磷酸铁锂废料处理回收工艺流程Fig.1 Process flow diagram of lithium iron phosphate waste treatment and recovery
1 材料与方法
1.1 样品与试剂
实验所用的磷酸铁锂废料来自湖北金泉新材料有限责任公司,为已与铝箔分离的正极活性物质。用王水消解磷酸铁锂废料,然后通过电感耦合等离子体原子发射光谱(ICP-OES)测定消解液中锂离子和铁离子浓度,以分析磷酸铁锂废料中铁元素和锂元素的含量。王水和磷酸铁锂废料的液固浓度为120 mL/g,消解温度为90 ℃,消解时间为2 h。测得磷酸铁锂废料中锂的质量分数为4.0%,铁的质量分数为29.2%。
实验中负载磷酸铁锂废料的电极为多孔碳毡电极,作为多孔阳极,孔隙率为90%,横向电阻率为15 Ω·mm,纵向电阻率为5 Ω·mm。
实验中所用的化学试剂均为分析纯,并采用去离子水配置溶液。
1.2 实验原理
磷酸为电解液,电解器如图2所示。电解过程的阳极可能发生的反应如下
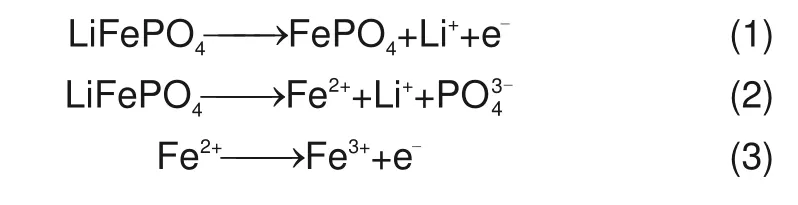

图2 电解器Fig.2 Schematic diagram of electrolyzer
采用ICP-OES 测定电解液中锂离子和铁离子的浓度,进而通过下式计算锂离子和铁离子的浸出率。

式中,η为金属的浸出率,%;C为金属离子的质量浓度,g/mL;V为电解液的体积,mL;ω为磷酸铁锂废料中相应金属的质量分数,%;m为电极上负载的磷酸铁锂废料的质量,g。
通过氨水调节过滤后电解液的pH 进行分布沉淀实现铁锂分离,在加热条件下沉淀二水合磷酸铁,过滤后再通过氨水进一步调节滤液pH,沉淀磷酸锂。测定沉淀前后溶液中铁离子和锂离子的浓度,计算金属回收率。
1.3 实验方法
1.3.1 循环伏安测试
首先将研磨后的磷酸铁锂废料和PTFE乳液黏结剂加入50%酒精中,超声30 min 使固体分散制成浆料。磷酸铁锂废料和PTFE 的质量比为3∶1,液固比为40 mL/g。将制成的浆料滴加到玻碳电极表面,使用红外灯烘烤30 min 使其干燥为工作电极。参比电极为饱和甘汞电极(0.242 V,vs.NHE),铂片电极为对电极。循环伏安测试时所用的电解液为1.0 mol/L 磷酸,在室温下进行测试,扫速为100 mV/s。
1.3.2 电解实验
用多孔碳毡电极负载磷酸铁锂废料进行电解实验。电极制备流程如下:首先用研钵研磨废料,加水搅拌制成浆料,用大小为10 mm×20 mm×3 mm的碳毡电极浸泡至浆料中10 s后取出烘干,制得工作电极,对电极为不锈钢电极,电解液体积为30 mL。电解时,负载磷酸铁锂废料的碳毡电极为阳极,不锈钢对电极为阴极。电解在室温下进行。
1.3.3 化学沉淀实验
将固液分离后的电解液进行化学沉淀实验。首先使用氨水将电解液pH 调节至1.5~2.0,在一定温度下沉淀获得二水合磷酸铁,反应结束后抽滤得到沉淀和滤液,分别测定沉淀前后溶液中铁离子和锂离子的浓度以计算铁离子的回收率和锂、铁两种离子的分离率。在沉淀二水合磷酸铁后的滤液中添加氨水将pH 调节至碱性获得磷酸锂沉淀,测定剩余溶液中锂离子的浓度,计算其回收率。最后将滤液蒸发结晶获得磷酸二氢铵。
2 结果与讨论
2.1 磷酸铁锂废料的电化学特性
通过循环伏安测试分析磷酸铁锂废料在磷酸电解液中的电化学性质,测试结果如图3所示。图中虚线为未涂覆磷酸铁锂废料的玻碳电极基底的测试曲线,实线为涂覆磷酸铁锂废料后的测试曲线。图3(a)为在-0.76~2.24 V(vs.NHE)电压范围内进行循环伏安扫描的结果,可以看出工作电极上存在明显的氧化还原反应,且反应随着循环圈数的增加逐渐减弱。图3(b)中先在-0.76~1.24 V(vsNHE)电压范围内进行扫描,此时阳极区未出现明显的氧化峰,原来阴极区的还原峰也未出现。在小电压范围的扫描测试结束后,仍使用原电极进行测试,此时重新将扫描的电压范围扩大至-0.76~2.24 V(vs.NHE),发现氧化峰和还原峰又再次出现。该测试结果表明,在1 mol/L 的磷酸电解液中,磷酸铁锂废料中的Fe2+可以在大于1.24 V时发生氧化反应转化为Fe3+[29-30],阳极区发生的电化学反应如式(1)所示,且部分氧化产物会残留于电极上,但随着反应的循环进行逐渐脱离电极,此反应的发生加速了废料中锂离子的溶出。
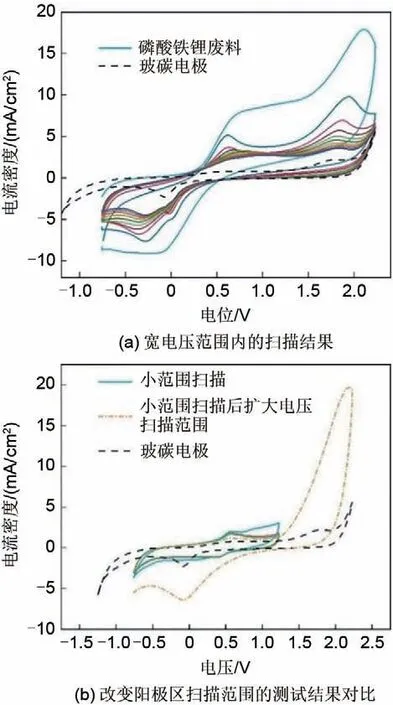
图3 磷酸铁锂废料的循环伏安测试图(电位,vs.NHE)Fig.3 Cycle voltammogram test of waste lithium iron phosphate(potential,vs.NHE)
2.2 磷酸铁锂废料的电解浸出规律
采用磷酸体系电解磷酸铁锂废料的过程中,本文主要考察了电解电压、磷酸电解液浓度以及电解前浸泡时间对锂离子和铁离子的浸出率的影响。
2.2.1 电解电压对废料浸出率的影响
在负载磷酸铁锂废料的多孔阳极和不锈钢阴极之间施加不同的电压进行恒压电解实验。磷酸电解液浓度为0.6 mol/L,测试时间为1 h。图4 为在不同电压下恒压电解的电流变化和电量变化的对比。从图4(a)中电流变化结果可以看出,从1.0 V 到3.0 V,电解浸出过程中的电流呈增大趋势,不同电压下的电解电流在电解时间大于1000 s 后均趋于稳定。将图4(a)中的电流进行积分,得到不同电压下恒压电解的电量变化,积分结果见图4(b)。图4(b)中电量随时间变化的后期,虚线部分呈一定斜率的直线,这与图4(a)中电解后期的稳定电流相对应,电流趋于稳定是由于工作电极上的活性物质已经消耗完全,所以可以假设这一区域内的电流为整个恒电压电解过程中的背景电流。对图4(b)中虚线部分进行线性拟合,以线性拟合得到的斜率作为测试电极的背景电流,其为除废磷酸铁锂正极活性物质被氧化之外的电化学反应,将图4(a)中的电流数据扣除相应的背景电流后再次积分,将积分后的电量除以测试电极上磷酸铁锂废料的负载量,即得到图4(c)中修正后的电量变化结果。从修正后的电量变化结果可以看出,单位质量的磷酸铁锂废料的电量消耗随着电解电压的升高而变大,在电解电压大于2.5 V 后趋于稳定。图4(d)为单位质量的磷酸铁锂废料在不同电压下恒压电解的最终积分电量。左侧为总的积分电量,右侧为扣除背景电流的积分电量。可以看出与2.5 V 恒压电解的结果相比,3.0 V恒压电解总的积分电量变大,但是扣除背景电流后积分电量没有明显变化。此结果表明2.5 V下恒压电解可能在较低能耗的条件下实现较好的电解效果。
图5为不同电压下电解锂离子和铁离子的浸出率。与图4(c)中扣除背景电流后的电量变化类似,锂离子浸出率随着电解电压的增加而变大,电解大于2.5 V 后趋于稳定,且浸出率超过90%。铁离子的浸出率呈先变小再变大的趋势。推测原因可能为部分磷酸铁锂可以直接向磷酸中溶解,而电解的氧化产物磷酸铁相对难以溶解。这使得1.0~2.0 V 电压变化范围内铁离子的浸出率降低,同时在进一步提高电解电压时磷酸铁更加容易溶出,这使得2.0~3.0 V 电压变化范围内的铁离子浸出率变高。

图4 电解电压对电解电流和积分电量的影响Fig.4 Effects of electrolysis voltage on electrolysis current and integrated electricity(a)current change during electrolysis,(b)electricity obtained by direct integration of electrolysis current,(c)electricity in b is corrected with background current and waste load quality,(d)comparison of final power consumption and power consumption after background deduction
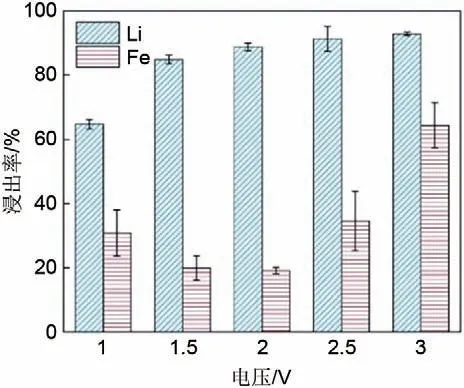
图5 不同电压下电解锂离子和铁离子的浸出率Fig.5 Leaching rates of electrolytic Li and Fe under different voltages
2.2.2 磷酸电解液浓度对废料浸出率的影响
在电解电压为2.5 V 的条件下改变磷酸电解液的浓度进行电解实验,电解测试时间为1 h。实验结果如图6 所示。图6(a)测试结果表明磷酸电解液浓度小于0.6 mol/L 时电解电流明显较小,磷酸电解液浓度大于0.6 mol/L 时电解电流呈相似的变化趋势。用图3 中同样的方式进行电量的积分和修正,最后得到的单位质量的磷酸铁锂废料在不同浓度磷酸电解液中恒压电解的最终积分电量如图6(b)所示,左侧为总的积分电量,右侧为扣除背景电流的积分电量。从修正后的电量变化结果可以看出,单位质量的磷酸铁锂废料的电量消耗随着磷酸电解液的浓度增加而变大,在磷酸电解液的浓度大于0.6 mol/L后略有降低。
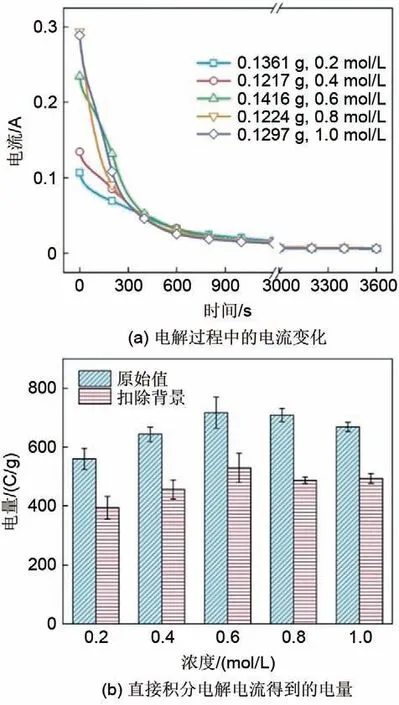
图6 磷酸电解液浓度对电解电流和积分电量的影响Fig.6 Effects of phosphoric acid electrolyte concentration on electrolysis current and integrated electricity
通过循环伏安测试和恒压电解测试的结果可以看出,电解后可能产生难以溶解的磷酸铁从而使铁离子的浸出率降低,同时部分磷酸铁锂可能可以直接溶解于磷酸电解液。所以在不同磷酸浓度下进行了直接浸泡和恒压电解的对比实验,浸泡时间与电解时间均为1 h,锂离子和铁离子的浸出率如图7所示。可以看出直接浸泡下锂离子和铁离子的浸出率在磷酸浓度大于0.4 mol/L 时趋于稳定,二者浸出率均可达到70%以上。电解下的锂离子浸出率在磷酸浓度大于0.4 mol/L 时趋于稳定,浸出率超过90%,可见电解对于磷酸铁锂废料中锂离子的浸出有明显的促进作用。电解下铁离子的浸出率低于直接浸泡,在0.8 mol/L 的磷酸中电解铁离子浸出率最高,但是仍小于60%。这进一步证明了电解产生的磷酸铁难以溶解于磷酸,使得在锂离子浸出率变大的同时铁离子浸出率降低。

图7 不同浓度磷酸电解液中直接浸泡和恒压电解下的锂离子和铁离子的浸出率Fig.7 Leaching rates of Li and Fe under direct immersion and constant pressure electrolysis in different concentrations of phosphoric acid electrolyte
2.2.3 电解前浸泡时间对废料浸出率的影响
在上述电解实验的基础上,为了在实现高锂离子浸出率的同时提高铁离子的浸出率,设计了先浸泡后电解的组合工艺。所用的磷酸浓度为0.6 mol/L,电解电压为2.5 V。直接浸泡、直接电解、先浸泡后电解3种不同条件下锂和铁的浸出率如图8所示。与直接浸泡和直接电解相比,先浸泡后电解的工艺可以在实现高锂离子浸出率的同时提高铁离子浸出率。在先浸泡30 min 后电解30 min 处理过后,锂离子浸出率为91.3%,铁离子浸出率为75.3%。锂离子的浸出率与直接电解60 min后一致,并且铁离子浸出率远高于直接电解60 min 后的34.6%,并且也高于直接浸泡60 min 后的71.3%。进一步增加浸泡时间,先浸泡60 min 后电解30 min 处理过后,锂离子浸出率为95.6%,铁离子浸出率为91.3%,而再进一步增加电解时间浸出率没有明显变化。
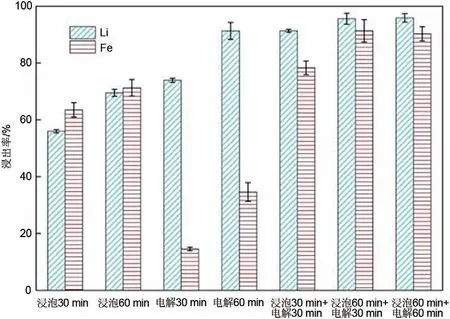
图8 不同电解前浸泡时间的锂离子和铁离子浸出率Fig.8 Leaching rates of Li and Fe for different immersion time before electrolysis
2.3 铁盐和锂盐的沉淀分离
本研究采用氨水调节溶液pH 值2.0 左右,在80 ℃加热4 h沉淀二水合磷酸铁。二水合磷酸铁的回收率可达98.8%,在分离铁离子后的滤液中用氨水将pH 值调节至8.0 左右,在60 ℃条件下反应2 h,获得Li3PO4产物,锂离子的回收率可达99.4%。对化学沉淀法制备的二水合磷酸铁和磷酸锂产品进行X射线衍射(XRD)分析,结果如图9所示。图9(a)中发现本实验制备的FePO4·2H2O有两种不同的晶型,除此之外没有其他的衍射峰,说明获得的沉淀纯度较高。图9(b)中制备的磷酸锂谱线与标准卡片谱线吻合度较高且没有杂峰,衍射峰尖锐,说明磷酸锂产品结晶度较好。经过王水消解后进行金属含量分析,磷酸锂产品的纯度为98.5%。沉淀磷酸锂后通过蒸发结晶回收滤液中的磷酸二氢铵,回收1 g的磷酸锂,磷酸二氢铵的产量为9.97 g。

图9 化学沉淀回收产品的XRD图Fig.9 XRD patterns of the product recovered by chemical precipitation
3 结论
(1)提出了采用磷酸体系固相电解的方法回收废磷酸铁锂正极活性物质的回收与资源化处理工艺。在磷酸电解液中,采用先浸泡后电解的方式浸出磷酸铁锂废料中的铁和锂,并以二水合磷酸铁和磷酸锂形式回收。全程除了磷酸根外无其他酸根引入,副产物只有磷酸二氢铵,无废水产生且使用电量少,回收成本低。
(2)对铁离子和锂离子浸出率影响最大的为电解电压、磷酸电解液浓度及电解前浸泡时间。优化后的工艺参数为:在磷酸浓度为0.6 mol/L、电解电压为2.5 V的条件下,先浸泡60 min后电解30 min处理过后,锂离子浸出率为95.6%,铁离子浸出率为91.3%。
(3)采用氨水调节浸出液pH 分步沉淀二水合磷酸铁和磷酸锂,最佳反应条件下铁的回收率为98.8%,锂的回收率为99.4%,磷酸锂的纯度可以达到98.5%,回收1 g 的磷酸锂磷酸二氢铵的产量为9.97 g。

