基质金属蛋白酶-7和基质金属蛋白酶-28在特发性肺纤维化诊断中的价值
严梅 纳建荣 杨朝
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种病因不明的慢性、渐进性、纤维化性间质性肺病[1],发病率逐年升高,且预后极差,中位生存期仅3-5年[2]。IPF的诊断主要依赖胸部高分辨率CT和/或肺活检,临床上因部分间质性肺病影像学表现与IPF相似,而肺活检技术要求高、操作风险大,从而导致IPF诊断困难。基质金属蛋白酶(Matrix metalloproteinases,MMPs)是一类锌依赖性内肽酶,参与细胞基质的降解,并在调节生物活性递质方面有一定作用[3]。目前在IPF中发现多种MMPs表达上调,其中包括基质金属蛋白酶-7(MMP-7)和基质金属蛋白酶-28(MMP-28),研究证实两者均有促进肺纤维化的作用[4-5],然而两者在IPF诊断以及严重程度评估中的价值尚不完全清楚。本研究旨在探讨血清MMP-7与MMP-28在特发性肺纤维化中的临床应用价值。
资料与方法
一、研究对象
选择2018年9月至2019年12月于宁夏回族自治区人民医院呼吸科住院的IPF患者30例为试验组,同期就诊的30例RA-ILD以及30例健康体检者分别作为对照组。IPF的诊断符合2018年美国胸科协会、欧洲呼吸学会等联合颁布的《特发性肺纤维化循证诊治指南》诊断标准[1],所有患者均存在不同程度的劳力性呼吸困难、干咳,体检可闻及Velcro啰音,部分存在杵状指,均为影像学确诊病例,即:肺部HRCT均表现为典型UIP型,双肺胸膜下、基底部为主的异常网格影、蜂窝影,部分伴牵拉性支气管扩张。RA-ILD诊断采用2010年ILD分类诊断标准[6],均存在关节疼痛,部分伴呼吸困难、干咳,体检部分有Velcro啰音、杵状指,HRCT主要表现为双下肺的网格影、蜂窝影,部分伴有结节影;其中21例表现为UIP型,9例为非UIP型。健康体检者来自同期体检中心就诊的健康人。排除标准:排除肺部感染、肺结核等其它肺部疾病;排除系统性红斑狼疮、原发性干燥综合征等其他类型的结缔组织病;排除合并肿瘤者;排除慢性心脏、肾脏、肝脏等脏器衰竭者;排除治疗过程中激素使用者。本研究获得我院医学伦理学委员会批准,所有研究对象均知情同意。
二、试验方法
1 实验室检查 所有研究对象于入院当日晨起空腹采取肘静脉血3 mL,半小时内以1 000 g离心20分钟,取上清液置于-80℃冰箱保存。采用ELISA法检测血浆中MMP-7、MMP-28水平。具体操作步骤按试剂盒说明书进行。
2 肺功能检查 使用德国Jaeger公司Master Screen肺功能仪完成肺功能检查,选取用力肺活量占预计值百分比(FVC%)、一氧化碳的弥散量占预计值百分比(DLCO%)来评估肺功能的损害程度。
3 HRCT 使用Philips Brilliancei 256多排螺旋CT进行胸部扫描。按Muller法将CT层面分上、中、下3个区域,选择主动脉弓层面、气管分叉平面、膈上1cm层面。评分标准按磨玻璃改变、网格影、蜂窝样改变分别评分。0分:没有改变;1分:病变范围<5%;2分:病变范围6%~24%;3分:病变范围25%~49%;4分:病变范围50%~75%;5分:病变范围>75%。3种改变评分累加后计算总分,累加的评分值越高,提示肺纤维化程度越重[7]。
4 超声心动图 使用彩色多普勒超声心动图测定安静状态下肺动脉收缩压(Pulmonary artery systolic pressure,PASP),先测定三尖瓣最大反流速度(V),再根据Bernoulli公式计算跨三尖瓣反流压差(ΔP),ΔP=4V2;PASP=4V2加右房压,以PASP≥40 mmHg为肺动脉高压(Pulmonary hypertension)[8]。
三、统计学分析
应用SPSS 23.0进行数据统计分析,计量资料以均数±标准差表示,两组间比较采用t检验,计数资料以例数(构成比)表示,组间比较采用卡方检验。相关性分析采用Person相关检验。绘受试者工作特征曲线(Receiver operating characteristic curve,ROC)评估诊断效能。P<0.05表示差异有统计学意义。
结 果
一、IPF、RA-ILD及健康对照组的年龄、性别构成比以及吸烟史比较
IPF组、健康对照组年龄高于RA-ILD组(F=5.98,P<0.05),IPF组、健康对照组男性患者多于RA-ILD组(χ2=18.77,P<0.05),IPF组、健康对照组吸烟人数多于RA-ILD组(χ2=12.34,P<0.05),差异均有统计学意义(见表1)。

表1 IPF组、RA-ILD组及健康对照组一般资料比较
二、IPF组与RA-ILD组临床指标比较
IPF组与RA-ILD组一般临床特征对比,① IPF组患者多表现为呼吸困难、咳嗽、咳痰,且Velcro啰音多见,RA-ILD组患者多表现为关节痛等原发病表现,呼吸道症状相对较IPF轻,两者差异均有统计学意义(P<0.05);在杵状指方面两组患者差别无统计学意义(P>0.05)。② 两组患者均有CEA、CRP、ESR、RF以及PASP升高病例。其中IPF组CEA升高例数较RA-ILD组多,差异有统计学意义(P<0.05),IPF组CRP、ESR以及RF升高例数均少于RA-ILD组,差异均有统计学意义(P<0.05),PASP升高例数两组相比差异无统计学意义(P>0.05)。③ IPF组与RA-ILD组患者肺功能指标进行比较,IPF组患者FVC%、DLCO%与RA-ILD组相比差异无统计学意义(P>0.05)。④ IPF组与RA-ILD肺部HRCT表现进行比较,IPF组患者基本影像学表现以网格影居多,其次为小叶间隔增厚、蜂窝影以及磨玻璃影;RA-ILD组以网格影居多,其次为磨玻璃影、蜂窝影以及小叶间隔增厚。IPF组各类影像学表现与RA-ILD组相比,除小叶间隔增厚外,差异均无统计学意义(P>0.05)。IPF组HRCT评分与RA-ILD组相比,差异无统计学意义(P>0.05)(见表2)。
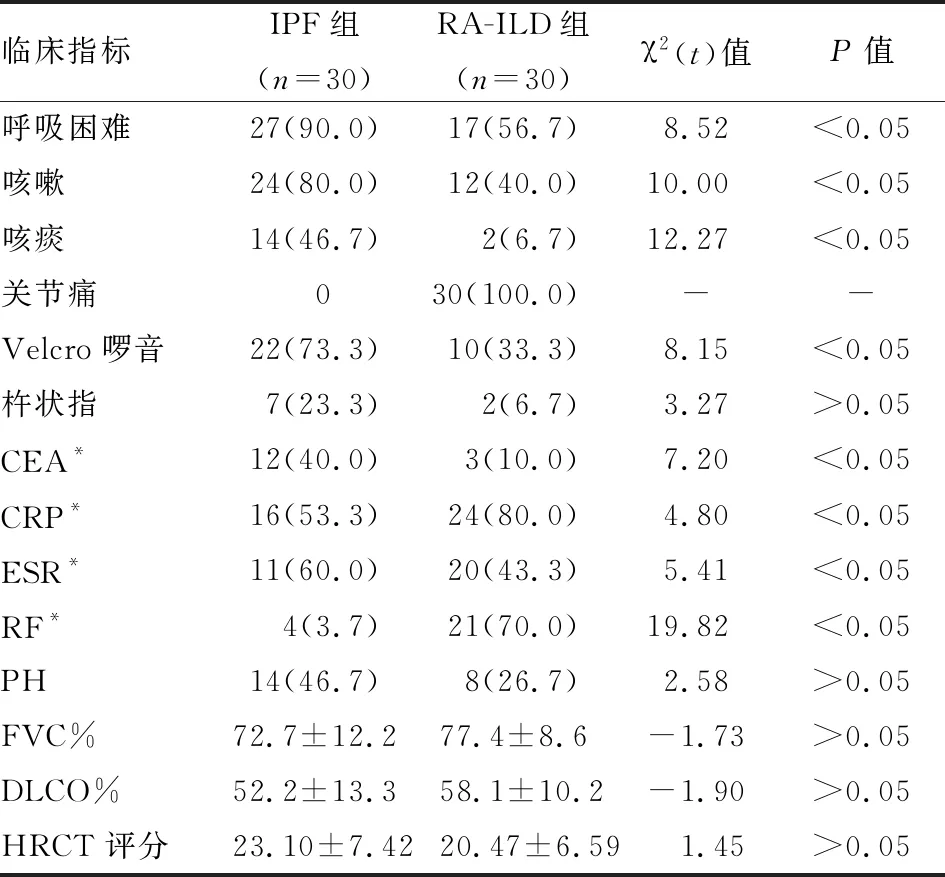
表2 IPF组与RA-ILD组患者一般临床特征比较
三、IPF组、RA-ILD组以及健康对照组血浆中MMP-7、MMP-28水平
① IPF组患者血浆MMP-7水平为(9.28±1.63)ng/mL,与RA-ILD组(8.63±1.50)ng/mL相比差异无统计学意义(t=1.61,P>0.05),较健康对照组(5.99±1.02)ng/mL明显升高,差异有统计学意义(t=9.36,P<0.05);② IPF组患者血浆MMP-28水平为(12.15±2.12)ng/mL,明显高于RA-ILD组(10.01±2.88)ng/mL以及健康对照组(7.45±1.50)ng/mL,差异均有统计学意义(t=3.30,P<0.05;t=9.90,P<0.05)(见图1)。
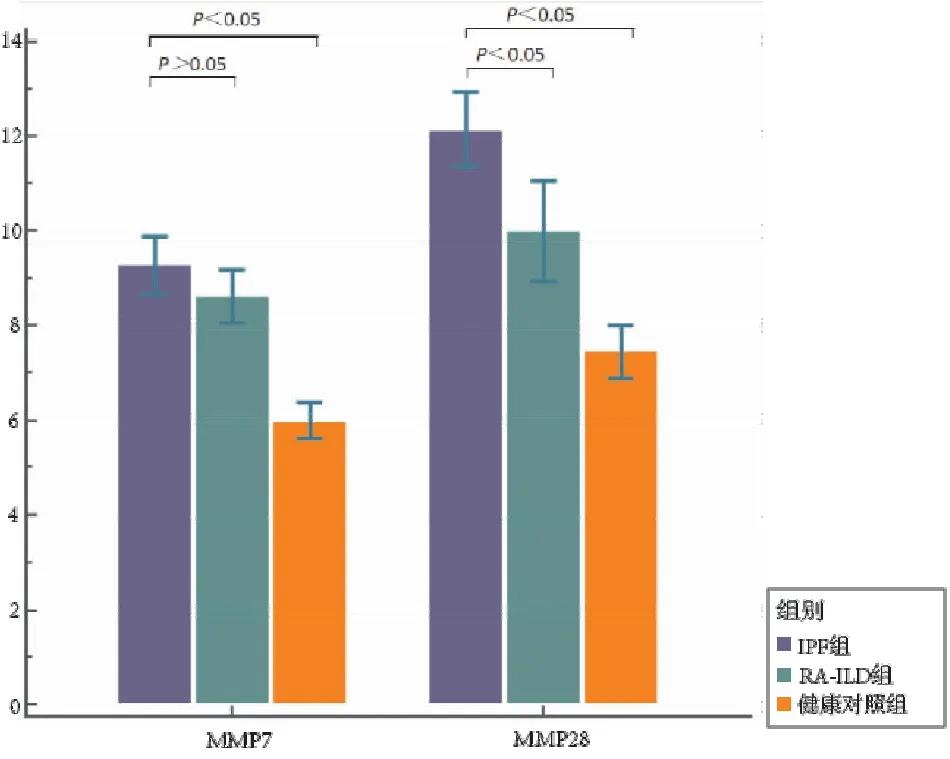
图1 IPF组、RA-ILD组及健康对照组MMP-7、MMP-28水平
四、IPF组MMP-7、MMP-28与肺功能指标、HRCT评分的相关性
IPF组血浆中MMP-7、MMP-28水平分别与FVC%(r=-0.76,P<0.05;r=-0.46,P<0.05)、DLCO%(r=-0.63,P<0.05;r=-0.44,P<0.05)呈负相关;与HRCT评分呈正相关(r=0.62,P<0.05;r=0.39,P<0.05)。
五、血浆MMP-7、MMP-28对IPF的诊断价值
MMP-7及MMP-28对IPF的诊断效能行ROC曲线分析,结果示:MMP-7曲线下面积(AUC)为0.97,最佳截断值为7.65 ng/mL,敏感度为86.6%,特异度为96.6%。MMP-28的AUC为0.98,最佳截断值为9.55 ng/mL,敏感度为90.0%,特异度为93.3%。MMP-7、MMP-28联合检测AUC为0.99,敏感度为99.9%,特异度为96.7%(见图2)。

图2 MMP-7、MMP-28在IPF诊断中的价值
六、MMP-28在IPF鉴别诊断中的价值
MMP-28对IPF与RA-ILD的鉴别诊断效能行ROC曲线分析,结果示:AUC为0.73,截断值10.33ng/mL时,敏感度为76.7%,特异度为60.0%(见图3)。
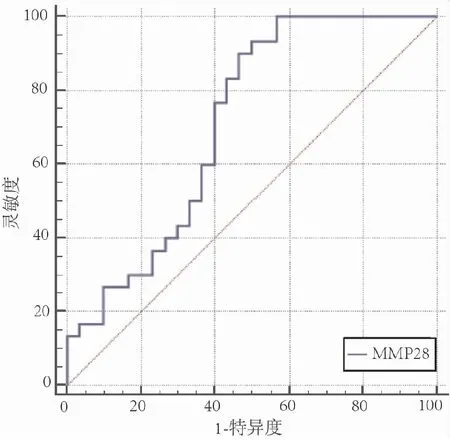
图3 MMP-28在IPF鉴别诊断中的价值
讨 论
IPF是原因不明的弥漫性ILD中最常见的类型,约占所有ILD的17%~37%,该病发病率逐年升高,目前认为其发病与年龄、吸烟、遗传易感性、肺微生物组紊乱、胃食管反流以及职业暴露等多因素有关。本研究中,IPF好发于老年男性,60岁后起病多见,常有吸烟史;多存在劳力性呼吸困难,部分伴干咳、双肺底Velcro啰音、杵状指;肺功能以限制性通气功能障碍为主,同时伴有弥散功能受损;肺CT表现为双肺底多发网格影、蜂窝影,部分伴牵拉性支气管扩张,与既往研究一致[9]。
MMP-7是MMPs家族中最小的成员之一,在肺内主要由肺泡上皮细胞以及单核吞噬细胞分泌[10]。本研究发现,IPF患者血浆MMP-7水平较健康对照组明显升高,且与FVC%和DLCO%呈负相关,与HRCT评分呈正相关,提示其可能参与了肺纤维化过程,并与肺损伤的严重程度密切相关。推测其可能的机制是[11]:MMP-7通过促进潜在转化生长因子-β(Transforming growh factor-β1,TGF-β1)的释放,介导中性粒细胞的跨上皮浸润且加剧上皮细胞炎性损伤,激活表皮生长因子促进肺成纤维细胞增殖,裂解E-钙粘蛋白促进细胞迁移及异常损伤修复等。临床上多采用肺功能FVC%、DLCO%及HRCT评分对IPF进行病情严重程度及预后判断。Tzouvelekis等报道IPF患者血浆MMP-7水平与患者FVC%和DLCO%呈负相关,且与年龄、性别、FVC%和DLCO%相结合的死亡风险评分系统具有相关关系[12]。本研究也发现随着肺纤维化程度(HRCT评分)、肺通气及弥散功能受损(FVC%和DLCO%)加重,MMP-7水平表达越高,这与以往的研究相同[12]。本研究中,IPF组与RA-ILD组血浆MMP-7表达水平无明显差异,这提示MMP-7对诊断影像学表现为UIP型的ILD或有重要诊断价值,因为本组RA-ILD患者影像学上多表现为UIP型(21例表现为UIP型,9例为非UIP型),因此推测MMP-7可能不能区分影像学表现为UIP型的IPF与其它类型的ILD。IPF的诊断需要排除病因明确的ILD,且HRCT和/或组织学表现为UIP[1]。一般情况下,HRCT表现为UIP型足以诊断IPF,然而由于其他慢性纤维化性肺疾病影像学也可表现为UIP,而肺病理活检标本获取困难、操作风险大,使得准确诊断IPF存在一定的困难。因此,临床上亟需用于IPF诊断的无创新方法。本研究利用ROC曲线评价MMP-7在IPF诊断中的价值,AUC为0.97,最佳截断值为7.65 ng/mL,敏感度为86.6%,特异度为96.6%,提示其临床可用于IPF的辅助诊断。
MMP-28是MMPs家族中最新的成员之一,最早是从人角化上皮及睾丸的cDNA文库中克隆而来[13]。研究发现MMP-28在健康人低表达,而在IPF患者中过度高表达,主要由肺泡上皮细胞和支气管上皮细胞分泌[4]。MMP-28在IPF临床应用中的研究还较少,本研究发现IPF组患者血浆中MMP-28水平明显高表达,相关性分析显示其与FVC%和DLCO%均呈负相关,与HRCT评分呈正相关,提示其参与了肺纤维化过程并可用于IPF严重程度的判断。值得关注的是,本研究MMP-28水平明显高表达,且与RA-ILD组比也明显升高,提示其引起肺纤维化损害的机制可能不同于MMP-7,或可用于区分IPF与其它类型的ILD。研究发现[14],从疾病早期及终末期获取的肺组织中始终能观察到高水平的MMP-28,在博来霉素诱导的小鼠模型中,野生型小鼠MMP-28表达显著增加,而MMP-28基因敲除小鼠纤维化程较轻;MMP-28可通过作用于细胞表面E-钙粘蛋白以及激活潜在TGF-β复合物,导致稳定且不可逆的EMT。另外Gharib等人发现MMP-28可通过促进巨噬细胞募集及向M2表型极化,放大炎症反应,从而加重肺纤维化[15]。本研究评价MMP-28在IPF诊断中的价值,AUC为0.98,最佳截断值为9.55 ng/mL,敏感度为90.0%,特异度为93.3%。将MMP-7、MMP-28联合后AUC为0.99,敏感度为99.0%,特异度为96.7%,敏感度及特异度较单独指标升高,故两者联合可提高诊断效能。进一步分析MMP-28在IPF与RA-ILD鉴别诊断中的价值,ROC曲线示AUC为0.71,当截断值为10.33 ng/mL,敏感度为76.7%,特异度为60.0%,提示其鉴别诊断效能良好,推测MMP-28可对影像学表现为UIP型的IPF与非IPF所致的 ILD进行区分,是IPF鉴别诊断的良好指标。
综上所述,IPF发病男性较多,年龄较大(60岁以上),常有吸烟史,临床多表现为呼吸困难、咳嗽、咳痰,且Velcro啰音多见,MMP-7、MMP-28在IPF患者中均高表达,可作为IPF诊断及病情严重程度评估的生物标记物;与RA-ILD比,MMP-28在IPF中表达更高,或可用于IPF与非IPF所致的ILD的鉴别诊断。因此,两指标联合有助于IPF的早期识别、病情判断及制定诊疗措施,对改善患者预后有一定意义。

