琼胶多糖对异育银鲫生长、体组成和抗氧化能力的影响
郭益红 , 宣雄智 , 赵永志 , 李文嘉
(1.苏州农业职业技术学院,江苏苏州 215008;2.广东海纳川生物科技股份有限公司,广东佛山 528500;3. 河南省农业科学院畜牧兽医研究所,河南郑州 450002)
琼胶是一种从红藻中提取的天然胶体, 是一种链状聚合物, 结构上由 (1-3)-β-D-半乳糖和(1-4)-3、6-内醚-α-L-半乳糖等组成。 琼胶具有良好的凝胶、增稠和稳定性能,在食品中被广泛用作胶凝剂、稳定剂、增稠剂、分散悬浮剂,用来增加食品黏度、 使食品黏滑而富有弹韧性 (付晓婷,2008);在工业上,琼胶可以进一步制成琼胶糖,是很好的免疫扩散介质,在临床诊断、生物化学、微生物学、免疫学研究上发挥重要作用。 在医学上,可用作腹泻剂、片剂、油膏剂、鱼肝油乳化剂等(王琪琳等,2002)。琼胶是一种很好的膳食纤维,含有人体必需的多种矿物质元素, 具有排毒和降血糖等保健作用(何坤祥,2016)。红藻中琼胶的产量和质量随环境因素,如温度、盐度、光照、营养盐等的变化而变化(卫燕云等,2020),因此其品质不太稳定。 异育银鲫(Carassius auratus gibelio)是以兴国红鲤为父本,天然雌核发育的方正银鲫为母本,经人工授精和异精雌核发育而获得子代, 其生长迅速,适应能力强,且肉质鲜美,颇受人们喜爱(刘艳辉等,2021)。
水产饲料常用黏合剂为淀粉、纤维素等,海藻多糖替代饲料黏合剂对经济鱼类生长和免疫性能的影响研究鲜有报道(宣雄智,2014),本试验拟探索琼胶粉梯度替代淀粉对异育银鲫生长代谢和免疫性能的影响, 评估琼胶应用于水产饲料的可行性。
1 材料和方法
1.1 试验饲料 琼胶粉购自广东环凯生物科技有限公司。所有饲料原料经粉碎后过60 目筛后充分混合均匀, 采用逐级扩大的方法添加维生素和矿物质等微量原料,然后加适量蒸馏水,拌匀后用硬颗粒挤压机制成直径为1.5 mm 的颗粒饲料,室温风干后密封于真空包装袋中, 存放于-20 ℃冰箱中待用。 以不含琼胶粉的饲料为对照组,另外,分别以1%、3%、5%琼胶替代基础饲料中的淀粉,配制 3 组试验饲料(D1、D2、D3 组),基础饲料组成及营养水平见表1。
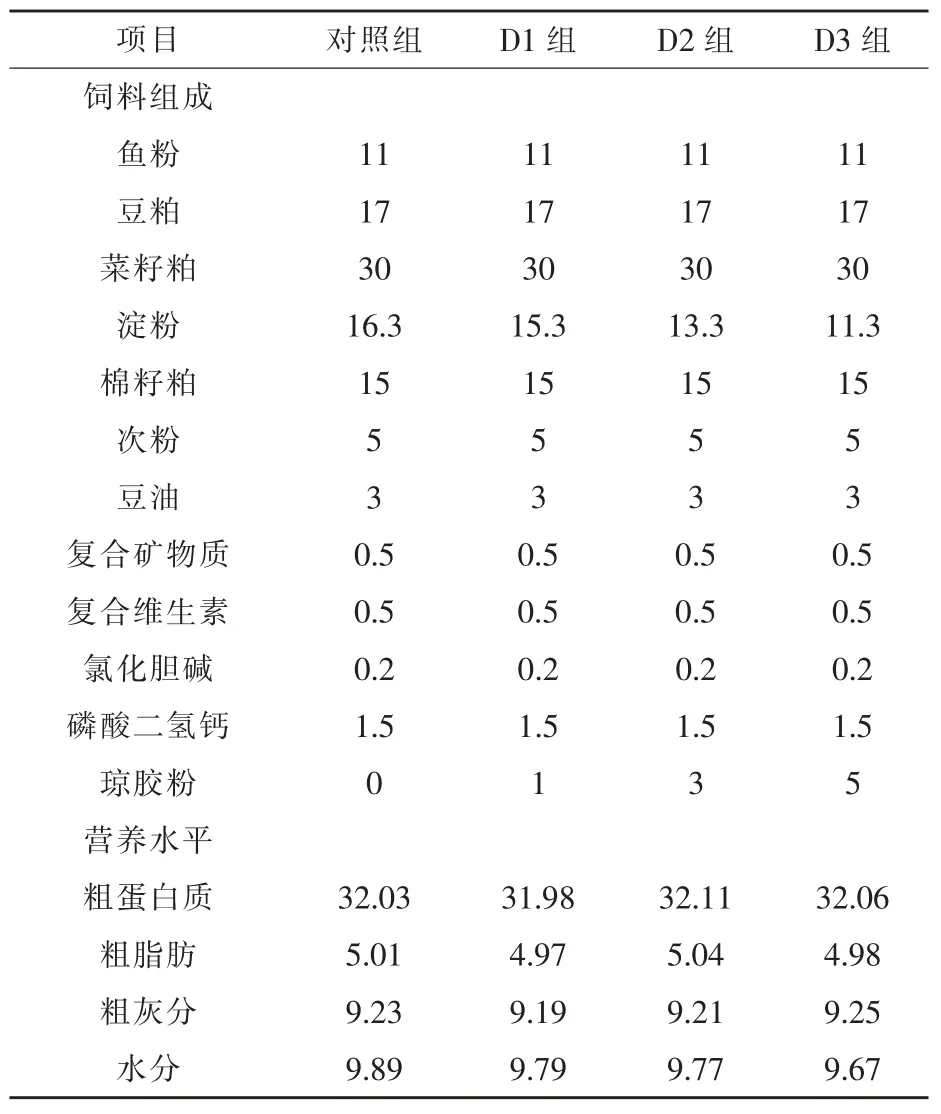
表1 饲料组成及营养水平(干物质) %
1.2 试验鱼与试验条件 试验用异育银鲫幼鱼购自江苏华辰水产实业有限公司,试验开始前,先将试验鱼在室内养殖箱 (规格70 cm×60 cm,200 L 圆柱型)驯化2 周,驯化期间投喂对照组饲料。养殖试验设5 组,每组3 个重复。 试验开始前,试验鱼禁食24 h, 挑选健康且规格一致的幼鱼称重,并放入养殖箱,每箱25 尾。试验鱼初始体质量为(10.32±0.16)g,试验水温为(20±2)℃,pH 为 7.5左右;适量连续充气,使水体溶氧≥5 mg/L;以饱食投喂法每天投喂 2 次(8:30、16:30),准确记录投饲量, 投喂结束后2 h 用虹吸法去除养殖箱底部的粪便。
1.3 样品收集 养殖试验结束后, 试验鱼禁食24 h,麻醉后(40 mg/L 丁香酚)称重。 每缸随机挑取12 尾,其中3 尾用作全鱼样本,其余9 尾尾静脉采血,低温离心(1500 r/min,15 min,4 ℃)吸取上层血清,经液氮速冻后置于超低温冰箱(-80 ℃)保存备用。 将上述抽完血的试验鱼 (每处理组共12 尾)用于肝脏、前肠取样,所取样品经液氮速冻后保存于超低温冰箱(-80 ℃)待用。
试验最后2 周,给试验鱼投喂含1% Cr2O3的消化率试验饲料,饲喂结束后1 h,用虹吸法收集粪便,测定饲料表观消化率。
1.4 测定指标
1.4.1 常规生长及血清指标测定 饲料和全鱼样品的水分、粗蛋白质、粗脂肪、粗灰分含量,肝脏的水分和粗脂肪含量均按国标方法测定。 粗蛋白质用凯氏定氮法,粗脂肪用索氏抽提法,粗灰分用马弗炉在550 ℃灼烧法, 水分用105 ℃烘干恒重法测定,血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆固醇(TC)和甘油三酯(TG)的测定依照南京建成生物工程研究所试剂盒说明书进行。
试验鱼的增重率、饲料转化率、摄食率等指标的计算公式如下:
增重率=(mt×m0)/m0;
饲料转化率 =(mt×m0+ md)/ I;
摄食率/%= I/[t×(m0(g) + mt(g))/2]×100;
成活率/%=末尾数/初尾数×100。
式中:mt为试验结束时鱼体质量,g;m0为试验初始鱼体质量,g;t 为试验时间,d;md为死亡鱼体质量,g;I 为饲料干物质总投喂量,g。
蛋白质效率/%=(mt-m0)/(I×CP)× 100。
式中:mt为试验结束时体质量,g;m0为试验初始体质量,g;t 为试验时间,d;md为死亡鱼体质量,g;CP 为饲料中粗蛋白质含量;I 为饲料干物质总投喂量,g。
1.4.2 表观消化率测定 表观消化率的测定参照Cho & Kaushik(1990)所报道的方法,本研究以1% Cr2O3作为指示剂,对所配制的试验饲料组干物质、 粗蛋白质和粗脂肪的表观消化率进行了测定。 计算公式如下:
表观消化率/%=[1-(A0/A×B/B0)]×100;
式中:A、A0分别为饲料中和粪便中的营养物质含量;B、B0分别为饲料和粪便中的Cr2O3含量。
1.4.3 消化、 免疫及抗氧化酶活性的测定 酶液的制备及异育银鲫前肠蛋白酶活性的测定参照宋林等(2013)所报道的方法,前肠脂肪酶、淀粉酶、肝脏超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量均采用南京建成生物工程研究所试剂盒测定, 粗酶液中蛋白质浓度测定采用考马斯亮兰染色法 (南京建成生物工程研究所试剂盒)。
1.5 数据统计分析 采用SPSS 22.0 软件对试验所得数据进行单因素方差分析 (One-way Anova),差异显著时(P < 0.05),用 Duncan’s 法进行多重比较检验。 统计数据均以“平均值±标准误”表示。
2 结果
2.1 琼胶对异育银鲫生长、体成分和饲料利用率的影响 随着琼胶添加量的逐渐增加, 异育银鲫的增重率呈先上升后下降的趋势, 但各组差异不显著(P > 0.05)。 随着琼胶添加量的增加,异育银鲫肝脏粗脂肪含量逐渐降低,D3 组肝脏脂肪含量、全鱼粗蛋白质含量、干物质表观消化率分别比对照组显著下降 7.75%、7.56%和 4.00%(P <0.05)(表 2 ~ 表 4)。
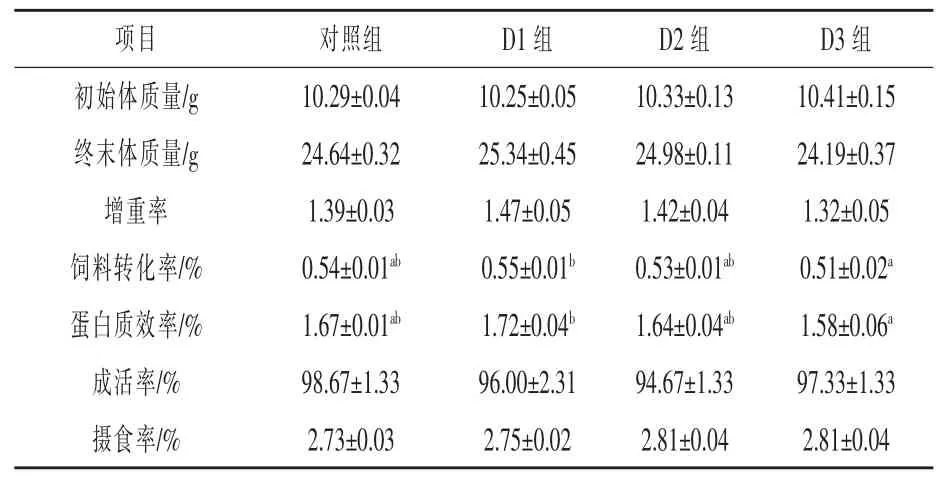
表2 养殖8 周后异育银鲫的生长和饲料利用情况
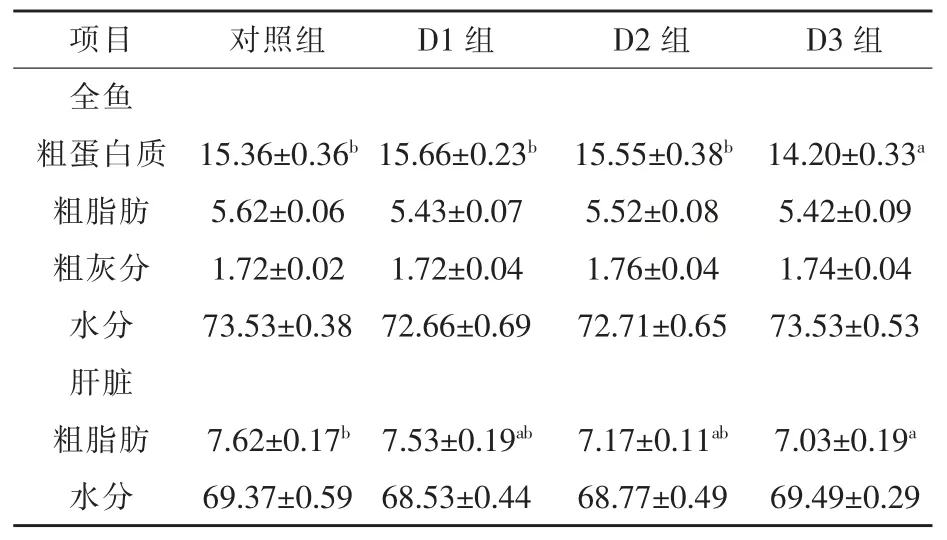
表3 养殖8 周后异育银鲫全鱼及肝脏成分(鲜质量) %
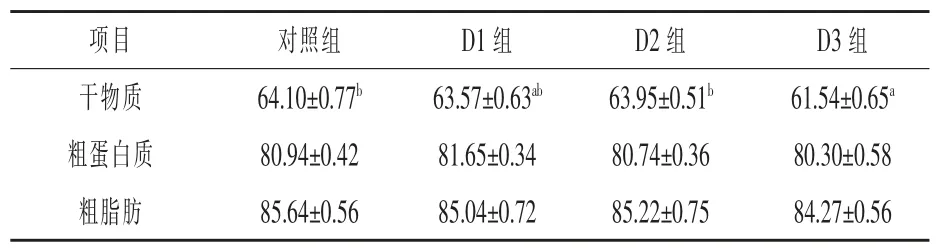
表4 养殖8 周后异育银鲫的表观消化率 %
2.2 琼胶对异育银鲫消化酶活力的影响 本试验中,D2 和D3 组异育银鲫前肠淀粉酶活性分别比对照组显著下降19.80%和26.99%(P <0.05),但各组前肠蛋白酶和脂肪酶活性无显著差异(P >0.05)(表 5)。
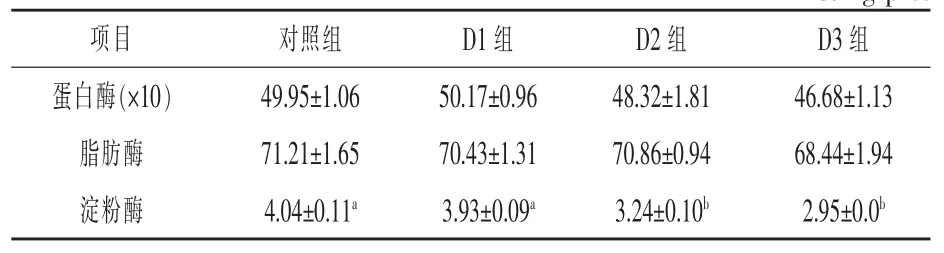
表5 养殖8 周后异育银鲫前肠消化酶活性 U/mg prot
2.3 琼胶对异育银鲫抗氧化酶活力的影响 本试验中, 随着琼胶添加量的增加, 异育银鲫肝脏SOD 和 CAT 变化趋势相似,CAT/SOD 比值逐渐下降,D3 组肝脏酸性磷酸酶、 过氧化氢酶的活性及CAT/SOD 比值比对照组显著下降11.00%、19.61%和16.08%,各组肝脏MDA 含量无明显差异(表 6)。
2.4 琼胶对异育银鲫血清指标的影响 本试验中,D2 和D3 组异育银鲫血清总胆固醇含量分别比对照组显著下降11.00%和8.33%,其他指标各组间无显著差异(表7)。
3 讨论
3.1 琼胶对异育银鲫生长、消化及体成分的影响本试验中,随着琼胶添加量的逐渐增加,异育银鲫的增重率呈先上升后下降的趋势。 宣雄智等(2014)用含有琼胶的饲料投喂黑鲷,只有当琼胶添加量达9%时,黑鲷的增重率才显著下降。 本试验中琼胶替代异育银鲫饲料中的淀粉量最高为5%,且异育银鲫是杂食性鱼类,食性广,对琼胶等多糖可能有较强的耐受性。
随着琼胶添加量的增加, 异育银鲫肝脏粗脂肪含量逐渐降低,当琼胶添加量为5%时,与对照组相比,试验鱼肝脏脂肪含量、全鱼粗蛋白质含量显著下降。琼胶具有较强的吸水膨胀能力,可能会导致异育银鲫肠道内食糜黏度上升, 减少食糜微团与肠道吸收表面的接触, 抑制肠道黏膜对食糜微团中营养物质的吸收(聂国兴等,2007)和饲料干物质表观消化率的显著下降, 证实了该组鱼对饲料营养物质的消化受到了负面影响。
3.2 琼胶对异育银鲫消化酶活力的影响 鱼类淀粉酶是一种碳水化合物水解酶, 主要是由肝胰脏生成和分泌, 淀粉酶活性的高低会影响到鱼类对食物的消化吸收(关莹等,2021)。 有研究表明,木聚糖、 果胶等非淀粉多糖对水产动物部分消化酶活性具有较强的抑制作用(张振龙,2014)。本试验中,当琼胶添加量为3%和6%时,异育银鲫前肠淀粉酶活性显著下降, 但蛋白酶和脂肪酶活性却不受影响。鱼类对碳水化合物的利用率较低,且淀粉酶活性与饲料淀粉含量有关, 随着琼胶添加量的线性增加, 饲料淀粉含量逐渐降低可能是淀粉酶活性下降的原因之一, 然而淀粉酶活性并非线性下降, 可能是饲料琼胶含量的升高不利于食糜与消化液的充分混合, 食糜黏度增加使淀粉酶与底物不能充分接触, 而底物数量的减少间接抑制了淀粉酶的活性。 琼胶粉黏性大,吸附性强,也可能对酶蛋白有吸附作用, 钝化了消化酶的活性基团(陈亚非等,2005)。
3.3 琼胶对异育银鲫抗氧化能力的影响 海藻多糖在冷冻后可分为胶体部分和非胶体部分,非胶体部分的免疫活性要远高于胶体部分, 本试验所用的是商业琼胶产品, 其所含有的生物活性物质很少, 对异育银鲫生理生化的影响主要是基于其物理特性, 如黏度和吸水膨胀性能等 (宣雄智等,2018),因此本试验中,在饲料中添加不同水平的琼胶并没有增强肝脏抗氧化酶和血清溶菌酶,这与宣雄智等(2014)对黑鲷的研究结果一致。 在鱼类抗氧化系统中,SOD 和CAT 酶在机体清除活性氧自由基中起着关键作用, 这两种酶活性的变化能有效反映机体抗氧化防御的变化特征, 基于SOD 和CAT 的作用机理,两者的变化趋势是类似的, 且一定程度上,CAT/SOD 比值与机体所承受的氧化压力成正比(Avanzo 等,2001);丙二醛含量则可敏锐的反映机体内脂质过氧化强弱(Mu等,2002)。本试验中,SOD 和 CAT 变化趋势相似,且随着琼胶含量的增加,CAT/SOD 比值逐渐下降, 当饲料中琼胶含量达5%时, 异育银鲫肝脏CAT 的活性及CAT/SOD 比值显著下降,而肝脏丙二醛含量并无明显变化, 表明饲料中添加5%的琼胶可能并非损害了异育银鲫机体的抗氧化能力,而是降低了异育银鲫的抗氧化压力,具体机制有待进一步研究。
3.4 琼胶对异育银鲫血清生化指标的影响 本试验中,3%和5%琼胶组异育银鲫血清总胆固醇含量显著低于对照组。 研究表明,海藻所含的可溶性膳食纤维有利于降低机体胆固醇 (虞燕华等,2021), 其作用机理主要是通过改变消化道内容物的黏度、pH 及对消化道内容物的吸附性来影响肝胰脏和肠道的生理功能, 膳食纤维的黏度越大, 对胆固醇的吸附性越强 (Isabel 等,1998)。 琼胶是一种具有良好黏性和凝胶性的膳食纤维, 这些膳食纤维可能提高了消化道内容物的黏度,减少了异育银鲫对胆固醇的吸收。
酸性磷酸酶是巨噬细胞溶酶体的标志酶,在酸性环境中,可水解表面带有磷酸酯的异物,并可修饰或改变外来异物的表面分子组成, 增强免疫细胞对异物的识别, 从而加速免疫细胞对异物的吞噬和降解(Meng 等,2003)。 本试验中,当琼胶添加量达5%时,异育银鲫肝脏酸性磷酸酶活性显著下降, 表明鱼体免疫力可能受到一定的损害。 有研究表明, 当鱼体处于健康状态时, 血清胆固醇含量与鱼体抗病能力呈正相关(Nakagawa 等,2007),因此血清总胆固醇含量的下降也从侧面证实了鱼体免疫力受到一定的负面影响。
4 小结
琼胶粉替代淀粉对异育银鲫的生长性能无明显影响。 本试验条件下,当琼胶粉添加量达5%时, 有助于降低异育银鲫肝脏粗脂肪和血清胆固醇含量,在一定程度上减轻了鱼体的抗氧化压力,但鱼体免疫力也会受到一定的负面影响。

