尼泊尔酸模根部多酚提取工艺优化及其抗氧化活性研究
李欣燃, 陈玉萍, 石云丽, 王绪英, 翁贵英
(六盘水师范学院生物科学与技术学院,贵州六盘水 553000)
尼泊尔酸模(Rumex nepalensis Spreng)为廖科酸模属多年生草本植物,具有抗菌、消炎、通便、抗溃疡等多种药理作用(Woretaw 等,2021;文乐等,2019;Lopamudra 等,2003;Ghosh 等,2003),在我国主要分布于云、贵、川以及西藏等地(彭毅,2013),是一种传统中草药。 鉴于酸模属植物具有一定的饲用价值(阎宏等,2002;霍贵成等,1997),因此, 尼泊尔酸模亦可作为饲料加以开发利用。多酚类化合物是植物体内重要的次级代谢产物,其应用于饲料中可改善动物生产性能, 提高动物的抗炎及免疫力以及改善常见畜禽的肉品质 (蒋步云等,2014)。目前,对于尼泊尔酸模多酚类化合物的提取工艺及其抗氧化活性尚鲜见报道。
本研究通过超声辅助的提取方法分别检测尼泊尔酸模根、茎及叶三个部位总多酚的含量,并采用响应面法对多酚含量最高的部位进行提取工艺优化, 同时通过检测羟自由基和DPPH 自由基的清除率来对多酚提取物的抗氧化活性进行评价,以期为该植物的进一步开发利用提供参考。
1 材料与方法
1.1 试验材料 本试验所用材料采自六盘水市水城区, 经鉴定为廖科酸模属草本植物尼泊尔酸模,样品经洗净、风干、粉碎后,过40 目筛备用。没食子酸 (纯度≥99%), 生工生物工程有限公司;DPPH(纯度>97%),北京索莱宝科技有限公司;磷酸氢二钠、磷酸二氢钠、酒石酸钾钠、硫酸亚铁均为分析纯,国药集团化学试剂有限公司。
1.2 主要仪器与试剂 TD5 离型心机,湖南赫西仪器装备有限公司;UV-2100B 型紫外分光光度计, 北京东西分析仪器有限公司;GL2204B 型电子天平, 上海佑科仪器仪表有限公司;SB-800DT型超声波清洗机,宁波新芝生物有限公司。
1.3 试验方法
1.3.1 标准曲线的构建 称取没食子酸标准品0.125 g 于 250 mL 容量瓶中, 用蒸馏水定容至刻度,混匀备用,得到浓度为0.5 mg/mL 的没食子酸标准液。 移液器准确吸取标准品溶液0、0.5、1.0、1.5、2.0、2.5、3.0 mL 于 25 mL 容量瓶中,依次加入蒸馏水5 mL,酒石酸亚铁溶液5 mL 后,再用pH 7.5 的磷酸盐缓冲液补齐至25 mL,混匀、静置15 min 后于540 nm 波长测量上述各标准品吸光度,得到标准曲线 y=14.704x-0.0227(R2=0.9971)。 其尼泊尔酸模多酚得率计算公式如下:
尼泊尔酸模多酚得率/%=提取液中多酚质量/待测样品质量×100。
1.3.2 根茎叶含量比较 取尼泊尔酸模根、茎、叶三个部位样品各1 g,在超声时间40 min,乙醇体积分数 50%,料液比 1∶100(g/mL)的条件下分别进行超声提取,检测并比较各部位多酚得率,选取得率最高的部位进行后续试验。
1.3.3 单因素试验 选取尼泊尔酸模多酚含量最高部位依次进行单因素试验。 当乙醇体积分数为50%,料液比为 1∶100(g/mL),分别检测超声时间为 20、30、40、50、60、70 min 时尼泊尔酸模选取部位的多酚得率;当料液比为 1∶100(g/mL),超声时间为40 min, 分别检测乙醇体积分数为 30%、40%、50%、60%、70%、80%时尼泊尔酸模选取部位的多酚得率;当超声时间为40 min,乙醇体积分数为 50%,分别检测料液比为 1∶70、1∶80、1∶90、1∶100、1∶110、1∶120(g/mL)时尼泊尔酸模选取部位的多酚得率。
1.3.4 响应面法试验 依据单因素试验结果,以多酚得率为响应值, 结合Box-Behnken 设计原理,进行响应面优化试验,并进一步对其进行工艺验证。
1.3.5 抗氧化活性检测 将尼泊尔酸模选取部位的多酚提取液进行梯度稀释,依次为0.6、0.5、0.4、0.3 mg/mL 以及0.2 mg/mL,并对各浓度提取液进行羟自由基清除试验和DPPH 清除试验, 同时以抗坏血酸作为平行对照。
2 结果与分析
2.1 尼泊尔酸模中各部位多酚得率 由图1 可知,分别将尼泊尔酸模根、茎及叶各部位多酚得率进行比较后发现,根部多酚得率为6.92%,显著高于茎部(4.37%)和叶部(5.99%)多酚得率,故后续试验选取尼泊尔酸模根部作为研究对象, 进行多酚提取条件的优化。
2.2 单因素试验结果 选取尼泊尔酸模根部进行单因素试验。 对于超声时间而言(图2),当达到40 min 时,多酚得率最高,为6.95%,随着超声时间延长,多酚得率略微有所下降,可能是由于超声时间的延长会导致少量多酚类化合物的破坏;对于料液比而言(图 3),当比例为 1∶80(g/mL)时,多酚得率达到最高,为6.95%,随着料液比的增加,多酚得率基本不变, 说明在此条件下多酚化合物已基本析出; 对于乙醇体积分数而言 (图4),在50%时多酚得率达到最高,为6.90%,随着乙醇体积分数的增加,多酚得率反而降低,可能是此时有机溶剂与多酚类化合物的极性最接近, 多酚得率最高。
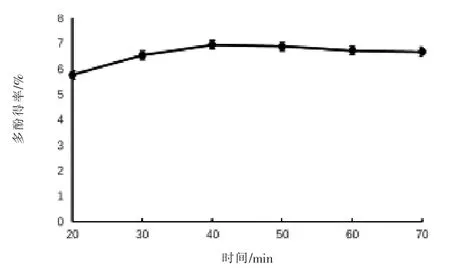
图2 超声时间对多酚得率的影响
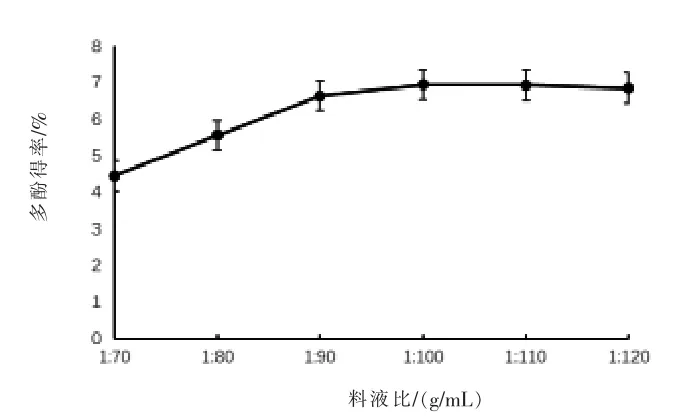
图3 料液比对多酚得率的影响
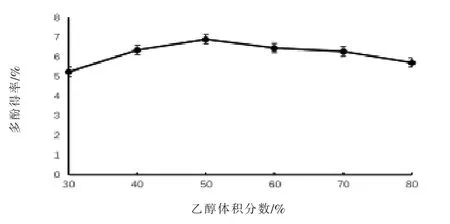
图4 乙醇体积分数对多酚得率的影响
2.3 多酚提取工艺优化
2.3.1 Box-Behnken 设计结果 根据尼泊尔酸模根部多酚提取的单因素试验结果, 采用Box-Behnken 设计原理对影响其多酚得率三个因素进行响应面优化,具体结果见表1。

表1 Box-Behnken 试验设计与结果
2.3.2 回归模型及方差分析 通过Design-Expert.8.0.6 对表1 中尼泊尔酸模根部多酚得率相关数据进行分析,得到多元回归拟合方程为Y =-141.51550 +0.21948A +2.63588B +0.25100C +2.35000×10-3AB+3.67500×10-3AC-8.25000×10-4BC-8.04500×10-3A2-0.013345B2-4.42000×10-3C2。
由表2 可知,该模型P < 0.05,差异极显著,失拟误差无显著差异, 表明该模型与实际拟合度较好。 模型中 B、A2和 B2表现为差异极显著,C 表现为差异显著,A、AB、AC、BC 和 C2表现为无差异, 三个因素对尼泊尔酸模根部多酚得率的影响大小因素依次为B>C>A, 即料液比>乙醇体积分数>提取时间。

表2 响应面试验结果方差分析表
2.3.3 响应面图形分析 各因素交互作用对尼泊尔酸模根部多酚得率的影响情况详见图5。 可以发现各响应面坡度变化较为平缓, 说明时间和料液比、时间和乙醇体积分数、料液比和乙醇体积分数之间交互作用对尼泊尔酸模根部多酚影响作用不显著。
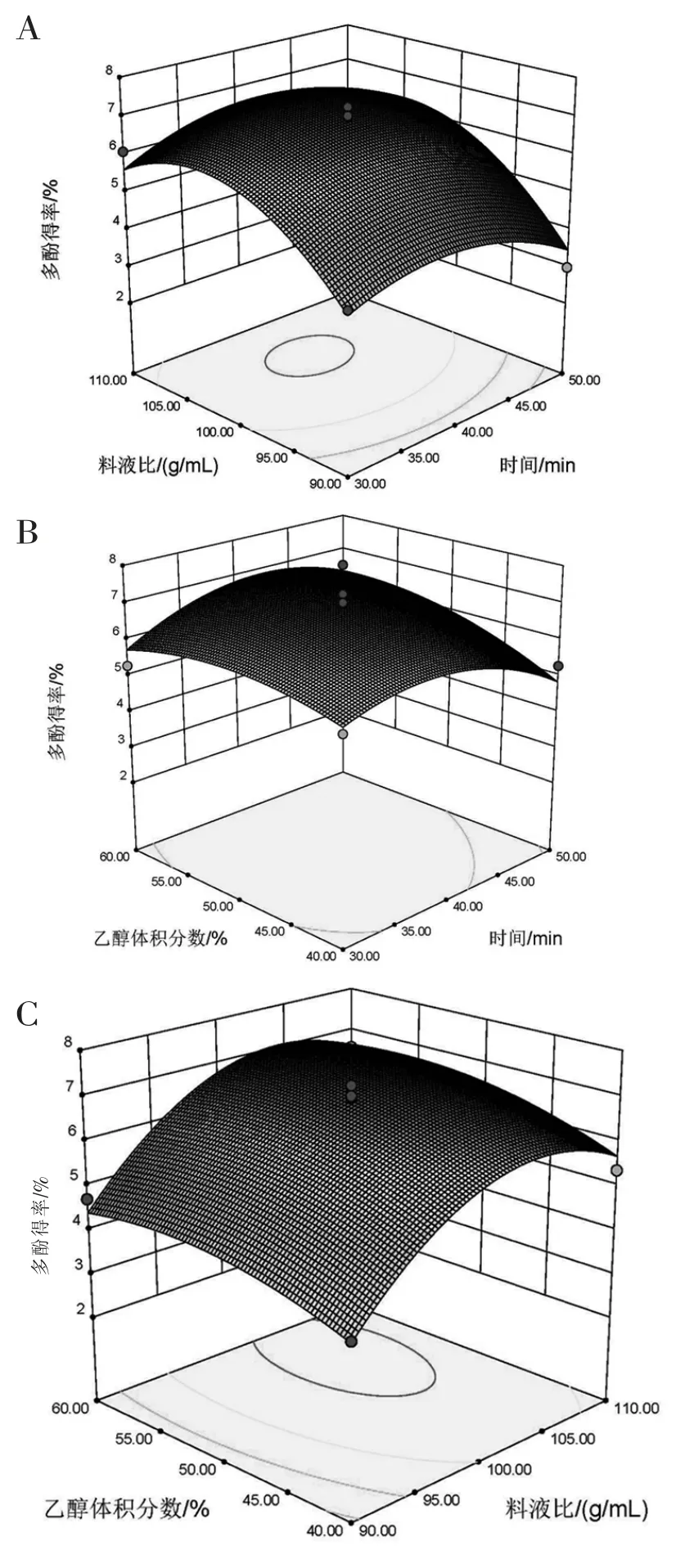
图5 各交互因素对多酚得率影响的响应面
2.3.4 验证试验 根据响应面法得到尼泊尔酸模根部多酚的最佳提取工艺为:超声时间41.50 min,料液比 1∶104.13(g/mL),乙醇体积分数 55.37%,其多酚得率的预测值为7.21%。 为方便实际生产试验过程中应用操作,将以上操作条件简化为:超声时间 42 min,料液比 1:104(g/mL),乙醇体积分数55%,进行三次平行操作取平均值,得到尼泊尔酸模根部多酚的平均得率为7.24%, 其与预测值(7.21%)的标准偏差为0.41%。
2.4 抗氧化活性检测 尼泊尔酸模根部多酚提取液抗氧化活性检测结果如图6 所示。 羟自由基清除能力和DPPD 自由基清除能力与Vc 的变化趋势基本一致,随着多酚含量的减少清除率降低。同时多酚提取液的清除活性略低于Vc。 经过计算, 尼泊尔酸模根部多酚的羟自由基和DPPH 自由基的清除率IC50值分别为0.36 mg/mL 和0.28 mg/mL,表明其具有较好的抗氧化活性。
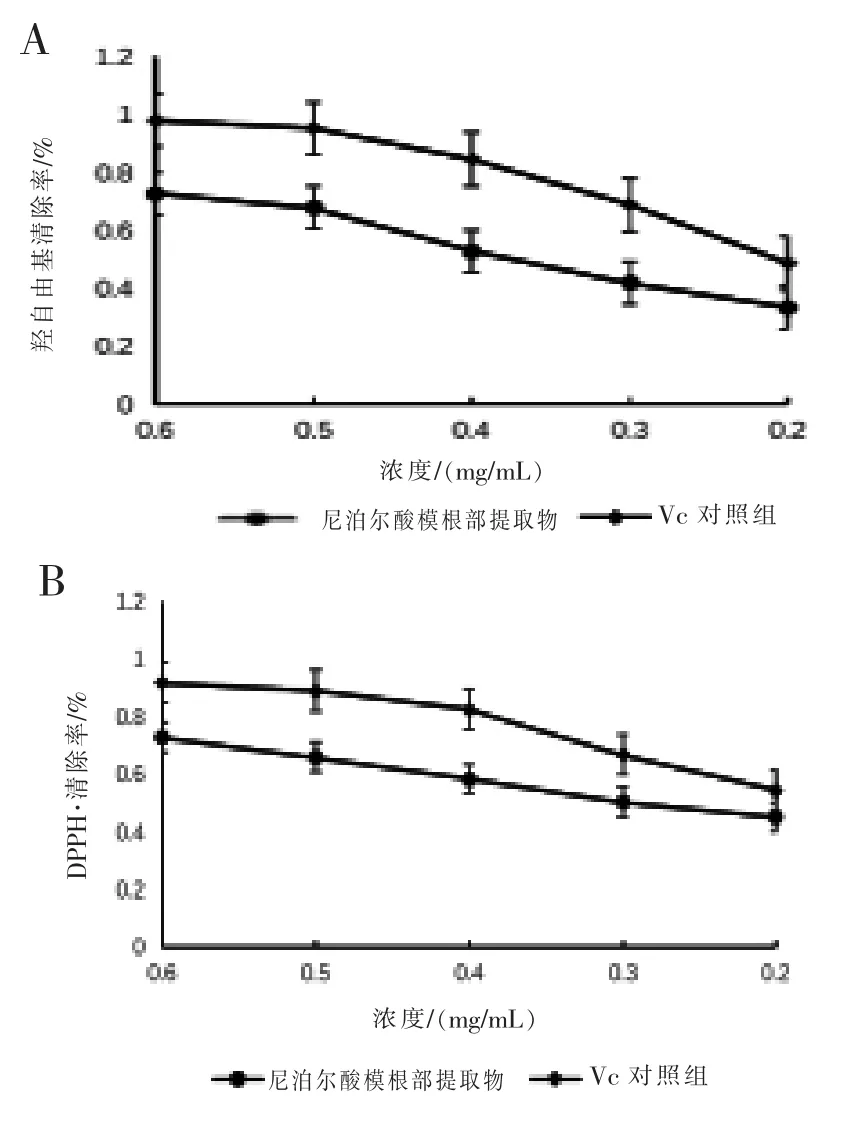
图6 多酚提取物和抗坏血酸对羟自由基及DPPH 自由基清除试验
3 结论
尼泊尔酸模根部多酚提取的最佳条件为超声时间 42 min,料液比 1∶104(g/mL),乙醇体积分数55%,此时多酚得率为7.24%,与预测得率7.21%的标准偏差为0.41%,说明优化的工艺可靠。提取物对羟自由基和DPPH 自由基的清除率IC50值分别为0.36 mg/mL 和0.28 mg/mL,表明其具有较好的抗氧化活性。 研究结果可为尼泊尔酸模的进一步开发利用提供理论参考。

