柠檬乌梅提取液预防肾草酸钙结石作用机制的研究
林馥嘉 欧财文 柯培锋 陈曲波 徐建华
广东省中医院检验科,广州 510120
随着现代社会人们的生活方式改变及日常工作中心理压力的上升,肾结石患者的发病率已经呈现了逐年攀升的态势,我国肾结石患者发病率为1%~5%[1-2]。肾结石主要是泌尿系统的一种非常常见的多发性疾病,是摆在我们面前的一大难题。因此,在积极治疗泌尿系结石患者的同时,重视和加强对结石病变的预防和复发措施也是必不可少的。
本研究拟通过建立动物实验型,探讨柠檬乌梅提取液对预防肾草酸钙结石的协同作用机制,为进一步临床预防肾结石以及开发新药提供理论基础依据。
材料与方法
1、实验动物
SPF级雄性Wistar大鼠50只,体质量200~250 g,由广州中医药大学动物研究中心进行提供。
2、仪器与试剂
日立7180全自动分析仪和配套的化学试剂,Olympus光学显微镜,白洋牌常规离心机,良平电子天平,超速离心机(Eppendorf,离心半径为11 cm),石蜡切片机(德国莱卡),pH计(梅特勒-托利),乙二醇和氯化铵(天津市天力化学试剂有限公司),兔抗骨桥蛋白(OPN)的多克隆动物抗体和动物免疫组化SP试剂盒(北京博奥森生物技术有限公司)。
3、柠檬乌梅提取液提取
首先取新鲜的柠檬100 g,洗净,置于2 000 ml大小的烧瓶中,加二次性温开水800 ml,煮沸60 min,过滤。滤渣首先加二次性清水600 ml,煮沸40 min,过滤。合并两次柠檬过滤液,浓缩后即可形成一种具有可溶性生药浓度含量范围大约为0.05 g/ml的中性柠檬原液,用高速离心机对原液进行离心(16 000 r/min,离心半径为11 cm)10 min,取出柠檬上清液,即柠檬提取液。取新鲜乌梅100 g,洗净,放入2 000 ml大小的烧杯中,加二次性温开水800 ml,煮沸60 min,过滤。滤渣再加二次性清水600 ml,煮沸40 min,过滤。合并两次上清过滤液,浓缩后即可形成一种生药浓度含量范围大约为0.05 g/ml的乌梅上清原液,用高速离心机对原液进行离心(16 000 r/min,离心半径为11 cm)10 min,取出乌梅上清液,即乌梅提取液。两种提取液混合摇匀得柠檬乌梅提取液。
4、建立肾草酸钙结石模型和给药
参照曹正国等[3]研究者的建模方法,选择分组使用SPF级雄性Wistar大鼠50只,在适应环境变化条件下连续饲养3 d后,按随机数字表法分为5组,每组10只,设立A组(对照组)、B组(成石组)、C组(柠檬提取液组)、D组(乌梅提取液组)、E组(柠檬乌梅提取液组)。参照《中药药理研究方法学》计算剂量,A组大鼠以自来水作为日常饮用水,每天用纯净水灌胃;B组以含1%乙二醇+2%氯化铵的自来水作为日常饮用水,每天用纯净水灌胃;C、D、E组在B组的基础上每天分别以柠檬提取液、乌梅提取液、柠檬乌梅提取液灌胃;连续喂养4周。
5、检测指标和检测方法
第30天收集24 h尿液,检测尿量、尿钙(尿Ca2+)、尿尿酸(尿UA)、尿肌酐(尿Cr)、尿草酸(尿OX)检测;第30天,20%浓度的乌拉坦(0.7 ml/kg)进行腹腔麻醉后,下腔静脉采血3~5 ml,离心后取上清液,全自动生化分析仪检进行测大鼠血中肌酐(血Cr)、尿素氮(尿BUN)、钙(血Ca2+)、磷(血P)的含量;第30天,切取肾脏做冰冻切片,偏光显微镜下进行观察,记录肾脏组织结晶的情况及肾小管扩张的情况;第30天,留取肾脏,采用10%中性福尔马林固定肾脏组织制成3μm的石蜡切片,脱出石蜡后入水,使用免疫组化和苏木素复染,制片,显微镜下即可观察结果,病理软件分析OPN含量结果。
6、统计分析方法
本文采用SPSS 17.0统计软件对所有组间参数数据进行统计分析,其中所有组间参数等计量资料均符合正态分布,用(±s)表示,组间差异用独立样本t检验,结晶评分及OPN强度评分用秩和检验进行统计学分析,以P<0.05表示差异有统计学意义。
结 果
1、各组大鼠24 h尿液的相关结果
各组大鼠24 h尿液的相关结果如表1所示:B组的24 h尿量明显低于其他各组,结果数据差异有统计学意义(P<0.01),C组和D组的24 h尿量明显低于A组,结果数据差异均有统计学意义(均P<0.01),E组的24 h尿量也明显低于A组,结果数据差异有统计学意义(P<0.05),C组、D组、E组3组的24 h尿量相比,结果数据差异无统计学意义(P>0.05)。E组尿液pH的测定结果比B组高,结果数据差异有统计学意义(P<0.05),其余各组相比差异变化不大,结果数据差异无统计学意义(P>0.05)。B组、C组和D组的24 h尿Ca2+结果明显高于A组和E组,结果数据差异均有统计学意义(均P<0.01),A组、E组的24 h尿Ca2+结果相比差异不大,结果数据差异无统计学意义(P>0.05)。B组、C组、D组、E组的24 h尿OX结果明显高于A组,结果数据差异均有统计学意义(均P<0.01),与B组相比,C组和D组的24 h尿OX含量减少,结果数据差异均有统计学意义(均P<0.05),E组24 h尿OX的含量明显降低,结果数据差异有统计学意义(P<0.01),C组和D组的24 h尿OX高于E组,结果数据差异均有统计学意义(均P<0.05)。B组、C组、D组的24 h尿UA结果明显高于A组,结果数据差异均有统计学意义(均P<0.01),与A组相比,E组的24 h尿UA增高,结果数据差异有统计学意义(P<0.05),C组、D组和E组的24 h尿UA结果明显低于B组,结果数据差异均有统计学意义(均P<0.01)。B组的24 h尿Cr明显低于A组、C组和E组,结果数据差异均有统计学意义(均P<0.01),低于D组,结果数据差异有统计学意义(P<0.05),C组和D组的24 h尿Cr低于A组,结果数据差异均有统计学意义(均P<0.05),C组和D组的24 h尿Cr低于E组,结果数据差异均有统计学意义(均P<0.05),A组和E组的24 h尿Cr变化不大,结果数据差异无统计学意义(P>0.05)。
表1 各组大鼠24 h尿液尿量、尿pH值、尿Ca2+、尿OX、尿UA、尿Cr比较(±s)
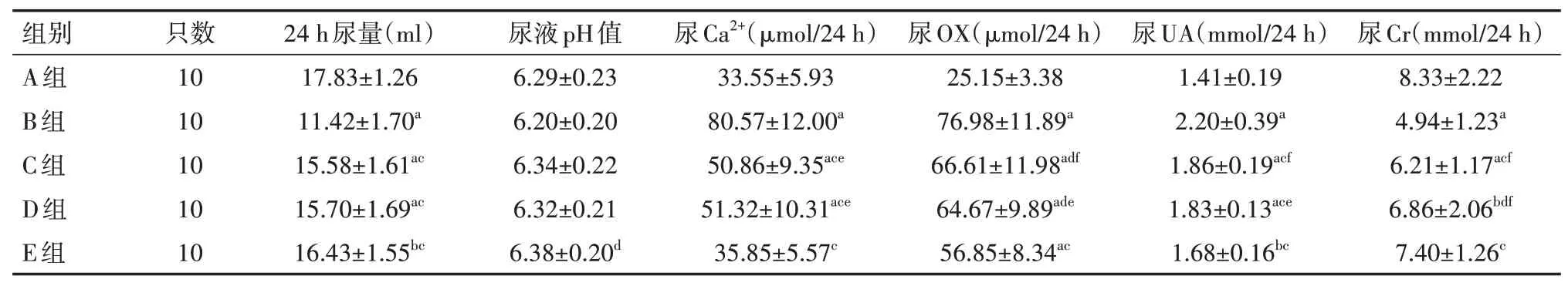
表1 各组大鼠24 h尿液尿量、尿pH值、尿Ca2+、尿OX、尿UA、尿Cr比较(±s)
注:A组大鼠以自来水作为日常饮用水,每天用纯净水灌胃;B组以含1%乙二醇+2%氯化铵的自来水作为日常饮用水,每天用纯净水灌胃;C、D、E组在B组的基础上每天分别以柠檬提取液、乌梅提取液、柠檬乌梅提取液灌胃;OX为草酸,UA为尿酸,Cr为肌酐;与A组相比,a P<0.01,b P<0.05;与B组相比,c P<0.01,d P<0.05;与E组相比,e P<0.01,f P<0.05
?
2、各组血液的相关生化指标结果
各组的大鼠血液相关生化指标测定结果如表2所示:B组的相关生化大鼠血液BUN明显高于其他各组,差异有统计学意义(P<0.01),与A组相比,C组、D组和E组的相关生化大鼠血BUN明显增高,差异均有统计学意义(均P<0.01),C组、D组、E组3组的相关生化大鼠血BUN相比,差异无统计学意义(P>0.05)。B组的大鼠血液Cr明显高于其他各组,差异有统计学意义(P<0.01),与A组相比,C组、D组和E组的血Cr明显增高,差异均有统计学意义(均P<0.01),C组和E组的大鼠血Cr相比,差异无统计学意义(P>0.05),D组和E组的大鼠血Cr相比,差异有统计学意义(P<0.05)。各组大鼠的血Ca2+和血P的检测结果比较,差异均无统计学意义(均P>0.05)。
表2 各组大鼠血BUN、血Cr、血Ca2+、血P比较(±s)

表2 各组大鼠血BUN、血Cr、血Ca2+、血P比较(±s)
注:A组大鼠以自来水作为日常饮用水,每天用纯净水灌胃;B组以含1%乙二醇+2%氯化铵的自来水作为日常饮用水,每天用纯净水灌胃;C、D、E组在B组的基础上每天分别以柠檬提取液、乌梅提取液、柠檬乌梅提取液灌胃;BUN为尿素氮,Cr为肌酐,P为磷;与A组相比,a P<0.01,b P<0.05;与B组相比,c P<0.01;与E组相比,d P<0.05
?
3、各组大鼠肾脏病理切片中草酸钙晶体结果
草酸钙结晶在HE及Van-Kossa,s染色病理切片上呈现黑褐色。A组的大鼠没有看到任何草酸钙结晶沉积和肾小管不见任何扩张(图1A);B组镜下多数肾小管腔内均存在连续片状结晶,部分肾小管存在连续的团状结晶,可以清楚地看到见肾小管管腔明显的扩张(图1B);C组、D组和E组镜下即可观察,小部分肾小管管腔扩张,肾小管管腔中偶尔可见一定量的点状散布草酸钙结晶,偶尔也可见成为片状结晶,草酸钙结晶沉积和肾小管管腔扩张等情况均显著较B组改善(图1C)。结晶分级见表3,根据表3数据,采用多个单独样品进行比较的Kruskal-Wallis H检验,可以确定各组肾小管的结晶差异有统计学意义(P<0.05);其中A组无结晶形成,B组结晶最明显。相对B组,C组、D组和E组各组含有少量的草酸钙结晶。C组、D组和E组组间比较,采用Kruskal-Wallis H检验,E组与C组和D组组间肾小管结晶差异均有统计学意义(均P<0.05),C组与D组组间肾小管结晶差异无统计学意义(P>0.05)。
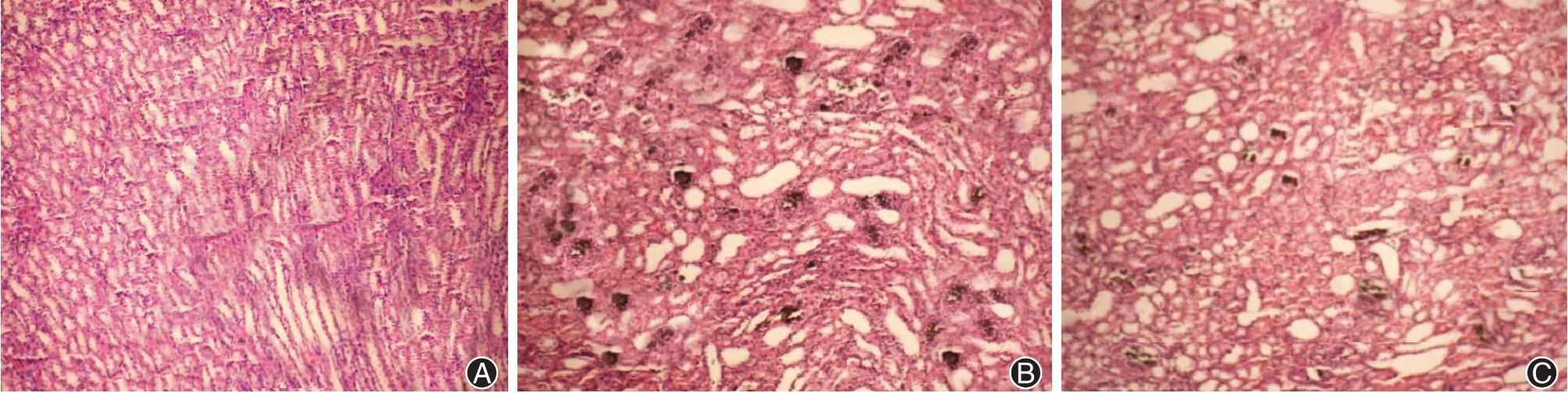
图1 各组大鼠肾脏病理切片中草酸钙晶体结果。A:A组,HE染色,×200;B:B组,HE及Van-Kossa,s染色,×400;C:C组、D组、E组,HE及Van-Kossa,s染色,×400

表3 各组大鼠肾小管草酸钙结晶分级(只)
4、各组大鼠肾脏OPN结果
OPN在各组大鼠的肾脏组织中均有表达,实验发现在肾近曲小管和远曲小管、亨利氏袢、集合导管(主要髓袢升支)上表达最为突出,在皮质肾小球中反而未发现有OPN的表达。A组大鼠只能检测到OPN微量表达(图2A),但是B组大鼠肾组织中OPN表达则明显增强(图2B),C组、D组和E组大鼠肾组织中OPN表达强度高于A组、低于B组(图2C)。各组大鼠OPN表达强度比较见表4,根据表4数据,采用多个组的独立组对样本分组进行定量比较的方法Kruskal-WallisH检验,可以得出确定各组肾小管OPN表达强度差异有统计学意义(P<0.05),其A组的OPN表达最少,B组的OPN表达最明显,C组、D组、E组的OPN表达强度次之。C组、D组和E组组间比较,采用Kruskal-Wallis H检验,统计结果为C组、D组和E组组间的OPN表达差异无统计学意义(P>0.05)。
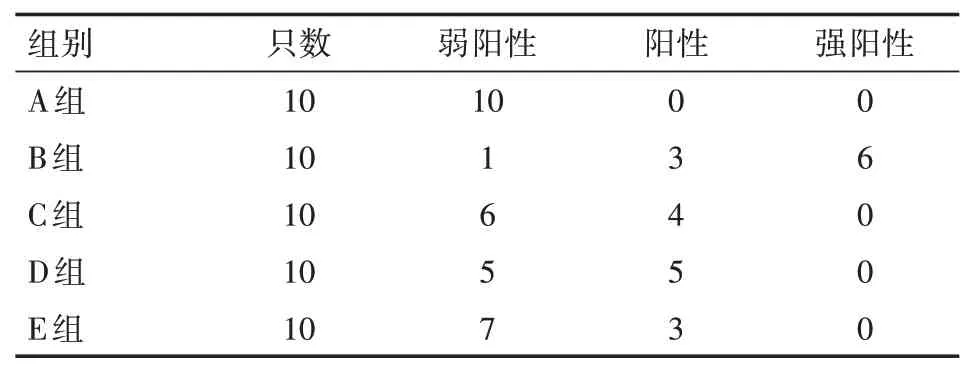
表4 各组大鼠OPN表达强度(只)
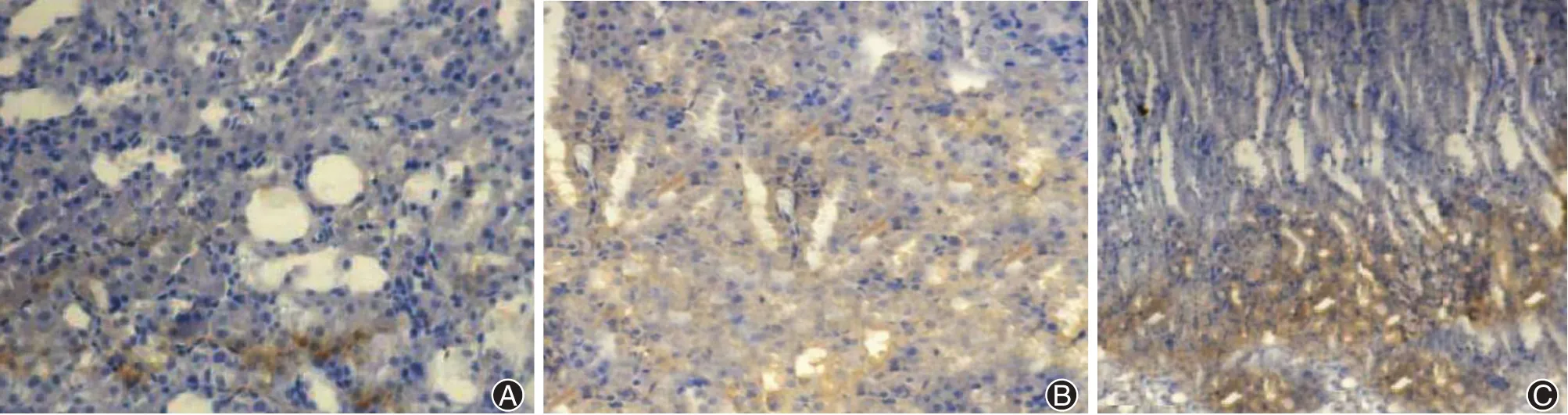
图2 各组大鼠肾脏OPN结果。A:A组髓质OPN(×400);B:B组髓质OPN(×400);C:C组、D组、E组髓质OPN(×400)
讨 论
肾结石的形成是一个复杂而隐匿的过程,多年来众多学者提出了许多学说,如肾钙斑学说、基质学说、免疫损伤学说等[4]。目前研究认为,肾结石的形成是一个多因素互相作用的结果,其中包括促进因素,如基因易感性、体内物质代谢异常、肾解剖异常[5],也包括柠檬酸、磷酸盐、OPN等抑制因素[6-8]。肾结石主要成分包括草酸钙结石(70%)、磷酸钙结石(10%)、尿酸钙结石(17%)及胱氨酸结石等[1]。草酸钙结石最为常见,草酸钙结石的全年发病率大概为每年占我国泌尿系结石总发病患者全年发病率的60%~80%[4],研究解决草酸钙结石临床形成机制问题尤其具有重要的学术科学性和重要临床意义。
近几年,国外学者通过对比结石患者饮用可乐、咖啡、苏打水、柠檬酸饮料及正常饮食对结石形成作用的研究显示,饮用柠檬酸饮料的尿量升高、尿枸橼酸浓度增加、草酸钙饱和度减低,尿酸浓度降低,降低了结石复发率等[9-10]。临床系统评价也显示柠檬预防肾结石的有效性[11],且无不良作用。蔷薇科杏属植物乌梅为多年生草本植物,乌梅叶、果、根等均可入药,传统用于治疗久咳、久泻、虚热烦渴、痢疾、便血、尿血等症[12]。商英成等[13]通过雄性大鼠动物学模型研究了乌梅对草酸钙晶体生长的抑制影响,发现乌梅提取液在草酸钙晶体中的生成过程中具有抑制性作用,且其抑制性作用也会随乌梅提取液中含水量和浓度的减少而进一步增加。
本实验研究结果表明,柠檬提取液、乌梅提取液和柠檬乌梅提取液都可以显著降低肾结石大鼠尿液Ca2+、尿液OX、尿液UA等水平,提高尿液pH水平,增加大鼠的排尿量,提高Cr排泄,能有效抑制肾脏组织草酸钙结晶的形成,降低血BUN和Cr含量。给予柠檬提取液、乌梅提取液和柠檬乌梅提取液后,组织病理学检测结果发现,肾脏组织内草酸钙结晶显著程度减少,未见良性肾小管明显厚度增大和小管扩张,OPN表达强度降低。通过分析原因,可能是柠檬和乌梅中的枸橼酸与钙离子发生络合反应,减轻了肾脏的损伤,保护肾功能。通过OPN表达实验结果分析,柠檬乌梅提取液可能通过降低肾脏OPN的表达来抑制大鼠草酸钙结晶的形成。而且C组、D组、E组的实验结果分析显示,柠檬提取液、乌梅提取液和柠檬乌梅提取液都能降低尿Ca2+,但柠檬乌梅提取液降低尿液Ca2+的功能明显较强;柠檬提取液、乌梅提取液和柠檬乌梅提取液都能降低尿OX含量,但柠檬乌梅提取液降低尿液OX的功能明显较强;柠檬提取液、乌梅提取液和柠檬乌梅提取液都能降低尿UA含量,但柠檬乌梅提取液降低尿液UA的功能明显较强;柠檬提取液、乌梅提取液和柠檬乌梅提取液都能降低大鼠血液BUN的含量,且降低大鼠血BUN的功能一致;柠檬提取液、乌梅提取液和柠檬乌梅提取液都能降低大鼠血液Cr的含量,柠檬提取液和柠檬乌梅提取液降低大鼠血Cr的功能一致,而柠檬乌梅提取液降低大鼠血Cr的功能比乌梅提取液好。通过肾小管草酸钙结晶分级结果,柠檬乌梅提取液抑制肾小管结晶生成能力比柠檬提取液、乌梅提取液强。分析其原因可能为柠檬和乌梅的协同作用,增强了枸橼酸与钙离子发生络合反应,大大减轻了肾小管草酸钙结晶的生成。
综上所述,柠檬乌梅提取液能有效抑制大鼠草酸钙肾结石的形成,但柠檬乌梅提取液的有效活性成分和其更多的功能还有待进一步研究。
利益冲突所有作者均声明不存在利益冲突

