人参皂苷Rg3调控Dickkopf相关蛋白3对肝癌细胞增殖和凋亡的影响
胡珊珊, 王少文, 蒋 磊
(安徽省第二人民医院, 安徽 合肥 230000)
肝癌是常见的恶性肿瘤之一,具有高发病率、预后差以及病死率高等特点。最新研究显示,我国肝癌患者的发病人数每年超过30万,严重的危害患者生命健康[1]。既往研究证实,手术切除仍然是治疗早期肝癌的最佳方式,但是由于肝癌患者早期临床症状表现不明显,导致多数患者发现时已经为中晚期,85%以上的患者无法进行手术切除治疗[2]。因此,寻找有效的抗肿瘤药物对于肝癌治疗一直是研究的热点。人参皂苷Rg3(Ginsenoside Rg3,G-Rg3)是人参皂苷中有效的抗肿瘤活性成分之一,能够抑制肺癌、胃癌、肝癌等细胞增殖,对患者具有良好的治疗作用[3,4]。但是目前有关G-Rg3对肝癌细胞增殖、凋亡的影响及其作用机制尚不完全清楚。Dickkopf相关蛋白3(Dickkopf-related protein3,DKK3)是属于Dickkopf家族成员之一,研究发现,在肝癌患者癌组织中DKK3表达降低,过表达DKK3能够促进肝癌细胞HepG2凋亡[5]。以上研究表明,DKK3在肝癌患者疾病进展中发挥重要作用,但是有关DKK3在肝癌细胞增殖和凋亡中的调控机制以及药物干预研究较少。因此,本实验拟通过体外培养人肝癌细胞系HepG2,观察G-Rg3能否通过调控DDK3表达,从而抑制肝癌细胞增殖,促进细胞凋亡,以期为G-Rg3临床治疗肝癌提供新的作用机制。
1 材料与方法
1.1细胞与试剂:人肝癌细胞系HepG2(中国科学院上海细胞生物研究所);人参皂苷Rg3(上海钰博生物科技有限公司,批号:14197-60-5);Annexin V-FITC细胞凋亡试剂盒(美国Sigma公司,批号:4030ES20);噻唑兰(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT)检测试剂盒(江苏碧云天生物技术公司,批号:C0009S);细胞裂解液、胰酶、蛋白酶抑制剂、蛋白marker、二辛可宁酸(bicinchoninic acid,BCA)试剂盒、牛血清白蛋白(Bovine albumin,BSA)粉末、一抗稀释液、二抗稀释液、显影液检测试剂盒、羊抗兔IgG抗体(批号:A0239)、羊抗鼠IgG抗体(批号:A0192)、DKK3抗体(批号:ab36898)、Wnt抗体(批号:ab8805)、β-连环蛋白(β-catenin)抗体(批号:ab38449)、β-actin抗体(批号:AF5001)购自上海碧云天生物技术公司。
1.2仪器:TWK-FST32型细胞匀浆仪(武汉泰普拓公司);Micro17R型高速冷冻离心机(赛默飞世尔科技(中国)有限公司);GPJ9-TS100-F型倒置荧光显微镜(日本尼康(Nikon)公司);FC型全自动多功能酶标检测仪(赛默飞世尔科技(中国)有限公司);1658033型电泳仪(美国伯乐Bio-Rad公司);ChemiDoc XRS+成像系统(美国Bio-Rad公司)。
1.3肝癌细胞培养与分组:HepG2细胞采用10% 胎牛血清(fetal bovine serum,FBS)的杜尔贝科的改良鹰培养基(dulbecco's modified eagle medium,DMEM)并置于37 ℃、5% CO2的细胞培养箱内培养,贴壁生长,待生长融合度达80~90%时,倾去培养基,磷酸盐缓冲溶液(Phosphate buffer solution,PBS)润洗2次,采用0.25%的胰蛋白酶消化3 min至细胞呈现卵圆形,10% FBS的DMEM细胞培养基终止消化,进行传代处理。实验分为:对照组(Control)、人参皂苷Rg3组(G-Rg3)、人参皂苷Rg3+Dickkopf相关蛋白3无关片段组(G-Rg3+DKK3-NC)以及人参皂苷Rg3+Dickkopf相关蛋白siRNA组(G-Rg3+DKK3-siRNA)。其中G-Rg3组细胞给予G-Rg3(40mg/L)干预48h;G-Rg3+DKK3-NC组细胞转染DKK3-NC 24h后,G-Rg3干预48h;G-Rg3+DKK3-siRNA组细胞转染DKK3-siRNA后,G-Rg3干预48h;Control组细胞正常培养。
1.4MTT法测定肝癌细胞活力:将消化后的HepG2细胞按照96孔板密度为:1×104/孔接种,按照细胞实验分组进行相关处理,每组设置6个复孔,重复实验6次,G-Rg3干预处理48h,每孔加入MTT溶液10μL(5mg/mL)继续培养4h,终止培养,弃去细胞上清,每孔加入150μL的二甲基亚砜(Dimethyl sulfoxide,DMSO)震荡10min,酶标仪设定波长为570nm检测各孔的吸光度值,以光密度(optical density,OD)值反应细胞的增殖活力。
1.5流式细胞术检测肝癌细胞凋亡:细胞转染DKK3-NC或是DKK3-siRNA 24h后,G-Rg3干预处理48h,收集各组细胞,PBS润洗3遍,离心后倾去细胞液,细胞重悬并将浓度调整为1×105/mL。按照Annexin V-FITC凋亡检测试剂盒说明书操作,在488 nm处,分别激发525 nm和620 nm带孔滤波器,检测FITC和碘化丙啶(propidium iodide,PI)荧光,从而得到4组肝癌细胞的凋亡情况。
1.6蛋白质免疫印迹(Western blot)法检测DKK3、Wnt和β-catenin表达:收集各组细胞;4℃条件下裂解30 min,期间每隔5 min震荡1次;BCA法测定蛋白质浓度;凝胶电泳;湿转转膜;上样;用5%脱脂牛奶室温封闭2 h,孵育对应抗体DKK3(1∶1000)、Wnt抗体(1∶1000)、β-catenin抗体(1∶1000)以及β-actin抗体(1∶2000),4℃过夜,孵育对应的羊抗兔IgG抗体或者羊抗鼠IgG抗体(1∶5000)1~2h;摇床摇晃并加TPBS洗涤3次,5min/次,然后加入显影液,显影并拍照。DKK3、Wnt和β-catenin蛋白表达水平以目的蛋白条带灰度值与β-actin灰度值相比反映。
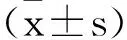
2 结 果
2.1G-Rg3对肝癌细胞增殖的影响:MTT检测显示,与Control组相比,G-Rg3组细胞活力明显从0.65±0.14下降至0.41±0.12(P<0.01)。与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞活力明显从0.41±0.12升高至0.58±0.10(P<0.05),见图1。

图1 G-Rg3对肝癌细胞增殖的影响
2.2G-Rg3对肝癌细胞凋亡的影响:流式细胞术检测显示,与Control组相比,G-Rg3组细胞凋亡指数明显从(5.6±1.3)%升高至(44.3±7.5)%(P<0.01)。与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞凋亡指数明显从(44.3±7.5)%降低至(15.2±6.3)%(P<0.01),见图2。
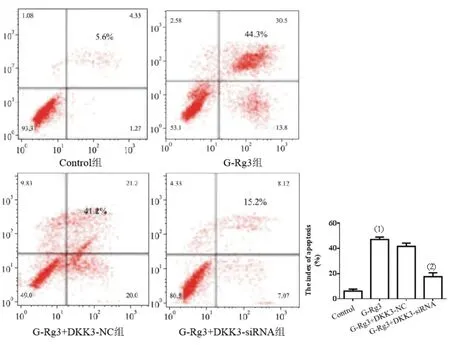
图2 G-Rg3对肝癌细胞凋亡的影响
2.3G-Rg3对肝癌细胞DKK3表达的影响:与Control组相比,G-Rg3组细胞DKK3蛋白相对表达量明显从1.00±0.10升高至2.35±0.28(P<0.01)。与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞DKK3蛋白相对表达量明显从2.35±0.28降低至1.14±0.15(P<0.01),见图3。
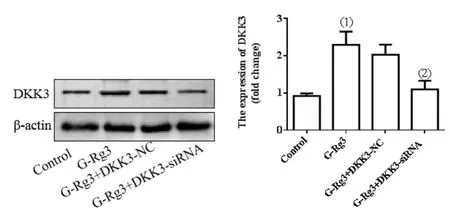
图3 G-Rg3对肝癌细胞DKK3表达的影响
2.4G-Rg3对肝癌细胞Wnt、β-catenin表达的影响:与Control组相比,G-Rg3组细胞Wnt、β-catenin蛋白相对表达量明显从1.00±0.09和1.0±0.14分别降低至0.35±0.06和0.38±0.05(P<0.01)。与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞Wnt、β-catenin蛋白相对表达量明显从0.35±0.06和0.38±0.05分别升高至0.91±0.14和0.75±0.23(P<0.05或P<0.01),见图4。

图4 G-Rg3对肝癌细胞Wnt、β-catenin表达的影响
3 讨 论
G-Rg3是从红参中提取的四环三萜皂苷活性单体。既往研究显示,G-Rg3能够通过抑制多种肿瘤细胞增殖、迁移,促进肿瘤细胞凋亡等发挥抗肿瘤作用[6]。但是目前有关G-Rg3对肝癌细胞增殖和凋亡的作用机制尚不完全清楚。因此,本研究拟采用体外培养人肝癌细胞系HepG2,探究G-Rg3对细胞增殖和凋亡的影响及其作用机制。
本研究首先观察G-Rg3对肝癌细胞增殖和凋亡的影响。MTT与流式细胞术实验结果显示,与Control组相比,G-Rg3组HepG2细胞增殖显著降低,细胞凋亡指数明显升高,表明G-Rg3能够抑制肿瘤细胞增殖,促进凋亡,与以往研究结果一致。DDK3表达与多种肿瘤发展密切相关,DKK3能够充当抑制剂作用,发挥抗肿瘤活性[7]。为此,本实验推测,G-Rg3可能是通过促进DKK3表达,从而发挥抑制肝癌细胞增殖、促进细胞凋亡的作用。结果显示,与Control组相比,G-Rg3组肝癌细胞增殖显著降低,凋亡显著升高。本研究结果再一次证实,DKK3表达与G-Rg3抑制肝癌细胞增殖、促进细胞凋亡相关。以往研究发现,DKK3表达下调是子宫内膜宫颈癌预后的不良标志[8],那么DKK3是否是G-Rg3抑制肝癌细胞增殖、促进凋亡的关键蛋白呢?本研究通过细胞转染DKK3 siRNA进一步观察G-Rg3对肝癌细胞增殖和凋亡的作用。Western blot结果显示,与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞DKK3表达显著降低,DKK3 NC组无显著变化,表明转染DKK3 siRNA成功。MTT检测显示,与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞增殖显著升高。流式细胞术检测显示,与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞凋亡指数显著降低。以上研究表明,G-Rg3能够通过促进DKK3表达,从而抑制肝癌细胞增殖,促进细胞凋亡。Wnt/β-catenin信号通路是调控细胞凋亡、增殖以及细胞外基质稳定的重要途径,在调控肿瘤细胞凋亡过程中发挥重要作用[9]。DKK3作为Wnt/β-catenin信号通路的关键调节蛋白,被认为是Wnt信号传导的抑制因子[10]。在结直肠癌细胞系HCT116中DKK3表达下调,过表达DKK3能够抑制Wnt/β-catenin活化促进肿瘤细胞凋亡[11]。为此,本实验通过调控DKK3观察G-Rg3对Wnt/β-catenin信号相关蛋白表达的影响。结果显示,与Control组相比,G-Rg3组细胞Wnt、β-catenin表达均显著降低。与G-Rg3组相比,G-Rg3+DKK3-siRNA组细胞Wnt、β-catenin表达均显著增加。本研究结果与既往研究结果一致。
综上所述,G-Rg3能够抑制肝癌细胞增殖,促进凋亡,其机制与促进DKK3表达,抑制Wnt/β-catenin信号传导相关。

