miR-93-5p靶向DUSP8基因对糖尿病肾病足细胞损伤的影响
顾 勇, 杨 艳, 李 娜, 王 艳, 张 姣, 杜 婷, 范小平
(1.武警陕西省总队医院消化内分泌科, 陕西 西安 7100002.陕西省人民医院内分泌科, 陕西 西安 710000)
糖尿病肾病(diabetic nephropathy)是糖尿病患者的主要微血管并发症之一,也是终末期肾病的主要病因[1]。肾素-血管紧张素抑制剂是临床上治疗糖尿病肾病十分广泛的药物,其具有降低血糖和血压的双重作用[2,3]。由于糖尿病肾病的发病机制尚未完全阐明,所以针对该病的精准治疗药物仍处于研发阶段。微小RNA(MicroRNA,miRNA)是一种长度约17~23个核苷酸的内源性非编码RNA,其通过调控靶基因的蛋白翻译过程参与人类疾病的发生发展[4]。越来越多的证据表明miRNAs的失调可能参与了糖尿病肾病的发生发展[5]。有研究报道,miR-93-5p参与高糖诱导的小鼠系膜细胞的增殖、迁移和侵袭过程[6],但是miR-93-5p参与糖尿病肾病进展的机制是否与DUSP8有关尚未清楚。本研究拟以人肾小球足细胞HPC为研究对象,观察miR-93-5p、DUSP8对高糖诱导HPC细胞炎性因子分泌、凋亡的影响,揭示二者之间的靶向关系,为糖尿病肾病的治疗提供理论依据。
1 材料与方法
1.1材料:人肾小球足细胞HPC购自美国菌种保藏中心;microRNA反转录试剂盒购自美国Applied Biosystems;肿瘤坏死因子α(Tumor Necrosis Factor-alpha,TNF-α)检测试剂盒、白介素6(interleukin6,IL-6)检测试剂盒购自北京康为世纪公司;LipofectamineTM3000购自日本TaKaRa公司;荧光素酶报告检测试剂盒购自美国Promega公司;膜联蛋白V-异硫氰酸荧光素-碘化丙锭(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒购自北京索莱宝公司;实时荧光定量反转录聚合酶链式反应(qRT-PCR)试剂盒购自上海碧云天研究所;Genesys 10紫外分光光度计购自美国Thermo公司;流式细胞仪购自美国贝克曼。
1.2方 法
1.2.1细胞培养:HPC培养条件:RPMI 1640培养基混合10%胎牛血清,37℃饱和湿度的恒温培养箱培养,每2天换液一次。将HPC细胞随机分成NG组(5mM高糖处理)、HG(6h、12h、24 h)组(25mM高糖处理)、miR-con组(转染miR-con)、miR-93-5p组(转染miR-93-5p mimics)、anti-miR-con组(转染anti-miR-con)、anti-miR-93-5p组(转染anti-miR-93-5p mimics)、HG+ si-con组(转染si-con)、HG+ si-DUSP8组(转染si-DUSP8)、HG+miR-93-5p+pcDNA组(共转染miR-93-5p mimics和pcDNA)、HG+miR-93-5p+ pcDNA-DUSP8组(共转染miR-93-5p mimics和pcDNA-DUSP8)。其中HG+ si-con组(转染si-con)、HG+ si-DUSP8组(转染si-DUSP8)、HG+miR-93-5p+pcDNA组(共转染miR-93-5p mimics和pcDNA)、HG+miR-93-5p+ pcDNA-DUSP8组(共转染miR-93-5p mimics和pcDNA-DUSP8)组需要在确认转染成功后,进行25mM高糖处理12 h。需要转染的细胞使用LipofectamineTM 3000试剂与质粒或DNA混合后与细胞共同培养10 h,然后更换培养基继续培养48 h,结束后用qRT-PCR实验检测转染效率。转染效率至少达到35%确定为转染成功。否则,更管条件继续转染,直至达到要求方可用于后续研究。
1.2.2qRT-PCR实验:使用一步法Trizol液提取细胞中总RNA,通过分光光度计评估RNA的质量。结束后,使用microRNA反转录试剂盒将RNA反转录为cDNA,-20℃保存,作为模板。使用qRT-PCR试剂盒进行扩增。扩增程序设置为94℃预变性2min;94℃,30s;60℃,30s;72℃,30s进行42循环扩增,延伸温度72℃,5min。最后以GAPDH和U6作为内参,使用2-ΔΔCT法计算miR-93-5p、DUSP8的相对表达量。引物信息为:miR-93-5p:正向引物:ACACTCCAGCTGGGCAAAGTGCTGTTCGTGC,反向引物:CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCTGC;DUSP8:正向引物:tgacccaaaacggaataagc,反向引物:agagatgccagccagacagt。GAPDH和U6使用通用引物。每个样品做3个复孔,实验重复3次。
1.2.3ELISA实验:收集需要检测的细胞,离心取上清。按照白介素6(IL-6)检测试剂盒、肿瘤坏死因子α(TNF-α)检测试剂盒的操作说明书操作,检测IL-6、TNF-α的含量。每个样品做3个复孔,实验重复3次。
1.2.4WB实验:用裂解溶液处理待检测的细胞,并提取细胞总蛋白,再将蛋白进行定量变性处理。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳把蛋白聚集在琼脂胶上,并用转膜仪将蛋白转移至PVDF膜,进行封闭处理。将兔抗DUSP8单抗 (1∶1000)、兔抗Cleaved caspase-3单抗 (1∶1000)、兔抗Bax单抗(1∶800)、兔抗Bcl-2单抗(1∶500)稀释,用各个蛋白的稀释液4℃孵育过夜。再将膜浸入辣根过氧化物酶标记的二抗溶液中,37℃孵育2h。最后对蛋白进行显色,分析。每个样品做3个复孔,实验重复3次。
1.2.5Annexin V/ FITC双染细胞凋亡检测实验:收集需要检测的细胞,PBS充分清洗,离心,弃上清,再用 500 μL 结合缓冲液悬浮细胞,然后在避光条件下先加入5 μL的 Annexin V/ FITC,避光孵育10 min后再加入5 μL的PI,避光反应15 min。结束后在1h内上流式细胞仪检测分析细胞凋亡情况。细胞总凋亡率(%)=早期凋亡率+晚期凋亡率。每个样品做3个复孔,实验重复3次。
1.2.6双荧光素酶报告实验:通过在线预测网站starbase(https://starbase.sysu.edu.cn)预测到DUSP8与miR-93-5p之间存在互补结合靶点。将含有野生型DUSP8-WT(含有野生结合位点)或DUSP8-MUT(不含野生结合位点的突变体)的DUSP8片段克隆至pGL3荧光载体,构建荧光素酶报告基因载体。将HPC细胞接种24孔板,培养24h,然后将miR-NC、miR-93-5p、anti-miR-NC、anti-miR-93-5p与报告质粒用LipofectamineTM 3000转染至HPC细胞。转染后培养48h,使用荧光素酶试剂盒检测细胞的荧光素酶活性。
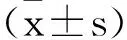
2 结 果
2.1高糖诱导HPC细胞miR-93-5p、DUSP8表达:结果如图1和表1所示,与NG组相比,HG 6h组、HG 12h组、HG 24h组HPC细胞miR-93-5p表达均显著降低,DUSP8的mRNA和蛋白表达均显著升高(P<0.05)。

图1 高糖诱导HPC细胞中DUSP8蛋白表达图
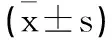
表1 高糖诱导不同时间的HPC细胞miR-93-5p DUSP8的表达
2.2高糖诱导HPC细胞的炎症因子分泌和凋亡:结果如图2和表2所示,与NG组相比,HG 6h组、HG 12h组、 HG 24h组IL-6、TNF-α的含量均显著升高,Cleaved caspase-3、Bcl-2的蛋白表达均显著降低,Bax的蛋白表达均显著升高,细胞凋亡率均显著升高(P<0.05)。故选用高糖处理12 h的细胞最合适。
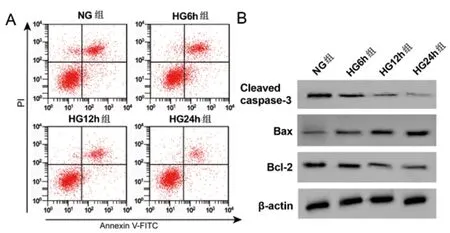
图2 高糖诱导HPC细胞凋亡图及凋亡相关蛋白表达
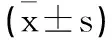
表2 高糖诱导不同时间HPC细胞炎性因子分泌量和凋亡率
2.3过表达miR-93-5p调控高糖诱导HPC细胞炎性因子分泌、凋亡:结果如表3所示,与NG组相比,HG组细胞miR-93-5p、Cleaved caspase-3、Bax蛋白表达显著降低,IL-6、TNF-α含量、Bcl-2蛋白、凋亡率均显著升高(P<0.05);与HG+ miR-con组相比,HG+ miR-93-5p组细胞miR-93-5p、Cleaved caspase-3、Bax蛋白显著升高,IL-6、TNF-α含量、Bcl-2蛋白、细胞凋亡率均显著降低,如图3,(P<0.05)。
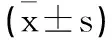
表3 过表达miR-93-5p的高糖诱导HPC细胞炎症因子分泌凋亡率
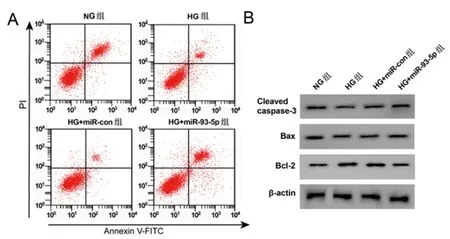
图3 过表达miR-93-5p的高糖诱导细胞凋亡及相关蛋白表达
2.4miR-93-5p靶向DUSP8:通过生物信息学预测软件预测到miR-93-5p与DUSP8 3'UTR存在互补的结合位点,如图4A。荧光报告实验结果见表4,相较于miR-con组,miR-93-5p组WT-DUSP8细胞的荧光活性显著降低(P<0.05)。与miR-con组相比,miR-93-5p组细胞DUSP8蛋白表达显著降低,与anti-miR-con组相比,anti-miR-93-5p组细胞DUSP8蛋白表达显著升高(P<0.05),如图4B、表5。
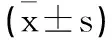
表5 miR-93-5p调控DUSP8的表达
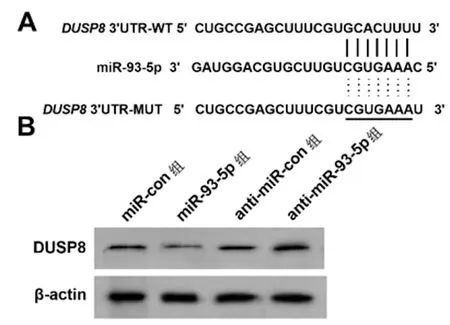
图4 miR-93-5p靶向调控DUSP8
表4 双荧光素酶报告实验结果
2.5沉默DUSP8调控高糖诱导HPC细胞炎症因子分泌、凋亡:与NG组相比,HG组细胞DUSP8蛋白表达、IL-6、TNF-α含量、Bcl-2蛋白、凋亡率均显著升高(P<0.05),Cleaved caspase-3、Bax蛋白显著降低(P<0.05);与HG+si-con组相比,HG+si-DUSP8组细胞DUSP8蛋白表达、IL-6、TNF-α含量、Bcl-2蛋白表达、细胞凋亡率均显著降低(P<0.05),Cleaved caspase-3、Bax蛋白表达显著升高(P<0.05)。见图5、表6。
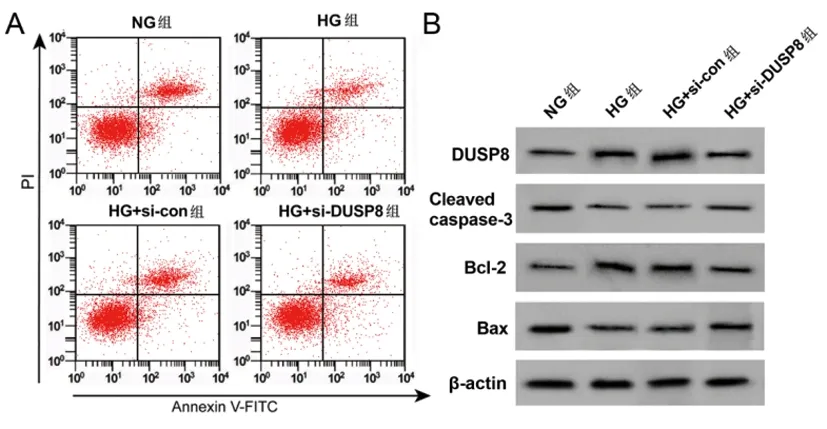
图5 沉默DUSP8的高糖诱导HPC细胞凋亡图及相关蛋白图
表6 沉默DUSP8对高糖诱导HPC炎症因子分泌凋亡的影响
2.6过表达DUSP8表达部分逆转转染miR-93-5p表达对高糖诱导HPC细胞的调控作用:与HG+miR-con组相比,HG+miR-93-5p组细胞DUSP8蛋白、IL-6、TNF-α含量、Bcl-2蛋白、凋亡率均显著降低(P<0.05),Cleaved caspase-3、Bax蛋白显著升高(P<0.05);与HG+miR-93-5p+pcDNA组相比,HG+miR-93-5p+pcDNA-DUSP8组细胞DUSP8蛋白、IL-6、TNF-α含量、Bcl-2蛋白、细胞凋亡率均显著升高(P<0.05),Cleaved caspase-3、Bax蛋白表达显著降低(P<0.05)。见图6、表7。
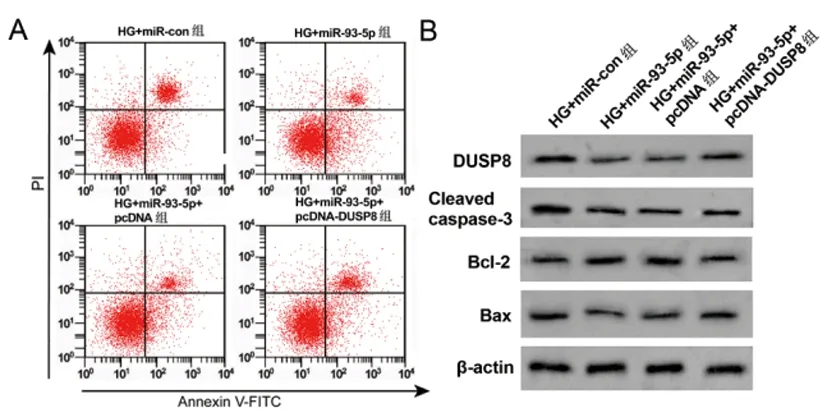
图6 高糖诱导HPC细胞凋亡及相关蛋白表达

表7 过表达DUSP8逆转转过表达miR-93-5p对高糖诱导HPC细胞炎症因子分泌凋亡的调控
3 讨 论
miRNA是一类长度为18-25个核苷酸的单链RNA,这些RNA不编码蛋白质,但可通过降解靶标的mRNA或阻止mRNA翻译为蛋白质,抑制编码基因在转录后水平的表达,从而参与疾病的病理生理过程,包括糖尿病的发生[7]。miR-93-5p在高糖诱导的人肾小管上皮HK-2细胞中异常降低,其作为lncRNA X失活特异性转录本(XIST)的下游因子,细胞周期蛋白依赖性激酶抑制剂1A (CDKN1A)的上游调控因子发挥抑制糖尿病肾病中肾间质纤维化作用[8]。近期,有报道miR-93-5p能够通过靶向HGF增强肝癌细胞的胰岛素抵抗力,进而调节糖尿病的进展[9]。然而,miR-93-5p对高糖环境下足细胞的生存影响及机制尚未发现研究。本研究为了探究miR-93-5p在糖尿病肾病足细胞中的功能,在体外用高糖诱导人足细胞HPC,监测高糖处理(6、12、24h)时HPC细胞中miR-93-5p的表达情况发现,miR-93-5p的表达水平随着高糖处理时间的延长而降低;炎性因子IL-6、TNF-α的含量随高糖处理时间的延长而升高,凋亡抑制基因Cleaved caspase-3、Bcl-2的表达随高糖处理时间的增长而降低,凋亡促进基因Bax的表达随高糖处理时间的延长而增加,与Yang[8]的研究结果相呼应,与Zhou[9]在肝癌中的实验结果相悖。这些实验结果说明在高糖诱导的足细胞损伤模型中miR-93-5p发生降低,炎性因子分泌增加,细胞凋亡率受到抑制,说明高糖诱导的足细胞损伤模型的最适处理时间为12h。进一步研究,过表达miR-93-5p后,受损的HPC细胞miR-93-5p表达升高,IL-6、TNF-α的含量也降低,细胞凋亡率也发生明显下降,伴随Cleaved caspase-3、Bcl-2的表达升高,Bax表达降低。这揭示了miR-93-5p在受损足细胞中的保护作用,暗示其在糖尿病肾病足细胞中的潜在治疗价值。深入探究发现,miR-93-5p还与DUSP8之间存在互补的靶向关系,并通过荧光报告实验验证,于是推测这可能与miR-93-5p保护足细胞损伤有关。
DUSP8是近两年新发现的一个参与糖尿病病理生理进程的重要基因。DUSP8是第一个全基因组关联分析鉴定的基因,其主要在大脑中表达,与人类糖尿病的发展有关[10]。有研究发现[11],DUSP8是二型糖尿病(T2D)的风险因子,其与男性下丘脑胰岛素抵抗相关,并且在T2D患者的漏斗核中表达增加;通过DUSP8敲除小鼠、DUSP8拯救DUSP8敲除小鼠的表型研究,揭示了DUSP8在肥胖环境中对系统性糖耐量和胰岛素敏感性的重要调控作用。最近,Peter等[12]发现,DUSP8作为糖尿病风险等位基因,在控制人类或小鼠摄取甜味高热量食物和糖类消耗方面具有积极作用。于是,本实验假设DUSP8参与高糖环境下足细胞的损伤过程。本研究发现,DUSP8在高糖诱导的足细胞中的表达异常升高,IL-6、TNF-α的含量上升,Cleaved caspase-3、Bcl-2蛋白表达降低,Bax的蛋白表达升高,并且沉默DUSP8能够明显的减轻高糖引起的足细胞的上述变化。此外,过表达DUSP8还能够明显的抑制过表达miR-93-5p对高糖引起的足细胞的炎性因子分泌和凋亡抑制作用。
综上所述,miR-93-5p抑制高糖诱导人足细胞的炎症反应和凋亡,其产生这种功能的机制与其靶向抑制DUSP8相关,为糖尿病肾病的靶向治疗提供新靶点。

