双特异性磷酸酶基因家族表达与肝细胞性肝癌进展的临床相关性研究
张 艳, 刘成元, 吴旭东, 陈 进
(江苏省盐城市第一人民医院, 江苏 盐城 224000)
肝细胞性肝癌(HCC)在全世界范围内被列为新发癌症病例的第五大原因,也是导致男性癌症死亡的第二大原因 ,慢性肝病如病毒性肝炎、酒精及非酒精性脂肪性肝病是其主要病因。外科手术、介入、靶向及免疫治疗是目前HCC治疗的主要手段,但HCC治疗后复发与转移率仍高,患者总体预后仍差。因此,更好地了解HCC发生发展的分子机制,挖掘潜在的治疗靶点,对于HCC的诊治具有重要意义。双特异性磷酸酶(DUSPs)属于一个家族,成员包括DUSP1-28,其编码的蛋白质主要负责通过选择性去磷酸化丝裂原活化蛋白激酶(MAPKs)参与多种生物学功能的信号转导包括蛋白泛素化、蛋白酶体降解、氧化、磷酸化、甲基化等[1]。研究表明DUSPs与肿瘤的进展有关:如DUSP1、6高表达于乳腺癌组织,并与乳腺癌患者的术后复发与转移风险增加有关;在功能上,差异化表达的DUSPs可能通过诱导上皮间质转化、调节乳腺癌细胞干性促进乳腺癌的发生发展[2]。但DUSPs在HCC中是否存在差异性表达及其临床意义仍未得到研究。本研究通过HCC公共数据与本院临床病理数据分析,明确在mRNA和蛋白水平上癌与癌旁组织差异性表达的DUSPs,分析其与临床病理特征、预后、免疫细胞浸润的相关性,并进一步探讨差异性表达的DUSPs在HCC发生发展中的生物学功能。以期为HCC的诊断与治疗提供新的靶点。
1 资料与方法
1.1公共数据来源与分析:本研究中,HCC癌与癌旁组织中差异化表达的DUSPs首先通过Oncomine数据库(https://www.oncomine.org/)进行初步筛选,具有统计学差异的DUSPs进一步通过GEPIA(http://gepia.cancer-pku.cn/)数据库进行验证[3]。统计学方法采用T检验,P<0.05代表差异具有统计学意义。通过GEPIA初步明确差异化表达的DUSPs与HCC患者总生存率(OS)的关系,再进一步通过Kaplan-Meier plotter (http://kmplot.com/analysis/) 数据库进行验证与亚组分析[4,5]。统计学方法采用Log rank检验,P< 0.05代表差异具有统计学意义。从TCGA(https://portal.gdc.cancer.gov/)数据库下载HCC患者临床特征与转录组数据,通过二分类回归检验差异化表达的DUSPs与HCC患者年龄、性别、病理分级、肿瘤分期的关系[6];并通过COX比例风险模型分析DUSPs与HCC患者OS的独立相关性,P<0.05代表差异具有统计学意义。基因富集分析(GSEA)软件(https://www.gsea-msigdb.org/gsea/index.jsp)用于预测DUSPs在HCC发生发展中的生物学功能。TIMER(https://cistrome.shinyapps.io/timer/)数据库用于进一步分析差异化表达的DUSPs与肝癌组织中不同免疫细胞浸润程度及免疫检查点相关分子表达的相关性,相关性系数r表示相关性大小,P<0.05代表结果具有统计学差异[7]。
1.2临床资料:收集本院2016年1月至2018年12月经手术切除HCC的癌与癌旁配对组织,记录HCC患者的性别、年龄、AFP定量值、肿瘤分级、分期。肿瘤的病理分级采用Edmondson分级法,根据肿瘤细胞的分化程度分为I~IV。肿瘤的TMN分期采用第八版AJCC分期标准,根据肿瘤大小、侵犯程度分为I~IV期。
1.3免疫组化分析:配对的癌与癌旁组织中的DUSP12表达采用免疫组化(IHC)的方法进行染色。DUSP12一抗购自Sigma-Aldrich,货号为HPA008840,二抗购自中杉金桥,货名为免疫组化通用型试剂盒,货号为PV-6000;一抗稀释比例1∶50,免疫组化步骤按照商品试剂盒说明书进行。染色完成后,每张切片在显微镜下5个高倍视野下(200x)进行DUSP12阳性细胞的观察计数。
1.4统计分析:GraphPad7.0用来处理本院收集病历的临床、病理及DUSP12基因蛋白表达的数据,两组间DUSP12基因蛋白表达差异采用T检验进行分析,P<0.05代表差异具有统计学意义。
2 结 果
2.1DUSP基因家族在HCC患者癌与癌旁组织中的mRNA表达差异:Oncomine检索DUSP基因家族在不同癌症中癌与癌旁组织中的表达差异如图1所示:在HCC中,DUSP1、DUSP2、DUSP5、DUSP6、DUSP10、DUSP12 mRNA在癌与癌旁组织中表达存在差异;进一步通过GEPIA对上述差异表达的DUSPs进行验证,结果如图2所示,与正常组织相比,DUSP1、5、6 mRNA仍在HCC的肿瘤组织中低表达 (P<0.05),而DUSP12则仍高表达于HCC肿瘤组织(P<0.05)。

图1 基于Oncomine数据库的DUSP基因家族在泛癌癌与癌旁组织中的mRNA表达差异。

图2 基于GEPIA数据库的HCC差异DUSP基因家族mRNA表达验证
2.2DUSP基因家族的mRNA差异化表达与HCC患者预后及临床特征的关系:GEPIA批量分析了DUSP基因家族与HCC患者OS的关系,结果显示DUSP10、DUSP11、DUSP12、DUSP13、DUSP14、DUSP23的mRNA表达与患者OS生存率有关(图3A)。结合mRNA差异化表达结果,我们发现在DUSP基因家族中,DUSP12不仅在HCC的癌组织中高表达,同时高表达该基因的患者OS下降(HR:2,Log rank P:0.00017)。Kaplan-Meier plotter绘制的OS生存曲线也验证出高表达DUSP12的HCC患者OS下降(HR:1.82,logrank P:0.00091),亚组分析结果显示高表达DUSP12对HCC患者OS的影响独立于种族(白种人或亚洲人)、肿瘤分期(Ⅰ+Ⅱ期或Ⅲ+Ⅳ期)、饮酒(不饮酒或饮酒)、病毒性肝炎(无病毒性肝炎或病毒性肝炎)(图3B-G)。进一步,我们从TCGA数据库中下载HCC患者临床与转录组数据,采用多因素COX风险比例回归模型分析DUSP12 mRNA表达对患者OS的影响,结果如表1所示,多元COX分析结果提示DUSP12 mRNA基因表达水平与患者OS下降独立相关(HR:1.123,95%CI:1.049~1.203)。在临床特征的比较中,表2显示DUSP12 mRNA表达水平与肿瘤的病理分级正相关(OR:2.904,95%CI:1.871~4.554)。

表1 基于TCGA数据库的DUSP12与HCC患者OS的uniCox与mutiCox分析

表2 基于TCGA数据库的DUSP12与HCC患者临床病理特征的相关性分析

图3 DUSP基因家族的mRNA表达与HCC患者OS的关系
2.3DUSP12在HCC发生发展中的功能富集分析:从TCGA数据库中获取的转录组数据进一步通过GSEA软件进行针对DUSP12的基因功能富集分析(KEGG),结果如下图4所示,共筛选得到5条显著上调的通路:包括嘌呤代谢、SNARE相关囊泡运动、剪接体、细胞周期、卵母细胞减数分裂,及5条显著下调的通路:包括初级胆汁酸合成、视黄醇代谢、CYP450代谢、补体与凝血级联反应、缬氨酸/亮氨酸/异亮氨酸降解。
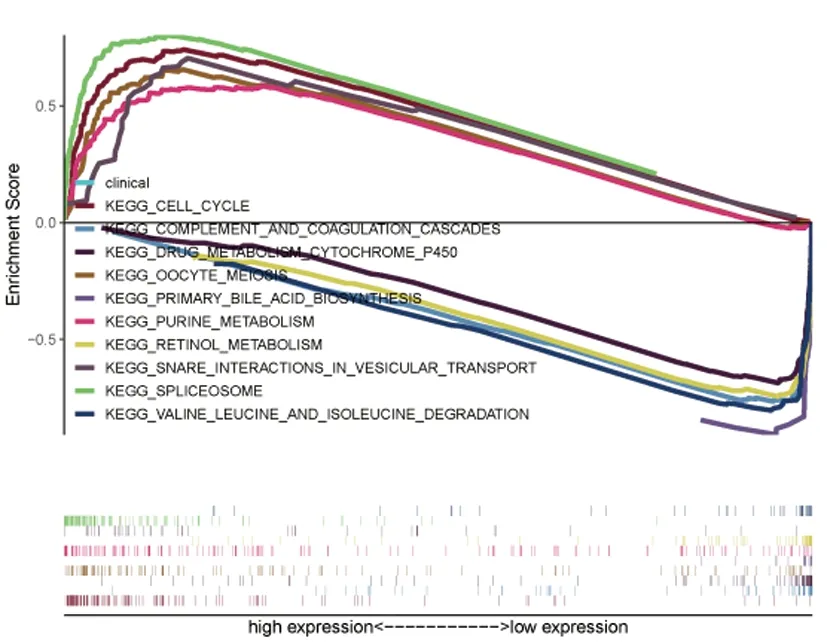
图4 DUSP12在HCC发生发展中的功能富集分析
2.4DUSP12 mRNA与HCC患者的肿瘤组织免疫细胞浸润程度及免疫检查点相关分子mRNA表达的相关性:在线工具网站TIMER分析结果如表3所示,通过纯度矫正后,DUSP mRNA表达量与肿瘤组织内B细胞(r= 0.422)、CD8+T细胞(r= 0.285)、CD4+T细胞(r= 0.359)、巨噬细胞(r= 0.396)、中性粒细胞(r= 0.337)、树突状细胞(r= 0.406)的浸润程度正相关,并且DUSP mRNA表达量也与免疫检查点分子:CTLA4、HAVCR2、LAG3、CD274、CD276、TIGIT、C10ORF54的表达升高有关。
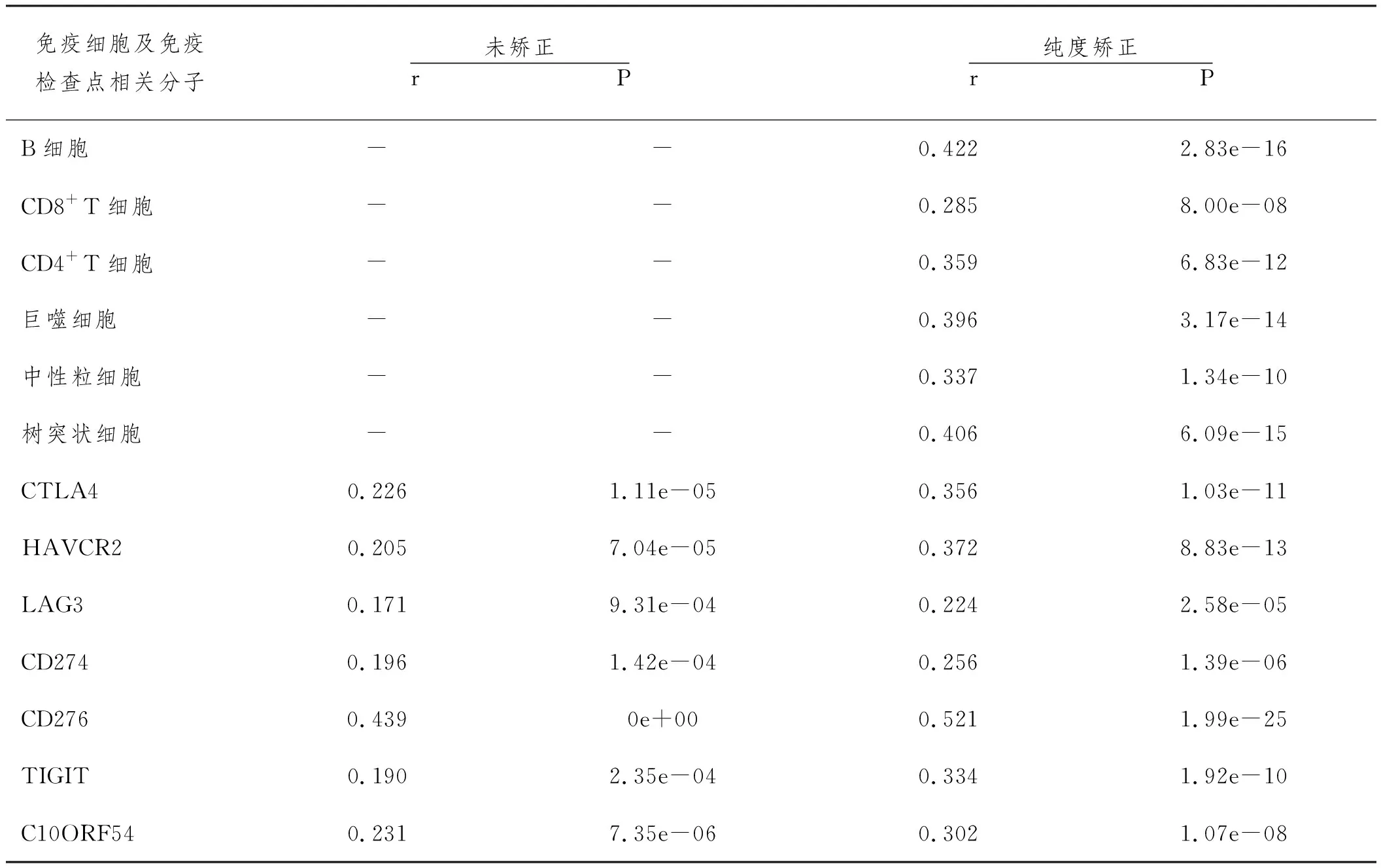
表3 基于TIMER的DUSP12与HCC患者肿瘤组织免疫细胞浸润程度及免疫检查点相关分子mRNA表达的相关性
2.5DUSP12蛋白在HCC患者中的差异化表达及其与临床特征的相关性:本院入组19例HCC患者,一般临床病理资料如表4所示。分析结果如图5所示,DUSP12蛋白在HCC癌组织中明显高表达(P<0.001),并且与病理分级1与2级的患者相比,分级为3与4级的患者癌组织中DUSP12蛋白表达更高;与临床分期1期的患者相比,分期为2-4期的癌组织DUSP12蛋白表达更高(图5A-B)。
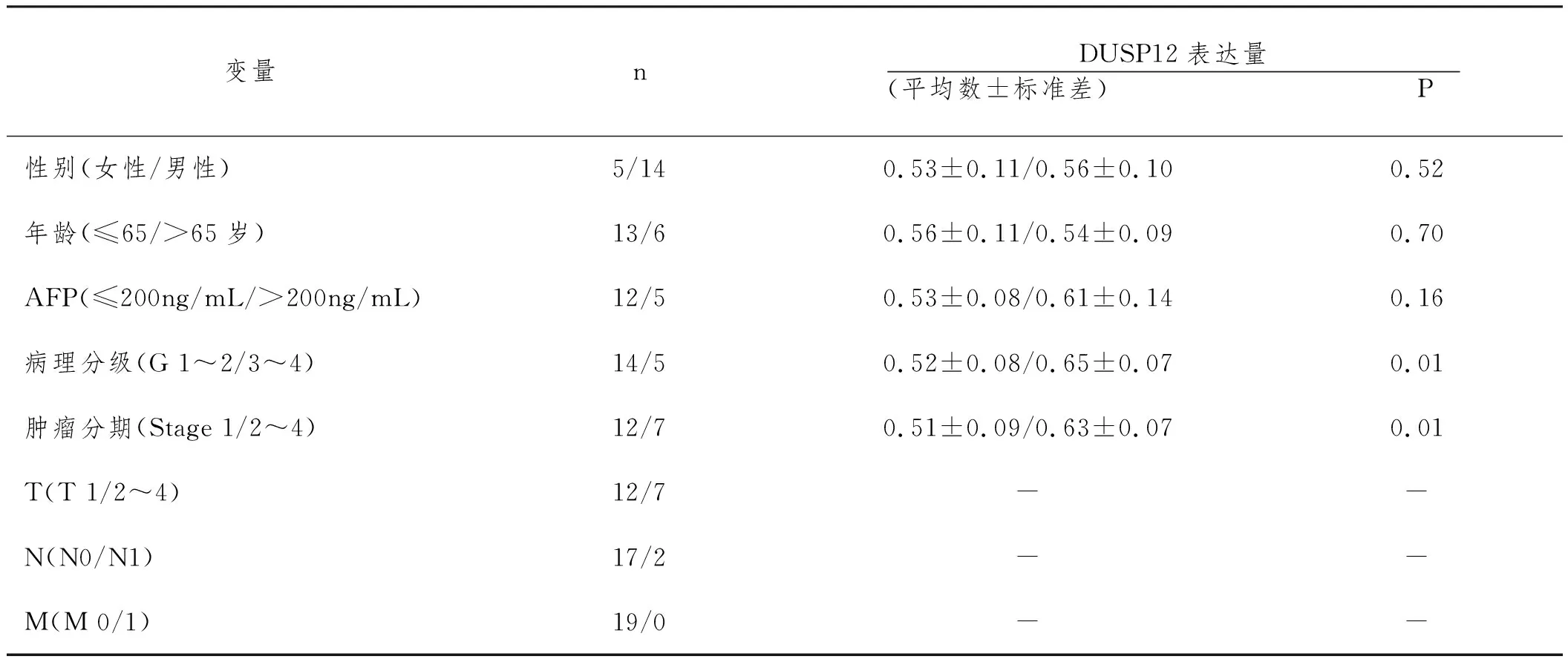
表4 验证队列中HCC患者的一般临床病理资料

图5 DUSP12蛋白在HCC癌与癌旁组织的差异化表达
3 讨 论
本研究通过结合公共数据挖掘与临床病理验证的方法明确了DUSP基因家族中的DUSP12在mRNA与蛋白水平上高表达于HCC癌组织。高表达DUSP12的HCC患者总生存率下降,并且DUSP12 mRNA表达水平与患者的病理学分级呈正相关关系。基因功能富集分析显示DUSP12参与HCC的发生发展过程的机制可能涉及嘌呤代谢、囊泡运动、剪接体、细胞周期信号调控通路的上调,及胆汁酸、视黄醇代谢、缬氨酸/亮氨酸/异亮氨酸降解信号调控通路的下调。在肿瘤免疫微环境中,DUSP12 mRNA表达水平与肿瘤内B细胞、T细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润程度及免疫检查点相关分子:CTLA4、HAVCR2、LAG3、CD274、CD276、TIGIT、C10ORF54的表达呈正相关关系。
此前有研究通过转录组分析慢性粒细胞白血病患者的差异化表达基因,结果显示DUSP12 mRNA高表达于肿瘤细胞 ,但该基因在HCC中的表达趋势目前并不清楚[8]。在本项研究中,我们在DUSP基因家族中仅发现DUSP12 mRNA在HCC癌组织中高表达并与患者总生存率下降有关,这提示DUSP12的基因表达可能在HCC的发生发展中发挥重要作用。DUSP基因家族是哺乳动物中调节MARKs活性最重要的磷酸酶类,通过去磷酸化MARKs激酶激活环内苏氨酸和/或酪氨酸残基的T-X-Y基序以调节MARKs的功能。通过调节MARKs的功能,DUSPs广泛参与肿瘤的发生发展过程,包括诱导DNA的甲基化及抑癌基因蛋白的泛素化,促进抑癌基因的失活及原癌基因的激活。DUSP12属于DUSPs家族的一员,研究显示DUSP12具有调控细胞周期从G0/G1期向G2/M期的转化,及抑制肝细胞凋亡的作用[9]。本研究中GSEA预测的DUSP12在HCC进展中的功能也与上述文献报道结果一致:DUSP12可能通过调控细胞周期相关分子的表达从而参与HCC的进展。
MAPKs包括c-Jun-NH2末端激酶(JNK)、p38 MAPK和细胞外信号调节激酶(ERK)。这些酶属于丝氨酸/苏氨酸蛋白激酶,在体内广泛参与调节各种细胞活动,包括增殖、分化、凋亡、存活、炎症和免疫[10]。已有大量研究显示DUSPs通过调节MAPKs的功能参与调控先天性及适应性免疫应答:如DUSP1已被发现是先天性免疫的主要调节因子,并参与适应性免疫中T细胞的激活;DUSP2和DUSP5参与炎症反应的活化,并被发现其是正常T细胞发育和功能所必需的调节因子[11]。基于DUSPs对于免疫系统的调节作用,我们也进一步推测DUSPs可能在HCC的免疫微环境形成中发挥作用。本研究中,我们发现肝癌组织中高表达的DUSP12与浸润的B细胞、T细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润程度正相关,并与免疫检查点相关分子的表达也呈正相关关系。这提示在HCC的发生发展中,DUSP12可能通过促进免疫细胞的浸润及诱导免疫细胞高表达免疫检查点分子介导肿瘤免疫抑制微环境的形成。
综上所述,本研究发现:在DUSP基因家族中,DUSP12显著高表达于HCC患者的癌组织,并与HCC患者的生存率下降、病理分级增加、免疫抑制微环境的产生有关。通过阐述DUSP12与HCC患者的临床关系,将为下一步进行DUSP12在HCC进展中的功能实验提供理论基础,并为未来HCC的治疗提供更多的靶点选择。

