牙髓干细胞静脉注射与联合髓芯减压治疗兔早期激素型股骨头坏死的对比研究
鲁 洋, 刘 飞, 王新民, 许 杰, 白玉玺, 吕 剑
(河北省秦皇岛市第一医院骨科, 河北 秦皇岛 066000)
股骨头坏死(Osteonecrosis of femoral head, ONFH)在临床上较为常见,多见于20~50岁的人群,如早期未及时治疗,患者2年内发生股骨头塌陷的几率可高达70%,严重影响患者的生活质量,由此可见早期干预对于ONFH患者预后的重要[1]。早期ONFH的保髋治疗方法众多,骨髓间充质干细胞(bone marrow stem cells, BMSCs) 移植治疗股骨头尚未塌陷的早期ONFH是目前公认的未见明显副反应且有效的方法。间充质干细胞(mesenchymal stem cells,MSCs)可促进坏死区骨组织的修复、减轻髋部疼痛症状、延缓病情进展[2]。本研究通过局部注射醋酸泼尼松龙建立兔激素性股骨头坏死模型,并将牙髓基质干细胞(dental pulp stem cells,DPSCs)分别以静脉注射及髓芯减压后隧道内注射两种方式给药,探讨不同给药方式的有效性,为临床治疗早期股骨头坏死提供实验依据。
1 材料与方法
1.1实验材料
1.1.1实验动物:健康成年雄性日本大耳兔47只,体重2.0~2.5Kg,免疫合格,饲养于恒温、恒湿环境中(湖北逸挚诚生物科技有限公司提供[SCXK(鄂)2016-0020],质量合格证号:42817300000855。由武汉云克隆龙科技股份有限公司饲养[许可证号:SYXK(鄂)2018-0069]。
1.1.2实验试剂、耗材及仪器:牙髓基质干细胞(dental pulp stem cells,DPSCs),DPSCs(北京泰盛生物科技有限公司提供,批号:S20200107),劈开牙齿用牙周刮匙剥出牙髓组织,转移到PBS的培养皿中进行清洁并将分离的组织切成小块。移入50mL离心管中,加入5mL(37℃)预热消化酶溶液,在37℃水浴中孵育60min。每10分钟用涡流管彻底分解组织。孵育后,加入3mL完全培养基使消化酶失活,通70μm细胞滤网得到单个悬浮细胞,然后以1200rpm离心10min,用1mL完全培养基复悬细胞。用10μL 0.4%台盼蓝细胞染色液稀释10μL细胞悬液,用细胞计数仪测定细胞浓度及活力。将3×106的细胞接入150mm培养皿中3h,然后用PBS轻轻冲洗培养皿三次,去除未附着的细胞。将10mL新鲜完全培养基放入培养基中,接种后7d更换完全培养基,然后继续培养7d。接种细胞后约10~14d,细胞生长为一个小簇并形成菌落。DPSCs传代培养:用3mL PBS洗涤体外扩增的原代培养细胞两次,并添加5mL胰蛋白酶/EDTA溶液以在150mm培养皿中在37℃下消化细胞3min。取5mL完全培养基灭活胰蛋白酶/EDTA溶液,移液至50mL离心管中,以1200rpm离心7min,吸取上清液,用完全培养基复悬。然后按上述方法计数细胞数,将3×106个细胞接种入150 mm培养皿,进一步扩增。待2~3d后,细胞融合度至80%~90%时进行传代。细胞培养至第六代,制备成单细胞悬液,备用。所用干细胞已经过细胞表面标志物鉴定证明为间充质干细胞;醋酸泼尼松龙:浙江仙琚制药股份有限公司 (批号181003);小动物称量称:中国凯丰集团有限公司KFS-C1;小动物剃毛器:宁波爱克利浦电器有限公司;3%戊巴比妥钠:Amresco;醋酸泼尼松龙:浙江仙琚制药股份有限公司 (批号181003)75%医用酒精武汉市活力消毒用品有限公司;活力碘:武汉市活力消毒用品有限公司;带线缝合针:上海金环;一次性使用无菌注射器:上海康德莱企业发展集团股份有限公司;颅骨钻:STR204;宠物X光机:江苏康派医疗宠物X光机;Micro-CT检测仪: 型号Skyscan1174 X-Ray Microtomograph(比利时Bruker公司)。
1.2分组:共采用健康成年日本大耳兔共47只,随机分为4组:A组(正常对照组),5只,同期饲养不做处理;B组(模型组),14只,右侧建立股骨头坏死模型后不进行治疗;C组(静脉注入DPSCs),14只,右侧建立股骨头坏死模型后,给予静脉应用干细胞;D组(隧道注入DPSCs),14只,右侧建立股骨头坏死模型后,减压隧道内注入牙髓干细胞。造模鉴定后剩下35只,A组5只,B、C、D组各10只。
1.3实验方法
1.3.1日本大耳兔股骨头坏死模型的制备:将健康雄性日本大耳兔47只,全部适应性喂养1周后,记为实验开始时间(Day 0)。采用Miyanishi法[3],B、C、D组右侧臀部肌注醋酸泼尼松龙8mg/kg,每周2次,连续注射6周,A组为空白对照组,于右侧臀部肌注等量生理盐水,每周2次,连续注射6周。同时,所有实验动物在左侧臀肌给予预防性应用青霉素8万单位/kg,预防感染,每周2次,连续注射6周。
1.3.2模型的鉴定:激素注射6周后(Day 42),建模完毕,从B、C、D组各随机抽取4只气栓处坏死并进行造模鉴定:取右侧股骨头组织行病理染色(HE染色),光镜下观察骨小梁、骨细胞、髓腔及造血细胞形态、结构和数量的变化,鉴定造模是否成功。骨小梁空骨陷窝、骨细胞核固缩、周围骨髓坏死、脂肪细胞和造血细胞坏死均为骨坏死(骨小梁正常而仅有骨髓坏死也被认为是骨坏死)。确定造模成功后进行下一步实验。
1.3.3干预方法及给药途径:将经过鉴定建模成功的B、C、D四组共30只大耳兔,每组10只,按不同分组分别给予相应处理:B组,不进行任何处理;C组,给予兔耳缘静脉注射DPSCs;D组,给予髓芯减压+ DPSCs移植。髓芯减压:3%戊巴比妥1mL/Kg行耳缘静脉注射麻醉,至麻醉后3~5min,剔除大转子部位毛发。俯卧位固定兔,充分暴露术区,消毒后以大转子下2~3cm为中心沿股骨方向做1.5cm切口,显露股骨粗隆,以环钻朝向股骨头方向,与股骨干成约70度角缓慢、间断钻孔,在X线透视监视下,保证隧道经过股骨颈到达股骨头并不穿出股骨头,隧道直径2mm,钻孔后用导针抽吸减压。干细胞治疗:于手术后即刻、手术后1周,术后2周共给予3次药物注射:髓芯减压后(Day 42),D组动物给予隧道内注入DPSCs 3×106细胞/只和等体积生理盐水,注射完毕后以骨蜡封闭隧道,以缝线在骨膜上缝合标记隧道口后缝合皮肤,无菌辅料包扎。于第一次注射后1周(Day 49)、2周(Day 56)再给予同样处理,第2、3次局部注射时,需对动物进行静脉麻醉,麻醉后以手按压皮下缝线确定减压孔,必要时行小切口,将药物或生理盐水注射进减压隧道。C组直接给予耳缘静脉注射DPSCs 3×106细胞/只。
1.4主要实验指标的采集
1.4.1X线检查:最后一次治疗结束后2周(Day 70)、6周(Day 98 处死前)行双侧股骨X线检查,观察正常侧、造模侧骨密度情况。于实验开始后14周末(Day 98)处死动物进行终末检测。
1.4.2大体形态观察:处死动物后即可取材观察股骨头、关节软骨的形态及色泽等,拍摄股骨大体照,随即置于固定液中保存。
1.4.3Micro CT检查:取右侧股骨头样本行Micro CT检测,电压50kV,电流800μA,以26.8μm扫描分辨率、1304×1024视野大小对兔股骨头进行扫描。将股骨软骨下骨连续150张切片,即厚度为4mm区域内的骨小梁设定为三维重建兴趣区域 (ROI),用N-Recon软件进行三维图像重建,用CT-AN软件进行三维分析,区域骨密度(BMD)测定。获得检测指标有:骨体积分数BV/TV(%)、骨小梁厚度Tb.Th(mm)、骨小梁数量Tb.N(1/mm)、结构模型指数SMI 、骨密度BMD(g/cm3)。在骨分解代谢大于骨合成代谢情况下,如发生骨质疏松时,Tb.N和Tb.Th数值减少。
1.4.4病理学检测:于CT检查后进行,股骨头标本采用 4%多聚甲醛液固定,5%硝酸脱钙,冠状面剖开取材,常规乙醇梯度脱水,石蜡包埋切片,染色后进行镜下检测。检测指标有:大体观察(骨小梁、骨细胞、髓腔及造血细胞形态、结构和数量的变化情况,鉴定造模是否成功);空骨陷窝率:HE染色后,每张切片在400倍视野下进行拍照选骨组织,任选6个视野,拍照时尽量让组织充满整个视野,保证每张照片的背景光一致,骨小梁区域无细胞核的骨组织陷窝为空骨陷窝,应用Image-Pro Plus 6.0软件以400倍标尺为标准,对每张照片的空骨陷窝与总的骨陷窝进行计数,每个视野计数50个骨陷窝,并对同一骨小梁区的空骨陷窝进行计数,空骨陷窝率=空骨陷窝数量/总的骨陷窝数量。骨小梁面积占比:对目的区域进100倍成像,尽量让组织充满整个视野,保证每张照片的背景光一致,成像完成后使用Image-Pro Plus 6.0分析软件,统一以单位像素Pixel作为标准单位,分别测量每张图片中的骨小梁像素面积记做A;测量每张图片的视野像素面积记做B,计算出骨小梁面积占比=A/B×100%,记做C。
1.4.5免疫组化检测:对兔血清中 VEGF的影响:血管内皮细胞生长因子,具有促内皮细胞增殖、促血管生成的作用。在激素引起的股骨头坏死模型中,VEGF表达量应显著减少,导致血管修复能力下降,影响股骨头局部病变血管的再生和修复,进一步加重骨坏死。另有文献报道,VEGF具有增强成骨细胞BMP-2表达的作用。与模型组相比,各两治疗组血清中VEGF的含量均有所上升,干细胞移植组上升显著,静脉组VEGF小于移植组,差异有显著性意义(P<0.05) 。结果见表 2。
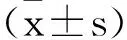
2 结 果
2.1一般情况 :所有35只实验动物均无死亡,B、C、D组实验动物注射醋酸泼尼松龙3~4周时,可观察到右侧后肢较对侧瘦小、2只可见跛行,活动及反应性普遍较对照组差,摄食量较前减少;干细胞移植组(D组)在手术减压后1周内活动减少,摄食量减少,至3周时逐渐恢复接近正常;静脉给药组(C组)于注射醋酸泼尼松龙后1周内活动减少,摄食量减少,术后2~3周逐渐恢复至接近正常状态。
2.2X线检查:四组实验动物行于髋部X线检查治疗结束后2周(Day 70)、6周(Day 98 处死前)行双侧股骨X线检查, B组可观察到股骨头部位骨密度较A组有所减低,其余除实验动物组部分可隐约观察到手术减压的钉道外,外形未观察到明显异常(图1)。
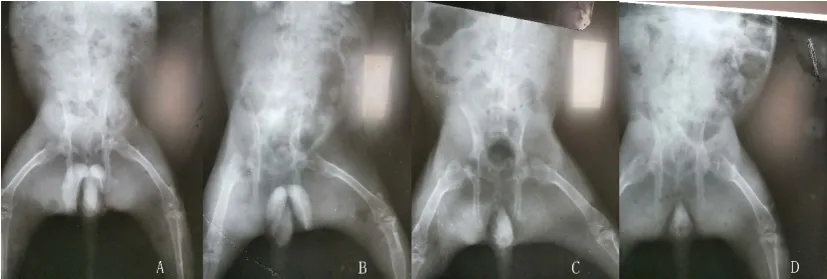
图1 髋部X线片
2.3Micro-CT检查:于处死动物后(Day 98)即刻取右股骨头样本行Micro-CT检查,四组动物股骨头外形均大致正常,未见明显塌陷、形变等改变;与A组对比,B组样本的骨小梁明显排列稀疏,无规则,隧道周围未见明显新生骨质生长;C、D两组骨小梁排列较为规则、致密,隧道处均有新生骨长入,钉道与周围骨质分界模糊,其中D组骨质与正常对照组较为接近,C组略逊于D组(图2)。基于CT影像数据用N-Recon软件进行三维图像重建,用CT-AN软件进行三维分析,获得检测指标有: BV/TV(%)、Tb.Th、Tb.N、SMI 、BMD。见表1、图3。并对所得数据均数进行组件比较,采用方差分析法,P<0.05代表差异具有显著性。模型组与对照组相比,所有指标差异均有统计学差异;静脉给药组和干细胞移植组分别与模型组比较,除Tb.N外,其余各指标差异均具有显著性,说明两种给药途径均有效改善坏死部位骨质情况,但是从数值上看,干细胞移植组改善更加明显。
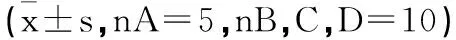
表1 各组Micro-CT指标结果
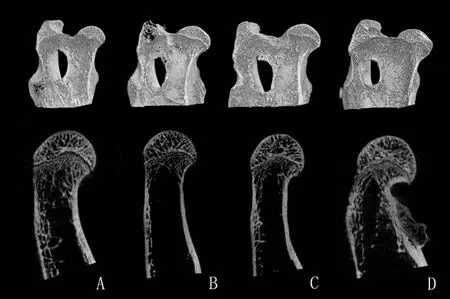
图2 兔股骨头Micro-CT结果

图3 各Micro-CT指标条形图
2.4病理学检查:模型组与对照组相比,空泡陷窝率和骨小梁面积比均有显著性差异(P<0.05),静脉给药组和干细胞移植组分别与模型组比较,差异均具有显著性(P<0.05)。从数值上看,干细胞移植组的疗效优于静脉给药组,结果与CT测量值相同(图4、5、6),见表2。
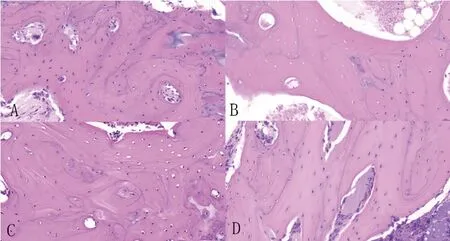
图4 各组兔股骨头组织切片(HE-400)
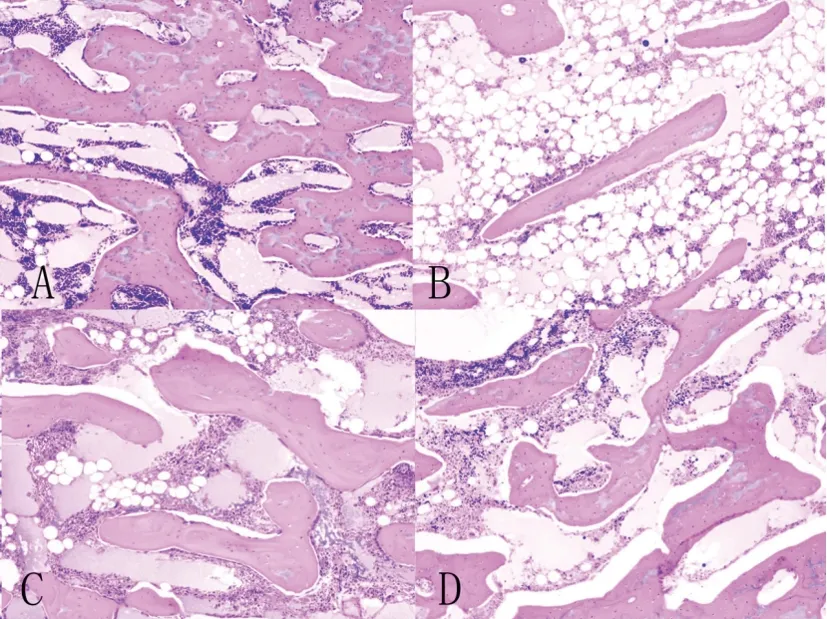
图5 各组兔股骨头组织切片(HE-100)
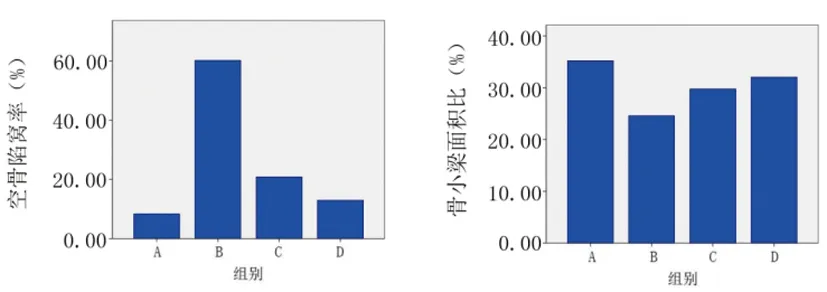
图6 各组空泡陷窝率和骨小梁面积比条图
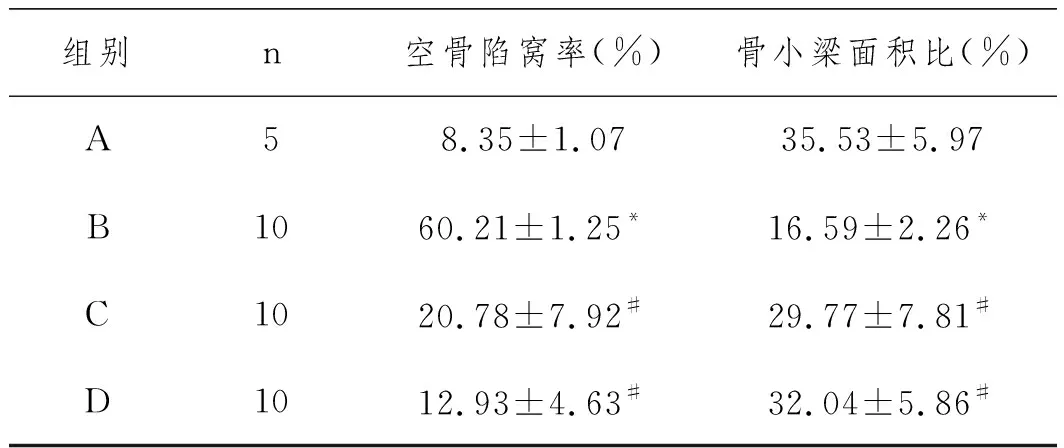
表2 14周时各组骨小梁面积比(HE×100)和空骨陷窝率(HE×400)
2.5免疫组化检测:模型组与对照组相比,VEGF明显减低,差异具有显著性(P<0.05),静脉给药组和干细胞移植组分别与模型组比较,VEGF均显著性上升,差异均具有显著性(P<0.05)。两治疗组比较,干细胞移植组较静脉给药组上升显著,差异有显著性意义(P<0.05)。可见局部干细胞移植的方法可显著诱导病变局部VEGF的产生,后者对坏死骨组织的再生及修复有积极作用。结果见表3、图7。
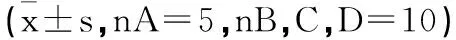
表3 各组对兔血清中 VEGF的影响
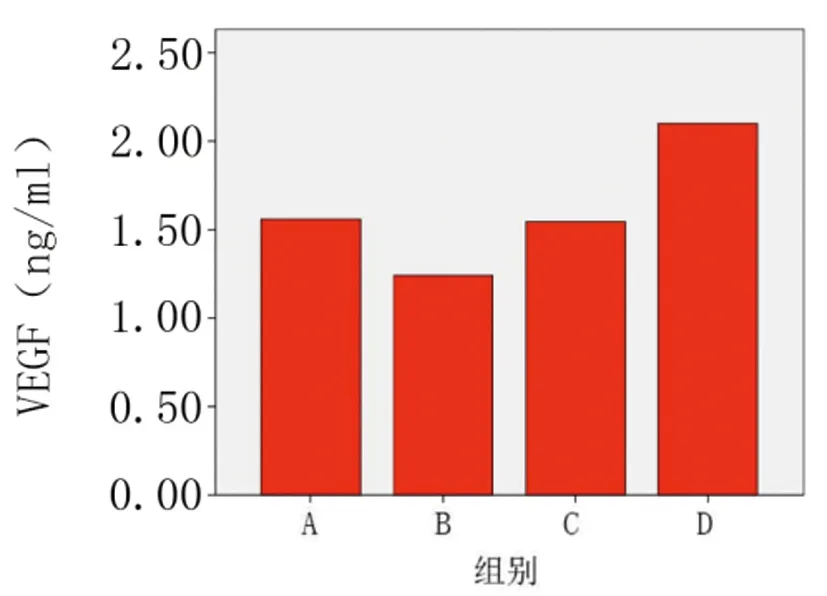
图7 各组VEGF条图
3 讨 论
股骨头坏死的原因众多,其病理基础是股骨头局部微血管损伤或血液供应障碍,导致骨细胞或骨髓成分的死亡、脂肪变性,进而造成骨小梁断裂和股骨头塌陷,最终使髋关节功能丧失,故也称为缺血性股骨头坏死(avascular necrosis of the femoral head,ANFH)[4]。尽管其病因尚未完全明了但创伤、乙醇及糖皮质激素已经是较为明确的致病因素。病变的股骨头骨质中,红骨髓转变为脂肪骨髓,从而使受累区域骨细胞总数减少。一旦发生股骨头的塌陷或关节软骨破坏,或继发髋关节炎,其病理改变将是不可逆的,此时髋关节置换术可能是最适合也是唯一能采取的有效治疗手段[5]。但是随着人工关节的磨损、假体周围骨折、感染等并发症的出现,导致年轻患者或是预期寿命较长,术后生活质量较高患者不可避免的会经历第二次甚至多次的翻修手术,加重了患者的身体及经济负担。因此及时发现早期ONFH并采取有效的保髋治疗,延缓或避免髋关节置换是临床治疗早期ONFH应追求的目标。目前针对早期ONFH的保髋治疗方法主要有:髓芯减压术,相应的截骨手术,带或不带血管蒂的植骨术等[6]。
这些手术清除病灶的同时降低了股骨头内压,有利于新生血管的修复及新骨的形成,如果植骨还会增加对坏死区域的支撑,减缓股骨头塌陷的发生。但是坏死区域骨质修复时间长,强度差等问题还未有效解决。
间充质干细胞 (mesenchymal stem cells, MSCs) 是一种具有自我增殖潜能的细胞群体,在机体发育、疾病发展及治疗中起到重要作用。股骨头坏死时,在股骨头、股骨颈部位发生大量的骨细胞凋亡,同时成骨细胞数量减少,活力降低。MSCs可提供成骨细胞或骨祖细胞,当其到达股骨头时,可定向分化为血管内皮细胞和成骨细胞,理论上和修复骨质破坏区。而髓芯减压术提供了直达股骨坏死患处的隧道,因此,将MSCs通过髓芯减压隧道直接注射到股骨头坏死区,结合了二者的优势。有报道称髓芯减压术联合干细胞移植,术后随访70%患者未发生进展,认为MSCs可有效减缓股骨头坏死的进展[7]。可用于ONFH的干细胞包括:间充质干细胞 (MSCs) 脂肪干细胞(adipose derived stem cell,ADSCs),脐血干细胞(cord blood stem cell, CASCs)和外周血干细胞(peripheral blood stem cell ,PBSC)。最常用的是骨髓间充质干细胞(BMSCs)。牙髓干细胞(DPSC)作为源最为广泛的自体成体干细胞之一被应用于组织工程中,同样可通过诱导分化为软骨、成骨、神经等各种组织,日益收到研究者关注[8]。其具有多向分化、高度增殖、免疫调节、分泌细胞活性因子等生物学特性[9]。本实验将DPSC应用于ONFH的实验研究当中,是一种新的治疗方法。
MSCs 移植治疗 ONFH的给药方式有多种选择,可以静脉注射,应用较多的是干细胞移植,其中干细胞移植主要有:动脉介入法,髓芯减压后通道灌注,复合支架材料植入等。但动脉介入法需要相应的接入设备,专门的介入科医生,对技术操作要求较高,于骨科开展有一定困难。复合支架材料植入法将制备好的干细胞以支架为载体植入病灶,有临床研究表明取得良好疗效,但其制备耗时长,操作成本高,且有损伤干细胞分化潜能的可能。静脉注射干细胞操作简单,成本低,不对患者造成额外的创伤,在临床上更易推广,通过本实验研究显示,静脉注射干细胞组与干细胞移植组均对治疗兔股骨头坏死有显著治疗效果,从各项指标上看,干细胞移植组的疗效优于静脉注射组的。静脉注射干细胞可作为其他治疗方式的辅助治疗方法活早期轻度股骨头坏死病人的治疗方式的选择。本实验是基于动物实验得出的结论,可为今后进一步的临床试验提供数据支持。

