高压氧调控TLR4/NF-κB通路对脓毒症大鼠海马区细胞凋亡的影响
郭 慧, 李旭蕊, 曲珍珍, 李建国
(河北省人民医院, 河北 石家庄 050051)
脓毒症是重症监护病房患者死亡的最常见原因之一,尽管最近的医学进展大大提高了存活率,但脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)仍是一种严重的并发症,发病率高达70%[1]。SAE通常表现出严重的、长期的认知障碍,不但影响生活质量,还增加了患者的死亡风险。Toll样受体4(Toll-like receptor 4,TLR4)/核因子(nuclear factor,NF)-κB通路是脓毒症不受控制的炎性反应的主要机制,该通路可被脂多糖等激活,并最终促进白细胞介素(interleukin,IL)-1β和IL-6的分泌,从而导致海马神经元炎性损伤和凋亡[2]。高压氧(hyperbaric oxygenation,HBO)是一种现代医学手段,其可通过提高氧分压使氧分子到达血红蛋白无法穿透的组织,研究显示HBO具有抗炎、抗氧化应激、调控免疫和调节细胞凋亡的作用[3]。近年来HBO在脑神经保护中有着广泛的应用,研究显示HBO能够减少脑出血后继发的神经元损伤,保护脑神经功能[4]。但是HBO对SAE的影响和机制仍不清楚。本文主要分析HBO干预通过调控TLR-4/NF-κB通路对SAE大鼠海马区细胞凋亡的影响。
1 材料与方法
1.1材料:Sprague-Dawley(SD)大鼠(SPF级,雄性,7~8周,180~200g,北京维通利华动物公司,中国)。水迷宫视频跟踪分析系统(上海移数信息科技有限公司,中国)。HE和TUNEL凋亡试剂盒(Roche公司,美国)。四氧化锇(Sigma公司,美国)。乙酸铀酰和柠檬酸铅(上海生工公司,中国)。树脂(Epon812,TAAB公司,英国)。超薄切片机(LKB公司,瑞典)。RNAspin Mini试剂盒(GE Healthcare,美国)。Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国)。Agilent Stratagene Mx3000P序列检测系统(Santa公司,美国)。一抗和山羊抗兔HRP-IgG二抗(博士德公司,美国)。PVDF膜(Millipore公司,美国)。ECL显色试剂盒(Thermo Fisher公司,美国)。光学显微镜(Olympus 公司,日本)。JEM-1230 透射电子显微镜(JEOL 公司,日本)。
1.2建模、分组和干预:将45只大鼠随机分为对照组、SAE组和SAE+HBO组(n=15)。通过腹腔注射LPS构建SAE模型(15mg/kg,3d)。在建模前2d和建模后3d,每日接受HBO干预,大鼠放置于高压氧舱中,在20min缓慢、稳定的加压至2.2个绝对大气压力,然后再此压力下呼吸95%的氧气60min;吸氧结束后再20min内缓慢、稳定的降至常压常氧,每日1次。
1.3观察指标和检测方法
1.3.1水迷宫实验:通过水迷宫视频跟踪分析系统分析大鼠神经功能,通过检测大鼠的逃避潜伏期和穿越平台次数分析神经功能,逃避潜伏期越长、穿越平台次数越低提示神经功能损伤越严重。
1.3.2ELISA:取大鼠尾静脉血离心(3000rpm,20min,4℃)收集血清,通过ELISA检测IL-1β和IL-6的水平。根据说明书加入抗体和显色剂,根据450nm下的光密度和标准曲线计算浓度。
1.3.3HE染色:大鼠断头处死后取出海马体组织并在室温下用4%多聚甲醛固定6h。用乙醇脱水(从低浓度到高浓度)后,将组织包埋在石蜡中。然后将石蜡包埋的组织切成5μm的切片,并将切片固定在载玻片上。将载玻片在室温下放入苏木精中染色10min。用自来水洗涤1~2min后,将玻片置于10%冰醋酸中10s,然后置于1%氨水中,直到切片变蓝。随后用自来水清洗1~2min后,将玻片放入曙红中10s。在乙醇(浓度分别为70%、90%、95%和100%)中脱水后,将玻片置于二甲苯中2min;重复此步骤一次。最后,用中性胶密封玻片。在倒置显微镜下观察载玻片。
1.3.4TUENL染色:将海马体组织样本在流水下洗涤8h。样本在洗涤后置于70%的乙醇中过夜。然后将组织块分别浸入80%,90%,100%A和100%B乙醇中1h。然后使用丙酮,二甲苯A和二甲苯B分别浸泡30min,直到组织块出现棕褐色或暗红色并透明。将块料分别放入水浴石蜡罐中1h(60℃),并将块放置在嵌入模具中并切成4μm的厚度。将切下的切片置于45℃的烘箱中过夜。经过脱蜡和修复抗原后,用10mM Tris-盐酸(pH7.4~7.8)将蛋白酶K稀释成10~20μg/mL的溶液,然后将蛋白酶K稀释液逐滴加入样品中,用膜覆盖,并在37℃下孵育20min。然后将样品用PBS洗涤两次,每次5min。将制备的TUNEL反应混合物滴在载玻片上,用膜覆盖,并在37℃下孵育60min。然后将其用PBS洗涤3次,每次5min。显色后在×200倍数的显微镜下随机选择5个视野,计算TUNEL染色阳性的凋亡细胞。
1.3.5电子显微镜观察神经元:将海马体组织在室温下浸入含有4%甲醛、2.5%戊二醛的、浓度为0.1M磷酸钠缓冲液(pH=7.4)中浸泡2h。然后将组织使用2%的四氧化锇固定。经过梯度酒精脱水后包埋在Epon 812树脂混合物(TAAB,英国伯克斯)中。然后使用Leica EM UC6超薄切片机切割成超薄切片(约70nm),分别使用乙酸铀酰和柠檬酸铅双重染色,并用电子显微镜观察海马神经元。
1.3.6RT-qPCR:使用RNeasy Mini试剂盒取海马组织中的总RNA,然后使用Bestar qPCR RT试剂盒将其逆转录为cDNA,条件如下:37℃/15min;98℃/5min。然后使用BestarTMqPCR预混液进行qPCR实验,条件如下:95℃/2min,94℃20s,58℃20s,72℃/20s,40个循环,最后在72℃下延伸4min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。通过比较循环阈值并以GAPDH作为内参计算mRNA相对表达水平。
1.3.7Western blot:将海马体组织在放射免疫沉淀测定裂解缓冲液中在冰上裂解。通过8%的SDS-PAGE分离每个样品中等量(50μg)的蛋白质,并将其转移到硝酸纤维素膜上。通过在室温下将膜浸入5%脱脂牛奶中2h封闭非特异性抗原。随后,将膜与一抗体在4℃下孵育过夜,然后将膜与相应的辣根过氧化物酶偶联的二抗在室温下孵育1h。使用化学发光试剂显示,使用Quantum One软件分析灰度计算蛋白相对于GAPDH的表达量。
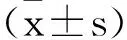
2 结 果
2.1HBO对SAE大鼠神经功能的影响:三组大鼠水迷宫实验结果比较差异显著(P<0.05)。SAE组的逃避潜伏期(44.06±5.12s)显著高于对照组,穿越平台次数(2.94±0.35次)显著低于对照组(P<0.05)。SAE+HBO组的逃避潜伏期(35.86±3.06s)显著低于SAE组,穿越平台次数(4.98±0.66次)显著高于SAE组(P<0.05),见表1。
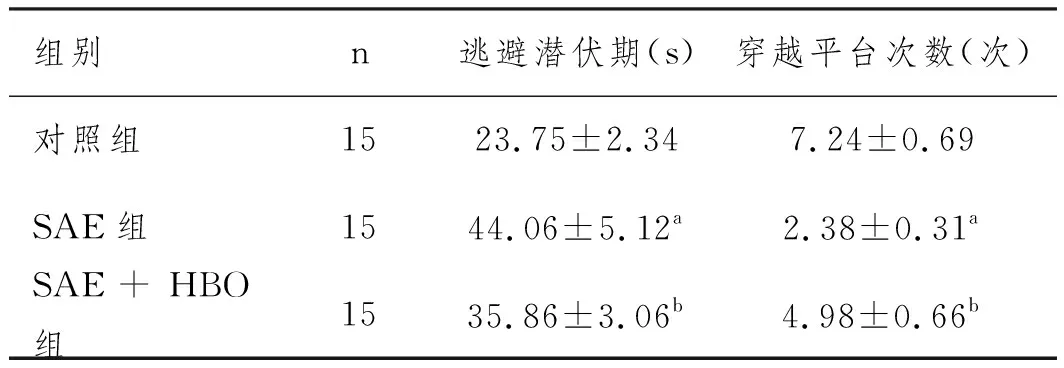
表1 HBO对SAE大鼠水迷宫实验结果的影响
2.2HBO对SAE大鼠炎性反应的影响:三组大鼠血清炎性因子水平比较差异显著(P<0.05)。SAE组的IL-1β(76.25±8.06pg/mL)和IL-6(91.37±10.74pg/mL)水平显著高于对照组(P<0.05)。SAE+HBO组的IL-1β(48.68±5.21pg/mL)和IL-6(64.47±7.06pg/mL)水平显著低于SAE组(P<0.05),见表2。
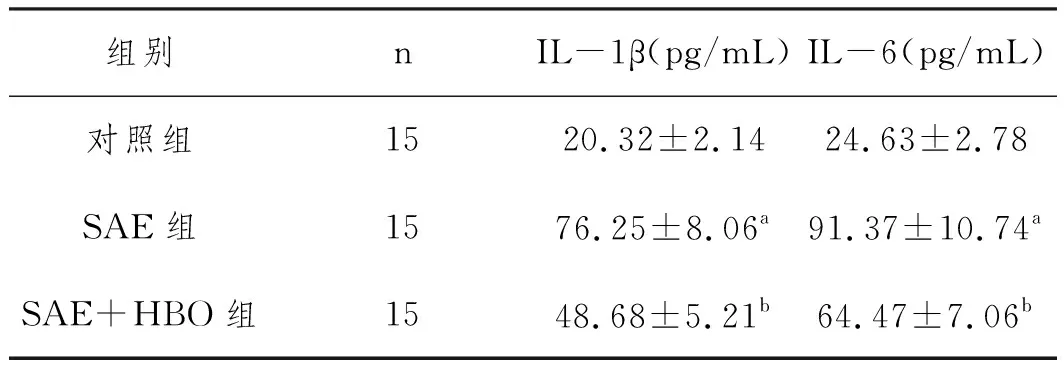
表2 HBO对SAE大鼠血清IL-1β和IL-6水平的影响
2.3HBO对SAE大鼠海马组织损伤的影响:对照组海马体神经元的形态正常,SAE组观察到严重的神经元变性,发现了许多增色细胞,神经元细胞质收缩甚至出现空泡。SAE+HBO组海马神经组织损伤情况较SAE组轻。见图1。
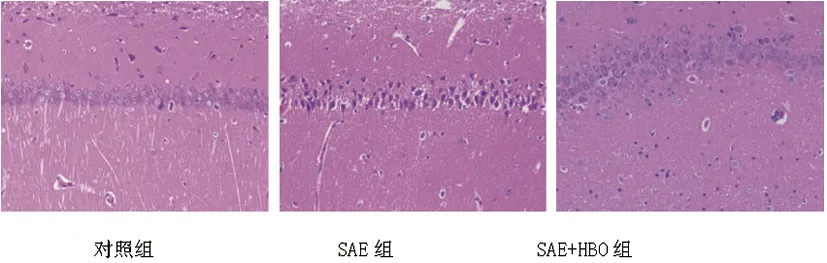
图1 HE染色检测HBO对SAE大鼠海马组织损伤的影响(×200)
2.4HBO对SAE大鼠海马神经元凋亡的影响:如图2所示,蓝色进而棕色分别为细胞核和TUNEL阳性的凋亡细胞的细胞核。三组大鼠海马神经元凋亡情况比较差异显著(P<0.05),SAE组的凋亡细胞(6.17±0.78个/视野)显著高于对照组(P<0.05),SAE+HBO组的的凋亡细胞(3.42±0.52个/视野)显著低于SAE组(P<0.05),见表3。

图2 TUNEL染色检测HBO对SAE大鼠海马神经元凋亡的影响(×200)(黑色箭头提示凋亡细胞)
表3 HBO对SAE大鼠海马神经元凋亡的影响
2.5HBO对SAE大鼠海马神经元损伤情况的影响:电镜分析表明,对照组的脑毛细血管完整结构,邻近的神经元结构正常。SAE组出现神经元肿胀和细胞膜破裂,同时还能观察到神经元的细胞质密度增加,细胞器异常。SAE+HBO组的神经元损伤情况较SAE组轻。见图3。
图3 电子显微镜观察HBO对SAE大鼠海马神经元损伤情况的影响(bar=2μm)
2.6HBO对SAE大鼠海马体组织中TLR4和NF-κB转录水平的影响:三组SAE大鼠海马体组织中TLR4和NF-κB转录水平比较差异显著(P<0.05)。SAE组的TLR4(5.82±0.54)和NF-κB(5.61±0.53)mRNA水平显著高于对照组(P<0.05),SAE+HBO组的TLR4(2.75±0.25)和NF-κB(3.02±0.29)mRNA水平显著低于SAE组(P<0.05),见表4。

表4 HBO对SAE大鼠海马体组织中TLR4 mRNA和NF-κB mRNA水平的影响
2.7HBO对SAE大鼠海马体组织中TLR4/NF-κB通路中蛋白表达水平的影响:三组SAE大鼠海马体组织中TLR4/NF-κB通路中蛋白表达水平比较差异显著(P<0.05)。SAE组的TLR4(3.79±0.34)和NF-κB(3.21±0.29)蛋白水平显著高于对照组(P<0.05),SAE+HBO组的TLR4(1.05±0.09)和NF-κB(1.47±0.13)蛋白水平显著低于SAE组(P<0.05),见图4和表5。
图4 Western blot检测HBO对SAE大鼠海马体组织中TLR4/NF-κB通路中蛋白表达水平的影响
表5 HBO对SAE大鼠海马体组织中TLR4和NF-κB蛋白表达水平的影响
3 讨 论
SAE是由感染的全身反应引起的常见脑功能障碍,SAE患者表现出不同程度的认知功能障碍,这些认知障碍可能归因于败血症本身,或归因于败血症增加了大脑对神经退行性疾病的敏感性[5]。SAE可在出院后持续数月至数年,但是目前尚无有效的干预SAE的方法,SAE患者通常需要长期的康复干预治疗才能恢复功能,寻找有效的治疗SAE的方法具有重要的现实意义。
HBO是在加压舱中进行的非侵入性疗法,患者在高于正常大气压的情况下吸入纯氧,这改善了从肺部到全身器官的氧合作用,特别是在缺血性状况下。HBO疗法目前用于治疗急性和慢性缺血性损伤,包括与潜水有关的伤害、中风、脊髓损伤等[6]。研究显示HBO可以促进神经功能的恢复,如Tan等[7]研究结果显示脊髓损伤患者接受早期HBO治疗可明显提高体感诱发电位和运动诱发电位的峰值,缩短潜伏期,加快神经传导,从而促进患者运动和自理能力的恢复。近年来,HBO在感染和炎性相关疾病的治疗中也取得了重大进展,研究结果显示HBO可以缓解脂多糖诱导的上皮细胞释放炎性细胞因子和抑制凋亡[8]。本次研究通过HBO干预SAE模型小鼠,结果显示HBO不但可以抑制炎性细胞因子的释放保护神经功能,还明显减少了海马体神经元的损伤和凋亡。研究结果显示海马体神经元的凋亡是导致SAE患者记忆功能、神经损伤和运动功能受损的重要机制[9]。Ying等[10]研究结果也表明HBO干预可通过调控脊髓损伤大鼠中的BDNF/TrkB信号通路减少神经元凋亡和损伤。这提示HBO可显著的抑制SAE大鼠海马体神经元的损伤和凋亡,从而保护神经功能,但是其分子机制仍需要进一步研究。
研究认为TLR4在脓毒症相关的炎性反应和细胞凋亡中发挥重要作用,TLR4可被脂多糖等激活,而TLR4蛋白可激活下游转录因子NF-κB进而调控免疫炎性基因的转录,从而导致细胞损伤和凋亡[11]。该通路也是SAE海马体神经元损伤和凋亡的重要机制。而抑制TLR4/NF-κB可保护海马神经元[12]。本次研究结果显示SAE大鼠海马体组织中TLR4和NF-κB转录和翻译的水平均明显升高,而HBO干预可显著抑制TLR4/NF-κB通路。Liu等[13]认为HBO可通过抑制星形胶质细胞中的NF-κB信号通路减轻脂多糖引起的炎症反应。HBO干预能够通过抑制TLR4/NF-κB通路缓解大鼠实验性蛛网膜下腔出血后的早期脑损伤[14]。也有研究显示HBO可通过抑制TLR4/NF-κB介导炎症而改善听力丧失患者的听力水平。这提示HBO保护SAE的功能可能与TLR4/NF-κB通路有关,HBO可能通过神经抑制TLR4和NF-κB的转录和翻译,从而抑制海马神经元损伤。
综上所述,HBO可能通过抑制TLR4/NF-κB通路缓解SAE引起的海马神经元损伤和凋亡,进而保护神经功能。但是关于HBO对SAE的治疗效果仍需要临床研究证实,并且其机制仍需要进一步的验证。

