早产儿补充不同剂量维生素D对支气管肺发育不良的预防效果比较
聂 莹
河南省安阳市妇幼保健院儿科 455000
支气管发育不良(BPD)是一种早产儿常见的慢性呼吸系统疾病,1967年由Northway等人首次报道并命名。BPD的远期预后包括哮喘、反复呼吸道感染、肺动脉高压、神经系统发育障碍等,给患儿家庭及整个社会带来沉重负担。该病在出生体重≤1 500g的极低出生体重儿和超低出生体重儿早产儿中发病率呈逐渐增高趋势。国外文献显示,约有24%胎龄在22~28周、体重400~1 500g的早产儿合并BPD[1];我国胎龄28~37周的早产儿BPD的总体发病率为8%左右[2]。维生素D(VD)是一种类固醇激素,不仅参与体内钙代谢平衡及骨骼形成,同时能通过与VD受体结合从而调控与免疫、炎症等相关基因表达,从而影响慢性呼吸系统疾病的易感性。另有文献显示,VD参与胎儿肺功能发育过程,缺乏VD可造成肺功能及结构的改变[3]。以往就不同剂量VD对BPD预防效果的研究并不多见,对此,本研究选取我院新生儿科160例早产儿进行临床研究,详细内容报道如下。
1 资料与方法
1.1 一般资料 选取2018年1月—2020年1月我院新生儿科的160例早产儿作为观察对象。纳入标准:(1)胎龄<34周,出生体重<2 000g;(2)生后24h内需机械通气或无创呼吸支持或氧疗;(3)住院时间≥30d。排除标准:(1)外院分娩转入;(2)先天性非细菌感染;(3)存在严重先天畸形,如消化系统先天性畸形、复杂先天性心脏病、呼吸系统先天性畸形等;(4)存在先天性代谢性疾病。根据VD给药剂量将早产儿分为常规剂量组(73例)和大剂量组(87例)。常规剂量组男39例,女34例,胎龄28~33周,平均胎龄(30.25±4.67)周;出生体重1 020g~1 960g,平均体重(1 478.24±203.71)g;呼吸机使用时间4~10d,平均时间(5.16±0.88)d。大剂量组男45例,女42例,胎龄27~34周,平均胎龄(30.43±5.31)周;出生体重980g~2 000g,平均体重(1 469.88±221.74)g;呼吸机使用时间3~10d,平均时间(5.26±1.12)d。两组早产儿性别、胎龄、出生体重及呼吸机使用时间等基线资料对比,差异无统计学意义(P>0.05),具有可比性,本研究已经医院伦理委员会批准通过。
1.2 方法 所有早产儿均给予保暖、肠外营养、机械通气等对症治疗,同时密切监测呼吸、心率、血氧饱和度等体征指标,必要时可给予地塞米松(生产厂家:广东华南药业集团公司,生产批号:1211121 ,规格:0.75mg×100s)以0.1mg/(kg·d)静脉推注。常规剂量组:出生后第2天开始进行VD补充,给予早产儿VD滴剂胶囊(生产厂家:厦门国药星鲨制药公司,生产批号:980516,规格:400IU×12粒×3板)口服,400IU(1粒)/d,同时给予婴幼儿配方奶粉喂养。大剂量组:出生后第2天开始给予早产儿VD滴剂胶囊口服900IU/d,同时给予婴幼儿配方奶粉喂养,密切观察早产儿是否出现水肿、口唇干裂、发热、呕吐、便秘或腹泻等症状,一旦出现上述症状,立即停药。两组早产儿治疗期间均未接受阳光照射。
1.3 BPD诊断及分度标准 根据美国BPD研讨会2000年制定的早产儿BPD相关诊断标准[4]:生后28d仍存在氧依赖。如胎龄<32周,根据校正胎龄36周或出院时需要的吸入氧浓度(FiO2)分度:Ⅰ轻度:未用氧;Ⅱ中度:需用氧但FiO2<30%;Ⅲ重度:需用氧且FiO2≥30%。
1.4 观察指标 (1)预防效果:比较两组早产儿轻、中、重度BPD发病例数及发病率;(2)血清25-羟基维生素D3[25(OH)D3]水平及免疫功能:分别在治疗前、治疗第14天及治疗第28天检测两组早产儿血清25(OH)D3水平及免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM),其中,采用酶联免疫吸附法检测血清25(OH)D3、IgA、 IgG、IgM,试剂盒由英国IDS艾狄斯提供;(3)炎性因子:分别在治疗前、治疗第14天及治疗第28天采用酶联免疫吸附法检测两组早产儿血清中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),采用免疫散射比浊法检测血清中C-反应蛋白(CRP),试剂盒购自上海科华生物工程股份有限公司;(4)不良反应:记录并统计两组早产儿治疗期间发生发热、口唇干裂、皮肤瘙痒、呕吐、便秘或腹泻等不良反应发生率。
2 结果
2.1 两组BPD预防效果比较 大剂量组BPD总发病率显著低于常规剂量组(P<0.05);两组轻、中、重度BPD发病例数及发病率比较差异无统计学意义(P>0.05),详见表1。
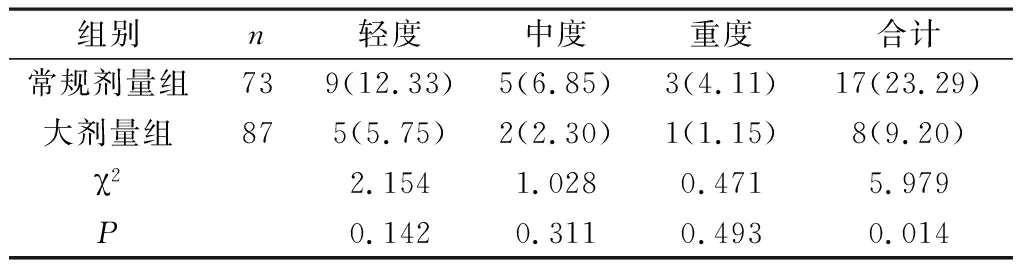
表1 两组BPD预防效果比较[n(%)]
2.2 两组血清25(OH)D3水平及免疫功能比较 治疗前,两组血清25(OH)D3、IgA、 IgG、IgM水平比较,差异无统计学意义(P>0.05)。治疗后14d、28d,两组间血清25(OH)D3比较,差异有统计学意义(F组间=16.752,P=0.009);各时间点两组血清25(OH)D3差异有统计学意义(F时间=27.482,P=0.000),组间及时间点对血清25(OH)D3水平的影响存在交互作用(F交互=25.116,P=0.000)。治疗后14d、28d,两组IgA、 IgG、IgM水平均有所提高,但差异不显著(P>0.05),详见表2。

表2 两组血清25(OH)D3水平及免疫功能比较
2.3 两组炎性因子水平比较 治疗前,两组血清IL-6、TNF-α、CRP水平比较,差异无统计学意义(P>0.05)。治疗后14d、28d,大剂量组IL-6、TNF-α、CRP指标水平显著低于常规剂量组,差异有统计学意义(F组间=6.946、21.779、6.211,P=0.011、0.000、0.008),各时间点两组患者IL-6、TNF-α、CRP比较差异有统计学意义(F时间=8.338、10.542、8.767,P=0.002、0.000、0.000),组间及时间点对IL-6、TNF-α、CRP的影响存在交互用(F交互=7.270、13.234、10.117,P=0.000、0.000、0.000),详见表3。

表3 两组炎性因子水平比较
2.4 两组不良反应情况比较 两组发热、口唇干裂、皮肤瘙痒、呕吐、便秘或腹泻等不良反应发生率比较,差异无统计学意义(P>0.05),详见表4。
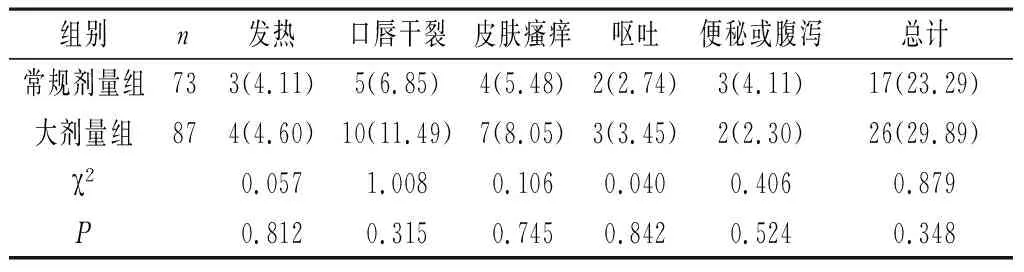
表4 两组不良反应情况比较[n(%)]
3 讨论
VD主要包括D2和D3,然而两类形式的VD在体内均需肝脏、肾脏等二次羟化转化为25(OH)D3,并通过与VD受体结合来发挥其生物效应。人体VD主要来源为阳光照射,天然食物中的VD含量很少,胎儿及新生儿获取VD的主要途径即通过胎盘,然而由于胎盘屏障作用,新生儿获取的VD含量仅为母体的50%~70%,因而其VD缺乏状况较为普遍[5]。早产儿在母体内时间更短,母体为其提供的营养有限,从而VD缺乏现象更为严重。美国一项研究指出,胎龄<32周的早产儿出生时VD缺乏发生率为68%[6];印度的有关文献显示VD缺乏发生率高达83%[7];我国南京地区的VD缺乏发生率约为76.5%。VD对机体免疫功能、钙磷代谢调节等起着重要作用,同时也参与肺的发育与成熟过程。研究显示,有超过30个基因含有VD反应元件,且多数参与肺发育。母体孕期及新生儿早期VD缺乏可增加其BPD发生率,并造成其后期反复呼吸道感染、喘息性疾病等发生。
本文中,大剂量组BPD总发病率为9.20%,显著低于常规剂量组的23.29%。肺发育不成熟是BPD的重要影响因素,其发病机制主要是未能发育成熟的肺,过早处于高氧环境中形成大量自由基,打破具有清除能力的氧化系统上限,产生的毒性直接损伤肺部;另外,早产儿BPD发病机制还包括气压伤、感染、遗传易感性等多方面因素。高剂量VD的补充,提高了早产儿体内25(OH)D3含量,对于促进其肺功能发育,降低BPD发生率起到了积极的作用。本文结果显示,治疗后14d、28d,两组血清25(OH)D3比较差异有统计学意义(P<0.05),进一步验证了大剂量VD补充对于提高早产儿机体内VD含量有促进作用。本文结果还显示,治疗后14d、28d,两组IgA、 IgG、IgM水平均有所提高,但差异不显著。IgA、IgG、IgM是机体内体液免疫应答产生的主要免疫球蛋白,反映机体体液免疫功能,结果说明VD补充虽然能够对免疫球蛋白水平有一定的改善作用,但可能由于早产儿免疫系统发育不全,免疫功能不完善,VD补充时间有限,对于体液免疫的调节未能显著体现。
本文分析两组炎性因子指标水平发现,治疗后14d、28d,大剂量组IL-6、TNF-α、CRP指标水平显著低于常规剂量组,差异有统计学意义。炎症反应同样是造成BPD的一项不可忽视的因素,IL-6是一种具有刺激炎症细胞生长、加速细胞急性期蛋白合成的前炎症细胞因子;TNF-α是一种通过激活巨噬细胞分泌,参与炎症反应造成组织细胞受损的主要介质;CRP在机体发生创伤或炎症反应时其水平会显著提高。本文结果提示大剂量VD补充能够有效减少炎症反应,可能与血清25(OH)D3与VD受体结合后能够抑制肺动脉内皮细胞炎症反应,缓解高氧造成的肺泡上皮细胞凋亡,从而减轻炎症反应有关。两组不良反应发生率比较无统计学差异,提示大剂量VD补充不会增加早产儿疾病风险。
综上所述,增补大剂量VD对于减少早产儿BPD风险,提高其免疫力并减少炎症反应具有积极意义,该法安全可靠,不良反应少,值得临床推广。

