白介素-17A在肺癌合并胸腔积液中的表达及其临床意义*
刘俊骥 钟 艳 周菊香 易 琳 刘新福
湖南省邵阳市中心医院 1 肿瘤科 2 药学部 422000
最新的全球癌症统计数据显示,目前肺癌新发病例居所有恶性肿瘤的前几位,大约15%的肺癌患者在最初诊断时有胸腔积液,50%在病程后期发展为胸腔积液[1]。而在鉴别恶性和非恶性胸腔积液时,传统的方法存在一定的局限性。胸水细胞学是检测胸水中肿瘤细胞的首选分析方法,敏感度为30%~60%。虽然胸腔积液中肿瘤细胞的存在是恶性胸腔积液的诊断标志,但发现它们的概率很低。对于细胞学阴性的胸腔积液,目前常用的癌胚抗原、神经元特异性烯醇化酶和细胞角蛋白19片段等指标有一定的鉴别价值,但其特异性和敏感性有限[2]。因此,寻找新的细胞因子很有必要。除了诊断问题,恶性胸腔积液患者的预后很差。尽管治疗方式取得了进步,但总体生存期(OS)仍然很短。目前的标准治疗方法是排出胸腔积液,然后进行静脉化疗或胸腔内化疗。然而,研究发现并不是所有的患者都能从化疗中获益,特别是在OS较短的患者中[3]。因此,对患者的预后评估至关重要。随着对胸腔积液免疫发病机制认识的提高,免疫诊断工具的发展有助于胸腔积液的鉴别诊断。大规模研究报告显示,淋巴细胞在发病机制中起着重要作用。CD4+T细胞可以分化为产生白细胞介素17(IL-17)的辅助性T细胞(Th17)。IL-17A为Th17所产生的特异性细胞因子,其表达水平与肺癌患者预后的关系是否存在显著差异,至今还没有得到评估。因此本文旨在探讨IL-17A与患者的治疗疗效、预后的相关性,为肺癌合并胸腔积液的免疫治疗提供新的思路。
1 资料和方法
1.1 一般资料 选取2017年12月—2019年6月我院收治的30例肺癌合并胸腔积液患者以及30例肺癌未合并胸腔积液患者的临床资料,本研究纳入30例肺癌合并胸腔积液患者,其中男20例,女10例,平均年龄(62.57±11.25)岁;纳入30例肺癌未合并胸腔积液患者,其中男19例,女11例,平均年龄(65.03±6.12)岁。两组年龄对比,差异无统计学意义(P>0.05),有可比性。本研究获得我院伦理委员会批准。
1.2 入选标准 纳入标准:(1)所有患者均行病检确诊,随访资料完整且病理标本充足;(2)并发中等量以上胸腔积液(中等量积液定义:卧位B超检查胸腔积液≥3cm,坐位B超检查胸腔积液≥4cm);(3)无重要器官功能严重受损,血常规、肝肾功能均在正常范围内,无明显化疗禁忌证,可耐受化疗。排除标准:(1)有对实验药物过敏史或高过敏体质者;(2)近3个月内接受过放化疗及生物治疗;(3)近3个月内接受过胸膜腔有创检查和(或)治疗,或者胸部外伤史。
1.3 胸腔灌注 所有患者经B超检查定位,确定穿刺点。常规消毒铺巾后于B超定位点置入中心静脉导管,连接引流袋放胸腔积液,充分引流,经B超检查证实胸腔积液基本排尽后予以胸腔灌注。给予顺铂40mg/m2+0.9%氯化钠溶液60ml胸腔内注射 (第1天,1次/周),连续治疗2周,治疗后1个月来院复查,评估近期疗效。
1.4 血清学检测 IL-17A 所取样本均不抗凝,室温静置,离心10min,分离上清液,置于-70℃低温冰箱内保存待测,标本编码,利用流式液相多重蛋白技术来测定血液中IL-17A的水平。采用ROC曲线确定IL-17A高低的截断值,并将确定结果应用于IL-17A阳性对照组进行高低分组。
1.5 疗效评估 依据胸腔积液的变化评估疗效:完全缓解(CR):胸腔积液完全消失,消失时间>4周;部分缓解(PR):胸腔积液减少≥50%,并4周内未见增加;稳定(SD):胸腔积液减少<50%,或增加≤25%;进展(PD):胸腔积液较前增加超过25%以上。客观缓解率(Object response rate,ORR)=CR+PR,疾病控制率(Disease control rate,DCR)=CR+PR+SD。并对所有肺癌合并胸腔积液患者进行随访,记录患者1年生存期情况。

2 结果
2.1 血液中IL-17A水平比较 肺癌合并胸腔积液患者血液中 IL-17A 的水平为(30.40±4.59)pg/ml,肺癌未合并胸腔积液患者血液中水平为(26.70±2.81)pg/ml。合并胸腔积液的患者IL-17A 的水平较未合并胸腔积液患者明显升高,且差异具有统计学意义(P<0.05)。
2.2 肺癌合并胸腔积液患者血液IL-17A的截断值 如图1所示,通过 ROC 曲线分析,肺癌合并胸腔积液患者血液IL-17A的截断值为 29.225,AUC为0.742,95%CI:0.612~0.871,P=0.001,表明取IL-17A截断值对肺癌合胸腔积液患者进行分组具有统计学意义,因此以此截断值作为高低的分组。
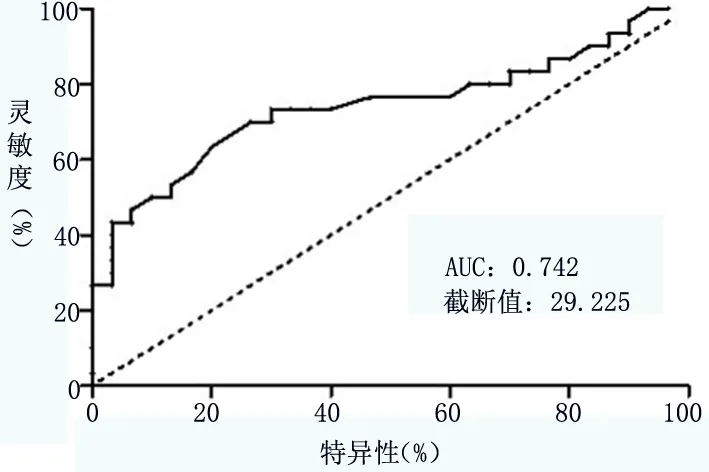
图1 肺癌合并胸腔积液患者血液IL-17A的截断值
2.3 胸腔灌注疗效 30例肺癌合并胸腔积液患者全部接受连续2周期的顺铂40mg/m2+0.9%氯化钠溶液60ml胸腔内注射。19例IL-17A高水平组患者进行疗效评估,ORR为42.11%(8/19),DCR为78.95%(15/19)。11例IL-17A低水平组患者中,ORR为54.55%(6/11),DCR为81.82%(9/11)。
2.4 血液IL-17A水平与肺癌合并胸腔积液患者预后关系 如图2所示,30例肺癌合并胸腔积液患者中,截止最后一次随访,死亡23例,其他7例为截尾。经ROC曲线确定IL-17A高组为>29.225pg/ml,低组为<29.225pg/ml。IL-17A高水平组与IL-17A低水平组的中位生存期估值分别为5个月和9个月,生存曲线水平的整体比较,显示两组生存曲线整体Log-rank检验结果为P=0.041<0.05,有统计学差别,表明IL-17A高水平组生存期更短;如图3所示,IL-17A低水平组的1年生存率较IL-17A高水平组提高了25%,且差异具有统计学意义(P<0.05)。由上可知,肺癌合并胸腔积液患者血液中IL-17A水平高组具有更短的生存期和生存率。综上,血液中IL-17A水平的高低与肺癌合并胸腔积液患者预后密切相关。

图2 血液IL-17A水平与肺癌合并胸腔积液患者的生存关系
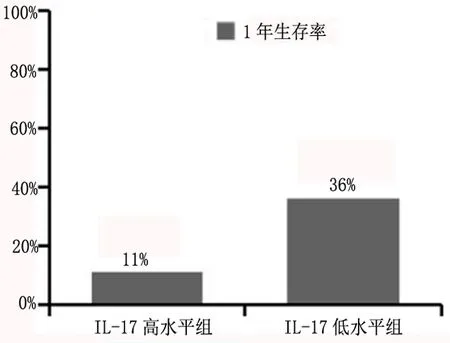
图3 血液IL-17A水平对肺癌合并胸腔积液患者生存率的影响
3 讨论
恶性胸腔积液是晚期肺癌患者常见并发症之一,可引起胸闷、气促等临床症状,导致患者生存质量下降。恶性胸腔积液的形成机制尚不清楚,目前国内外基本认同的产生机制是肿瘤转移至胸膜,破坏胸膜血管和炎症反应,使血管通透性增加,大量液体渗出,产生胸腔积液。研究发现,恶性胸腔积液中血管内皮生长因子(Vascular endothelial growth factor,VEGF)明显高于良性胸腔积液,其通过破坏血管内皮细胞间连接,增加血管通透性促进胸腔积液的生成。贝伐珠单抗等抗血管生成的药物在恶性胸水的控制上得到了一定的临床疗效[4],改善了患者的生存质量,延长患者生存时间。
随着分子生物学的发展,免疫微环境也逐渐受到重视,研究者发现恶性胸腔积液患者的淋巴系统细胞数目明显高于健康人群,恶性胸腔积液环境中宿主细胞、淋巴系统的细胞(如单核细胞、淋巴细胞、中性粒细胞、巨噬细胞)与肿瘤细胞的互相作用,分泌大量炎性因子,IL-17A 是其中一种重要的炎症因子。
IL-17A是由Th17细胞、自然杀伤 T(NKT)细胞、肥大细胞、巨噬细胞等多种免疫细胞分泌产生[5]。目前关于IL-17A 的作用存在很大的争议,一方面IL-17A可通过激活多种通路刺激肿瘤血管的生成、促进肿瘤种植转移。另一方面可通过招募与肿瘤浸润性相关的免疫细胞分泌细胞因子介导肿瘤消退,从而发挥抗肿瘤作用[6]。临床研究表明转移性结直肠癌[7]、肺癌[8]、肝细胞癌[9]中IL-17A高表达与预后不良相关,在食管癌[10]、胃癌[11]、卵巢癌[12]中IL-17A高表达患者提示良好预后。有研究指出特定的免疫细胞亚群在肿瘤细胞的空间分布不同具有不同的预后价值。目前有多项临床观察初步表明IL-17A高水平肺癌恶性胸腔积液患者的预后更差。例如,一项关于中国肺癌预后分析的研究中指出在肺癌合并胸腔积液患者中IL-17A 表达高低与总生存期显著相关[13]。Wang XF等[14]亦证实胸腔积液IL-17A表达是肺癌合并胸腔积液患者的独立预后因素。
本研究纳入30例肺癌合并胸腔积液患者,根据IL-17A水平进行分组,低水平组的ORR高达54.55%,明显优于高水平组,提示IL-17A的水平可能与顺铂的疗效相关。笔者进一步观察患者的预后,结果显示IL-17A高水平组中位生存期估值为5个月,与IL-17A低水平组的9个月具有明显统计学差异;从研究可知,血液中IL-17A水平的高低与肺癌合并胸腔积液患者预后密切相关。
大量研究数据证实IL-17A在促进肿瘤生长和转移方面具有重要作用,与肿瘤患者预后密切相关[16]。本研究结果亦表明IL-17A可作为一种预测肺癌患者预后的有效生物标记物。近年,IL-17A拮抗剂作为新型免疫抑制剂在几个炎症性疾病中取得巨大的突破[17]。IL-17A拮抗剂是否可作为一种新的、有效的非小细胞肺癌治疗方法尚无明确指南和共识。本研究为回顾性分析,可能存在信息不全面、偏倚等缺点,有待于大样本多中心进一步分析和扩展我们的结论,为预后评估及治疗提供帮助。

