COL3A1在胃癌中的表达及意义
姜洪伟,胡 琦,白钰灵,王 举,套格苏,李海军
(1.内蒙古自治区人民医院 胃肠外科,内蒙古 呼和浩特010017;2.内蒙古医科大学研究生学院;3.赤峰市敖汉旗医院 普外科;4.赤峰市医院 肛肠外科)
既往研究关注肿瘤细胞本身基因突变、拷贝数异常、启动子区域甲基化异常。但随着研究的深入,发现肿瘤微环境 (TME)是影响肿瘤发生、侵袭及转移的重要功能和结构单元[1]。细胞外基质(ECM) 指环绕细胞的整个细胞外环境,由多种复杂大分子物质构成。ECM同时也是TME的一部分,含有的主要蛋白成分有胶原蛋白、纤连蛋白(FN)、层粘连蛋白(LN)、弹性蛋白等,另外还有蛋白聚糖与氨基聚糖等糖蛋白。COL3A1基因位于人2号染色体q24.3-q3区域,全长约44 kb,编码Ⅲ型胶原α-1链[2]。Fagerberg等人[3]对来自95个个体的27个不同的人体器官和组织中的COL3A1的mRNA水平进行了测序。COL3A1表达的改变往往会导致机体内结缔组织相关病变,如发生撕裂或穿孔,进而引起一系列疾病。COL3A1的不同遗传变异影响脑卒中[4]的复发和预后。COL3A1在脑皮层发育和中也起重要作用[5]。Horn Denise等人[6]报道了两个家族中双等位基因COL3A1变异的临床和分子特征,这两个家族中有特定的大脑异常和一个家族中的结缔组织异常。并认为COL3A1的双等位基因突变可以导致一种特殊的大脑表型,包括额顶突出的鹅卵石型多小脑回、小脑微囊肿和白质改变,以及一些患者的发育迟缓和癫痫发作。COL3A1的功能变异还可导致其他心血管异常,如颅内动脉瘤[7]。埃莱斯-当洛斯综合征(EDS)又称全身弹力纤维发育异常症。这是一种罕见的、危及生命的遗传疾病,常常影响到组织和血管的弹性使其变得更加脆弱而容易损伤,COL3A1基因编码区或内含子区突变可导致EDS,影响患者生存[8]。但目前关于COL3A1与胃癌关系的研究报道基本还只是停留在对已有癌症数据库的信息挖掘上,缺少进一步临床、表型及分子机制的研究。因此本研究采用qRT-PCR及免疫组化法检测胃癌及其正常组织中COL3A1的mRNA及蛋白表达水平,并初步探究COL3A1与胃癌临床及病理特征的关系。
1 材料与方法
1.1 标本及临床资料
收集2019-1-1至2020-12-1在内蒙古自治区人民医院行胃癌根治术且术后病检结果为胃癌患者的癌及其正常组织石蜡标本各50例,由2名高年资病理医师显微镜下确定富含胃癌及正常组织的蜡块,所有患者临床病理资料完整,石蜡标本均由我院病理科进行固定、HE染色及包埋后进行免疫组化检测。所研究的50例胃癌患者术后标本中:男性36例,女性14例;年龄在41-74岁范围当中,<60岁的16例,≥60岁的34例;癌组织分化为中、高分化的23例,低分化的27例;出现周围淋巴转移38例,其余12例未发现淋巴转移;按照美国癌症委员会( AJCC)的分期标准,其中Ⅰ-Ⅱ期20例,Ⅲ-Ⅳ期30例;按照浸润程度分类:T1-T2期11例,T3-T4期39例;按照肿瘤大小进行划分,其中超过5 cm的29例,不足5 cm的21例。另外收集10对新鲜胃癌组织及距离肿瘤>6 cm的正常组织作为对照,组织离体收集后立即用液氮运输,在-80℃冰箱中储存。患者均诊断为原发性胃癌,未经过放疗及化疗,且病理组织学类型均为腺癌。该实验经内蒙古自治区人民医院伦理委员会审批允许开展。
1.2 实验试剂

1.3 实验方法
1.3.1免疫组织化学染色 先对蜡块标本进行修整,然后进行切片。切片放于60℃烤片机上烤片,干燥后,取出,室温保存。切片经脱蜡水化、抗原修复后,使用3%的过氧化氢溶液浸润切片以封闭其内源性过氧化物酶,切片滴加COL3A1抗体4℃过夜孵育。放入苏木素中复染,分别使用75%、85%、95%浓度的酒精脱水,封片。免疫组化的染色结果判定:使用阳性染色区域所占百分比(<5%:0分;5%-25%:1分;26%-50%:2分;50%-75%:3分;>75%:4分)和染色强度(未着色:0分;淡黄色:1分;黄色:2分;棕黄色:3分)两个指标的乘积作为总得分用于评估切片,每个切片均在400倍镜下选择5个不同区域进行染色评估,且整个评估过程均由2名副高以上病理科医师独立双盲进行。总得分≥6分定义为高表达。
1.3.2qRT-PCR法检测COL3A1mRNA表达水平 根据TAKARA PrimeScriptTMRT reagent Kitwith gDNA Eraser试剂盒的标准操作步骤进行,提取 total RNA,3%琼脂糖凝胶电泳及紫外分光光度计用来测定RNA浓度和纯度,A260/A280比值在1.8-2.0之间。反转录后以 cDNA 为模板进行荧光定量 PCR。COL3A1引物序列:正向TTGAAGGAGGATGTTCCCATCT,反向ACAGACACATATTTGGCATGGTT。GAPDH引物序列:GAGTCAACGGATTTGGTCGT,反向TTGATTTTGGAGGGATCTCG。反应体系为cDNA 2 μl、PCR 上游引物 0.4 μl、PCR 下游引物 0.4 μl、SYBR Green solution 10 μl、灭菌双蒸水 7.2 μl。待反应结束后,通过溶解曲线对反应过程是否特异进行判定,每个样品mRNA相对表达量通过计算其各自的Ct值计算得出。
1.4 统计学分析
实验所得数据采用平均数±标准差(Mean±SD)表示,数据处理软件为GraphPad Prism 6及SPSS 22.0,所得数据采用t检验和χ2检验进行分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 qRT-PCR检测癌及正常组织中COL3A1的mRNA表达
检测结果表明,胃癌组织中COL3A1的mRNA表达水平(6.86±3.07)更高,显著高于正常组织(2.48±1.25),差异有统计学意义(t=4.181,P=0.0013)(图1)。此外,还通过免疫组化方法对50例胃癌患者的石蜡切片进行了进一步的验证。结果显示COL3A1蛋白主要定位于细胞外基质中,表现为细胞外网状或条状纤维。在癌及正常组织中均有表达。癌组织中可见染色增强,纤维增粗、紊乱、排列不规则。在胃癌组织及正常组织中,COL3A 1蛋白的高表达分别出现32例、16例,差异有统计学意义(χ2=10.256,P=0.001)(表1、图2、图3)。
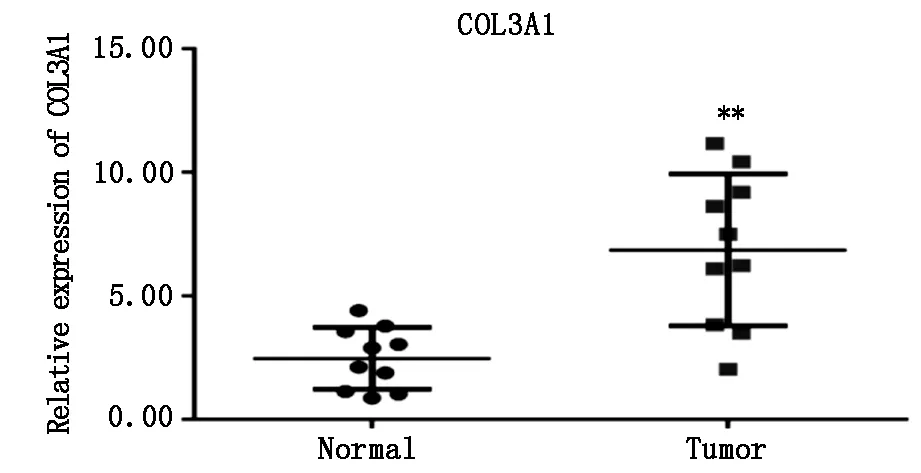
图1 COL3A1分别在胃癌及正常组织中的mRNA表达水平
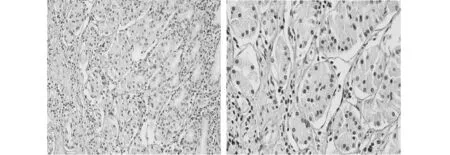
图2 免疫组化法检测COL3A1蛋白在正常组织中低表达(左图,200×;右图400×)
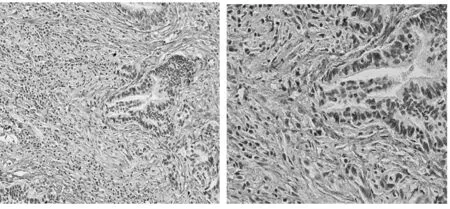
图3 免疫组化法检测COL3A1蛋白在胃癌组织中高表达(左图,200×;右图400×)

表1 COL3A1蛋白在胃癌及正常组织中的表达
2.2 COL3A1表达与胃癌各临床病理特征的关系我们发现COL3A1蛋白表达水平与AJCC 分期(P<0.001)、浸润深度(P=0.012)有关,而与性别(P=0.529)、年龄(P=0.880)、分化程度(P=0.869)、肿瘤大小(P=0.145)、淋巴结转移(P=0.416)等因素无关(表2)。
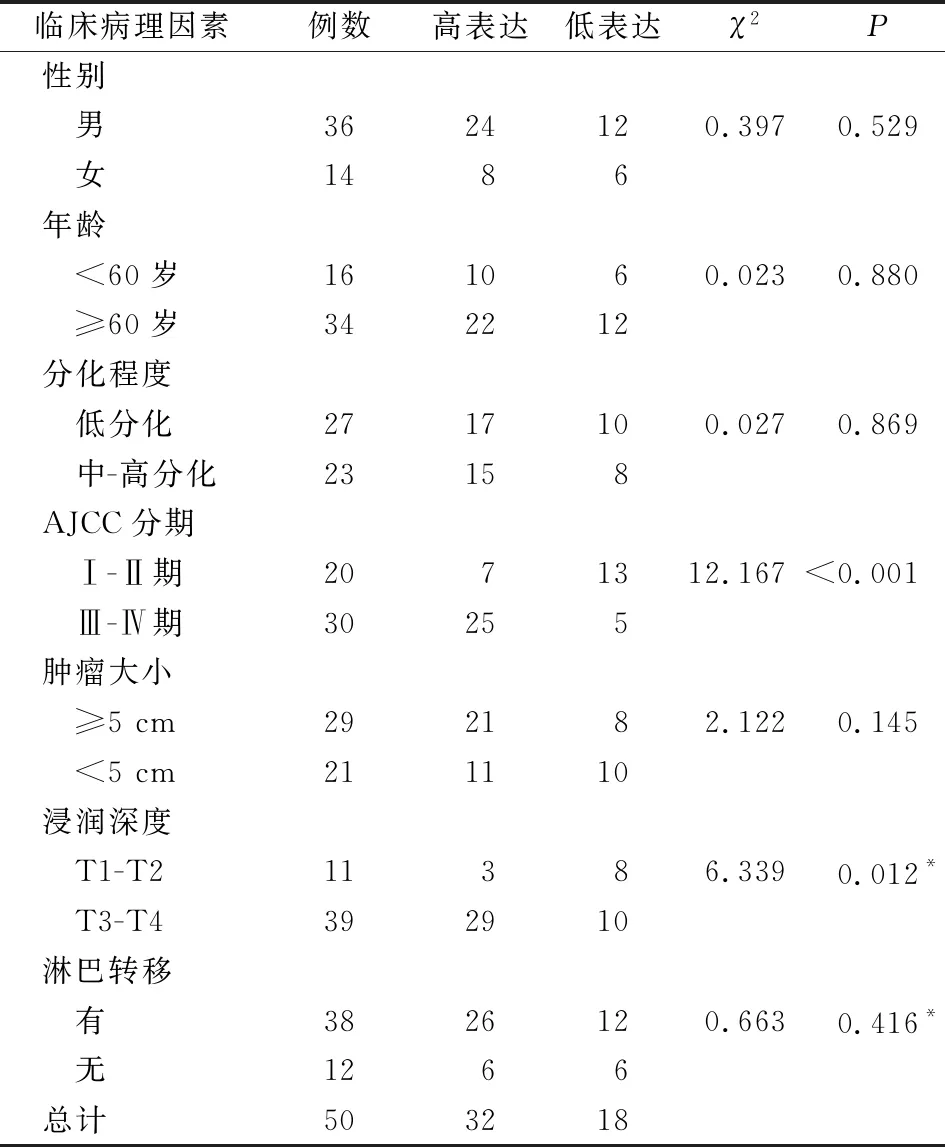
表2 COL3A1蛋白表达与胃癌各临床病理特征的关系
3 讨论
胃癌属于全世界恶性肿瘤中较为常见的一种,组织学上可分为腺癌、印戒细胞癌和未分化癌等[9],以腺癌最多见。根据对胃癌的发病数据统计,我国每年有超过41万例的新确诊病例[10]。随着内镜仪器和诊断技术及微创手术的发展,患者在早期可行内镜切除或腹腔镜胃切除术。但胃癌患者的生存率仍不乐观。随着对胃癌发病相关机制的进一步研究,如何做出更准确方便的早期诊断,评估胃癌患者的预后,并为胃癌患者提供合适的辅助治疗已经引起了研究者的广泛关注。
我们通过qRT-PCR检测10例新鲜的胃癌标本,结果发现胃癌组织中COL3A1的mRNA表达水平显著高于正常组织。然后对50例患者的病理石蜡切片行免疫组化实验,结果显示COL3A1主要定位于细胞外基质中,表现为细胞外网状或条状纤维。COL3A1在癌组织中染色增强,纤维增粗、不规则,在正常组织亦有表达。分析发现COL3A1在胃癌组织蛋白表达高于其正常组织。根据我们收集的患者临床病理资料,我们发现COL3A1蛋白表达水平与TNM 分期及浸润深度有关,而与别的因素无关。上述实验提示COL3A1在胃癌组织中的mRNA及蛋白水平均高于正常组织。关于COL3A1在恶性肿瘤中的作用,有一些与我们相似的研究。TianDing Shen[11]等用表皮生长因子(Epidermal growth factor EGF)处理人体成纤维细胞,发现丝裂原活化蛋白激酶(Mitogen-activated protein kinase MAPK)家族成员的表达趋势同COL3A1一样升高。由此认为EGF可以通过激活MAPK来促进COL3A1的表达增加。王颉等学者[12]使用Western blot法检测结直肠癌中COL3A1及蛋白激酶B (protein kinase B,PKB)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路蛋白水平的变化,过表达COL3A1后PKB/mTOR信号通路中的关键分子mTOR和PKB磷酸化程度显著增高,同时促进下游基因的表达。与其正常组织相比,结肠癌组织COL3A1的蛋白表达水平明显增高,且随肿瘤恶化程度的增高而增加,这表明COL3A1在结直肠癌中发挥促肿瘤生长的作用。Wang Xiao-Qing[13]等同样对COL3A1与结肠癌的关系进行了分析,发现COL3A1在结直肠癌上皮细胞中的高表达是影响预后的危险因素;体外细胞实验发现COL3A1通过刺激磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K) -AKT信号通路促进结肠癌细胞增殖,提示COL3A1可能是一个结肠癌潜在的治疗靶点。在一项对33个胶质瘤组织样本进行分析的研究[14]中,发现COL3A1 基因mRNA水平显著升高,且升高的表达与高表达级别胶质瘤的肿瘤级别相关。胶质瘤组织的免疫组织学染色在蛋白水平上显示了相同的结果。Becky[15]等人通过对小鼠的乳腺癌模型进行研究,发现COL3A1缺乏抑制了粘附、侵袭和迁移,但增加了乳腺癌细胞的增殖。上述研究结果与我们的结果相似,均提示COL3A1在恶性肿瘤中表达增加。有趣的是,在艾尔肯·肉孜比拉力[16]的研究中,她们发现的结果与我们相反,她们的免疫组化结果显示COL3A1在宫颈癌中表达低于正常宫颈组织,且人乳头状瘤病毒(HPV)阴性的宫颈癌细胞COL3A1的表达水平更高。过表达COL3A1后的宫颈癌细胞迁徙能力下降。Yu Shi[17]等人发现甲基转移酶样蛋白3 (METTL3)可以通过增加COL3A1的m6A甲基化而下调其表达,最终抑制三阴性乳腺癌 (TNBC)细胞的转移。这提示 COL3A1 在不同肿瘤中可能存在不同的功能,引起这种不同结果的原因可能是ECM与肿瘤细胞间的动态作用所致。综上所述,COL3A1在恶性肿瘤的发生发展过程中扮演着重要的角色,这为探究微环境与肿瘤细胞之间的相互作用提供了新的思路。
这些研究结果可能为指导胃癌的临床治疗提供新的依据,但是COL3A1与胃癌的关系还是有待进一步的深入研究。

