Au-Ag@PDA纳米颗粒介导的光热作用通过RNF20泛素化途径引起皮脂腺细胞缩小
金东成,赵 野,吴蓉慧,宋丹丹,赵天奇,朱明姬*
(1.吉林省中医药科学院第一临床医院,吉林 长春130021;2.吉林大学中日联谊医院 皮肤科,吉林 长春130033)
光热效应选择性作用于皮脂腺,抑制皮脂腺增生、抑制皮脂分泌,作为一种新的潜在的治疗痤疮的方法备受关注。Au-Ag@PDA纳米颗粒吸收近红外后具有良好的光热转换效率。本课题组首次发现干细胞膜载Au-Ag@PDA纳米颗粒,在808 nm激光照射后显著缩小金黄地鼠皮脂腺斑大小并减少皮脂分泌[1]。本实验通过蛋白质组学分析方法,分析光热作用于皮脂腺后蛋白质谱的变化,进一步探讨机制。为新型光敏剂治疗痤疮提供理论依据。
1 材料和方法
1.1 标本为课题组前期工作时制作的石蜡标本[1],标本均为金黄地鼠背部皮脂腺斑,金黄地鼠购自辽宁长生生物技术股份有限公司。本文重点分析两组石蜡标本:(A)空白组、(C)接菌并用 Au-Ag @ PDA NPs(40 μg/ml)处理后808 nm激光(0.5 W/cm2)照射3 min组。激光照射后第20天的皮脂腺斑组织石蜡标本。
1.2 实验方法
1.2.1蛋白提取 样品脱蜡处理后,转移到1.5 ml离心管中,分别加入4被体积裂解缓冲液(1%SDS,1%蛋白酶抑制剂),超声裂解。4℃12 000 g 离心10 min,去除细胞碎片,上清液转移至新的离心管。
1.2.2胰酶酶解 各样品蛋白取等量进行酶解,用裂解液将体积调整至一致。加入4被倍体积的预冷丙酮,涡旋混匀后加入4倍体积的预冷丙酮,-20℃沉淀2 h。4 500 g,离心5 min,弃上清,用预冷的丙酮洗涤沉淀2次。晒干沉淀后加入终浓度200 mM的TEAB,超声打散沉淀,以1∶50的比例(蛋白酶:蛋白,m/m)加入胰蛋白酶,酶解过夜。加入二硫苏糖醇(DTT)使其终浓度为5 mM,56℃还原30 min。之后加入碘乙酰胺(IAA)使其终浓度为11 mM,常温避光孵育15 min。
1.2.3液相色谱-质谱联用分析 肽段用液相色谱流动相A相溶解后使用NanoElute超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和100%乙腈溶液。液相梯度设置:0-70 min,6%-24%B,70-84 min,24%-35%B;84-87 min,35%-80%B;87-90 min,80%B,流速维持在450.00 nL/min。肽段经由超高效液相系统被注入Capillary离子源中进行电离然后进tims-TOF Pro质谱进行分析。离子源电压设置2.0 kV,肽段母离子及其二级碎片都使用高分辨的TOF进行检测和分析。二级质谱扫描范围设置为100-1700。数据采集模式使用平行累积串行碎裂(PASEF)模式。一张以级质谱采集后进行10次PASEF模式采集母离子电荷数在0-5范围内的二级谱图,串联质谱扫描的动态排除时间设置为30 s秒避免母离子的重复扫描。
1.2.4数据库搜索 二级质谱数据使用Maxquant 1.6.6.0进行检索。检索参数设置:数据库为Mesocricetus_auratus-10036(31693条序列),添加了反库以计算随机匹配造成的假阳性率(FDR),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为Trypsin/P;漏切位点数设为2;肽段最小长度设置为7个氨基酸残基;肽段最大修饰数设为5;First search和Main search一级母离子质量误差容忍度分别为20.0 ppm和20 ppm,二级碎片离子的质量误差容忍度为20.0 ppm。将半胱氨酸烷基化Carbamidomethyl(C)设置为固定修饰,可变修饰为[′Acetyl (Protein N-term)′,′Oxidation (M)′],定量方法设置为LFQ,蛋白鉴定,PSM鉴定的FDR都设置为1%。
1.2.5统计分析 所有实验均为3个重复。数据以平均SD表示。图表使用Graph Pad Prism 7.0和Excel Software 2007制作。采用SPSS 19软件进行统计学分析,采用单因素方差分析方法检验差异,以P<0.05为差异有统计学意义。
1.2.6免疫组化及结果分析 Anti-RNF20抗体(Affinity),免疫组化方法按试剂盒说明书操作。
分别以细胞核、细胞浆(或细胞外)出现黑褐色或棕褐色颗粒为强阳性表达,棕黄色颗粒为阳性染色,浅黄色为弱阳性,无色为阴性表达,随机观察5个具有代表性的高倍镜视野,阳性细胞(强阳性+阳性)百分比为5 个视野阳性细胞百分比的平均数。采用S PSS19.0 版本,计量资料采用t检验。
2 结果
2.1 Au-Ag
@ PDA NPs(40 μg /ml)处理后808 nm激光(0.5 W/cm2)照射3分钟组与空白对照组间蛋白质组学的变化中发现RNF20表达增加1.624倍。Akr1b1表达增加1.6145倍,CDKN1B、Marc1表达分别降低0.4367、0.4057倍(见表1)。
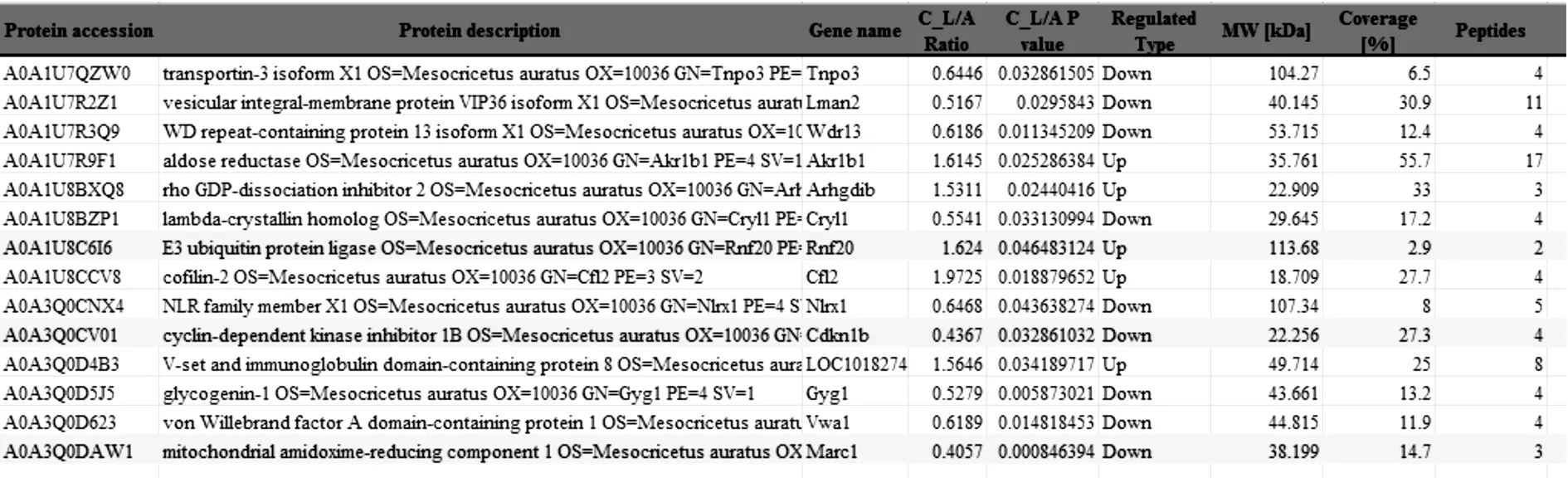
表1 Au-Ag @ PDA NPs处理后808 nm激光照射组与空白对照组间蛋白质组学的变化
2.2 免疫组化
Au-Ag @ PDA NPs(40 μg /ml)处理后808 nm激光(0.5 W/cm2)照射3 min后20天与空白对照组间石蜡标本免疫组化RNF20表达增加(见图1)
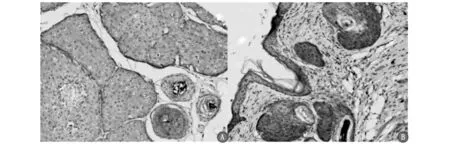
A:空白对照组;B:外用Au-Ag-PDA @ STCM纳米颗粒后808 nm激光照射20天后皮脂腺细胞明显缩小。免疫组化:RNF20核膜++
3 讨论
近年来,具有光热效应的纳米颗粒备受关注,在癌症的诊断和治疗中取得了很大的进步[2]。众所周知,银具有抗菌活性。金和银的组合具有良好的导热性,所以成为常见的光热治疗组合[3]。多巴胺具有良好的组织相容性,广泛用于各种疾病的诊断和治疗[4]。我们前期研究发现Au-Ag@PDA纳米颗粒,在808 nm激光照射后显著缩小金黄地鼠皮脂腺斑大小并减少皮脂分泌,并且808 nm激光在3 min的照射时间,0.5 W/cm2的强度下对皮脂腺的抑制增生作用最理想[1]。
光热效应选择性作用于皮脂腺,抑制皮脂腺增生、抑制皮脂分泌,作为一种新的潜在的治疗痤疮的方法备受关注。但由于毛囊皮脂腺单位中的皮脂腺,对近红光的吸收较低,迄今为止未取得满意的方法[5-6]。
5-ALA光动力疗法已广泛用于治疗痤疮,其作用机制为光热作用,但5-ALA的亲水性限制其在组织和细胞膜间的通透性,影响光动力疗法的治疗效果。纳米金是粒径1-100 nm的金颗粒分散体系,具有生物相容性和良好的光热转换作用,即在一定光照下,纳米金能够吸收光,将光能转化为热能,传递给周围组织,使附近的物质温度升高[7],引起细胞死亡。然而,如何增加靶组织的选择性光热作用,减少靶组织外的热损伤一直是研究热点。2015年Dilip Paithankar等[8]报道了利用超声导入一个聚乙二醇(PEG)涂层的二氧化硅核心(直径120 nm),被15 nm厚的金壳包围的金颗粒的方法增加了金颗粒富集在毛囊皮脂腺单位,增加了金颗粒渗透到皮脂腺部位,近红外光照射后,84%的漏斗部和47%的皮脂腺浅表部分发生了局部热损伤。推测的作用机制是,由于金微粒对光线的吸收,带有漏斗和皮脂腺的毛囊皮脂腺单位被加热,导致局部热损伤,使毛囊内容物汽化,并损伤皮脂腺,导致皮脂分泌减少。然而,有关金壳与二氧化硅的大小、厚度、比例的调整及超声参数的调整,需要进一步的研究。
目前金银纳米颗粒介导的光热疗法做为一种非侵入性治疗方法在肿瘤方面的研究日益增多[9]。然而,其穿透深度不足,肿瘤缺氧和单一治疗方法严重限制了治疗的有效性。我们发现Au-Ag@PDA纳米颗粒被干细胞膜微粒包裹后,可以促进细胞对纳米颗粒的摄取,提高纳米粒子分散性和生物相容性,进一步优化其光热治疗效率,光热作用效果更持久[1]。我们的研究发现,脐带来源的间充质干细胞膜纳米载药系统载Au-Ag@PDA(Au-Ag-PDA @ STCM)纳米颗粒做为新型低浓度光敏剂在808 nm激光功率密度0.5 w/cm2、3 min照射时间下皮脂腺体积显著缩小,减少皮脂分泌,但仍见到完整的表皮[1],光热作用较Au-Ag@PDA更持久。Au-Ag-PDA @ STCM 纳米颗粒处理SZ95细胞后808 nm激光照射[1]。我们研究发现[10]干细胞膜纳米载药系统载异维A酸通过提高cavolin-1的表达,增强细胞内吞作用加强干细胞膜载药的透皮能力,促进药物到达靶部位。推测,Au-Ag@PDA纳米颗粒被干细胞膜微粒包裹后,可以促进细胞对纳米颗粒的摄取,提高纳米粒子分散性和生物相容性,进一步优化其光热治疗效率,光热作用效果更持久。干细胞膜载金银纳米颗粒在808 nm激光照射后的光热转换对皮脂腺的抑制增生作用对痤疮的治疗领域将会提供非常有意义的治疗手段。
雄激素通过抑制皮脂腺细胞自噬、阻断皮脂降解,促进痤疮的发生发展。抑制雄激素的分泌,可以解除自噬抑制,减少皮脂腺的分泌。皮肤科常用于治疗痤疮的抗雄激素类药物能下调皮脂腺细胞的mTORC1,可促进自噬,从而起着治疗痤疮的作用[11]。
我们发现,Au-Ag-PDA @ STCM 纳米颗粒涂抹金黄地鼠两侧背部皮脂腺斑后808 nm近红外激光照射时,组织中Cdkn1b蛋白表达下调,Rnf20蛋白表达明显上调。Cdkn1b蛋白是一种磷酸激酶的抑制剂,同时有文献报道Cdkn1b蛋白与自噬相关;Rnf20蛋白是一种E3连接酶,会影响蛋白的降解;在Cdkn1b蛋白表达下调过程中,会增加蛋白质的磷酸化,从而促进ATP到ADP的过程;而这个过程的促进,会增加E1激活酶的活性,从而促进E2连接酶,以及最终使得E3连接酶的表达增加,而Rnf20正是在这个过程中增加的。Rnf20的增加会影响蛋白质的泛素化,使得泛素化水平增加,从而使蛋白更容易发生降解。
敲除RNF20后,H2Bub显著降低,H2Bub1主要由RAD6-RNF20泛素化机制催化,H2Bub1是调控自噬的表观遗传新途径[12]。自噬与蛋白的泛素化在细胞内是协同作用的,一些聚集的蛋白能够通过自噬途径降解,它们首先被多聚泛素化修饰,然后才被p62识别后运送到自噬体内降解[13]。
在生理条件下,转录因子HSF1仍然是细胞质中的一个单体。在热应激过程中,HSF1被迅速转化为活性形式,激活后启动Hsp70的转录和合成,热休克蛋白70是HSF1的转录靶点[13]。当细胞应激反应发生时,热休克蛋白大量表达,其作用是识别错误折叠的蛋白质,并标记他们以供蛋白酶体的降解[13]。Hsp70可以结合到错误折叠的蛋白质上,并引导E3泛素连接酶(如CHIP)将错误折叠的蛋白质标记上泛素,使得蛋白酶体能够降解它们[14]。多种机制解释了HSP27和HSP70的细胞保护作用。这两种蛋白质都是强大的伴侣。它们均在线粒体前后水平抑制凋亡机制的关键效应因子[13]。在应激条件下参与蛋白酶体介导的蛋白质降解,从而促进所谓的“蛋白质分类”[14]。目前,已经证实Hsp27和Hsp90具有提高泛素,蛋白酶体活性的功能。例如,Hsp27能够直接与多聚泛素链和26s蛋白酶体相互作用[13]。中暑等热应激诱导HSP70的增加,进一步诱导ATG5-ATG12复合物及LC3的增加,促进自噬,上调HSP70促进自噬[15]。
自噬长期以来被认为是一种主要涉及膜相关融合事件的细胞质细胞过程。然而,越来越多的研究表明,表观遗传修饰(如hMof-H4K16ac和G9a-H3K9me2轴)参与了自噬相关的细胞命运的确定和自噬活性[4,16]。H2B单双酯化(H2Bub1)是一种新的、关键的表观遗传开关,用于测定自噬活性[17]。这些研究为表观遗传调控因子可能在自噬调控中发挥关键作用提供了直接支持。H2Bub1可能是对环境的一个即时反应因子,通过营养变化来控制自噬的活性。组蛋白H2A和H2B以及肿瘤抑制因子p53依赖于RNF20的基因表达。RNF20抑制一些原癌基因的表达[18]。RNF20蛋白是一种E3连接酶,RAD6-RNF20泛素化复合体可能是唯一公认的一种H2Bub1的泛素化酶[18]。有研究发现自噬相关蛋白ATG5通过转录控制RNF20调控组蛋白H2B单泛素化[19]。
Au-Ag@PDA NPs光热作用于膀胱癌细胞后上调HSP70[20],我们前期研究发现金黄地鼠皮脂腺斑在干细胞膜载Au-Ag@PDA纳米颗粒的光热作用后RNF20表达增加。
我们推测,Au-Ag-PDA@做为新型光敏剂,它的光热作用通过HSP70-RNf20-H2Bub1途经诱导皮脂腺细胞自噬降解使皮脂腺细胞变小,抑制皮脂分泌达到治疗痤疮的目的。
总之,本研究首次发现Au-Ag@PDA纳米颗粒介导的光热作用通过RNF20泛素化途径引起皮脂腺细胞缩小,抑制皮脂分泌。为新型光敏剂治疗痤疮提供有价值的理论依据。相关的具体机制有待进一步研究。

