miR-181a通过调节Bcl-2逆转白血病细胞的耐药作用
卢慧敏,韩高华,钱静宇
(南京医科大学附属泰州人民医院,江苏 泰州 225300)
白血病是一类高度异质性的血液系统恶性肿瘤,按分化程度可分为急性和慢性。急性粒细胞白血病(Acute myeloid leukemia,AML) 是由转化的造血干细胞(Acute myeloid leukemia, HSC)通过获得性遗传异常(包括染色体重排和多基因突变)而产生的克隆性扩增及造血分化受损导致的。因其恶化快速,若没有进行适当的治疗可能在短时间内致命。获得性突变增强HSC 的自我更新和增殖,其中正常的分化机制受损,最终导致异常未成熟白血病原始细胞的克隆扩增,使得这些原始细胞在骨髓中积累,逐渐取代正常的造血组织,干扰正常血细胞的产生,导致造血功能受损和骨髓衰竭,出现血细胞减少的现象[1]。
AML常在老年人中高发。据报道,AML 的发病率为每100,000 人3~5 例,中位诊断年龄约为68 岁。虽然AML 在男性中的发病率略高于女性(比例为5∶3),但在种族和民族上相似。目前,只有大约35%~40%的小于60岁的患者和5%~15%的大于60 岁的患者可治愈该疾病。10%~40%的患者在强化诱导治疗后仍未达到CR,并被认为患有原发性难治性疾病。尽管部分患者能够达到CR,超过50%的患者随后疾病复发。对于复发的患者,其中只有一小部分患者能成功获得第二次CR。此外,鉴于并存疾病和缺乏合适的供体,这些患者通常不适合进行异体造血干细胞移植(alloHSCT)治疗。因此,这为复发性和难治性AML的治疗留下了巨大的临床需求[2]。
miR-181a 是研究较多的一种与造血调控相关的MicroRNA (miRNA),与B 细胞分化相关。miR-181a与多种肿瘤细胞如胶质瘤、胰腺癌等增殖侵袭相关[3,4]。近年,miR-181a 与白血病的关系也广受关注,Li 等[5]研究发现miR-181a 可促进柔红霉素耐药的K562/A02细胞凋亡。miR-181a与白血病细胞耐药之间的关系及其分子机制,目前鲜有报道,本研究从临床标本出发,通过进一步分析HL60及其阿霉素耐药株HL60/ADR细胞中miR-181a 和Bcl-2 的表达差异,探讨miR-181a 与白血病细胞耐药的关系。
1 材料与方法
1.1 研究对象 选取2019 年1 月至2021 年3 月经泰州市人民医院血液内科确诊的AML 患者45 例,其中初诊22 例,完全缓解者12 例,复发11 例。男性25 例,女性20 例;年龄63~80 岁,中位年龄67.45岁。正常对照10例,其中男性5例,女性5例;年龄52~78岁,中位年龄64.57岁。
1.2 骨髓标本有核细胞分离 取EDTA-K2 抗凝的骨髓标本1.5ml 加入红细胞裂解液5~8ml,充分混匀,放置约10min,直至红细胞完全破坏。1500r/min离心5min,丢弃上清,滴加约10ml生理盐水重悬,1500r/min 离心5min,共洗涤3 次。弃上清后加入1ml Trizol 液,再转移到EP 管里,保存于-80℃冰箱以备用。
1.3 寡核酸探针 所有寡核酸探针均购自广州锐博生物有限公司,miR-181a 模拟物序列是5’-AACAUUCAACGCUGUCGGUGAGU-3’;miR-181a抑制物序列是5’-UCACCGACAGCGUUGAAUGUUU U-3’;对照序列是UUCUCCGAACGUGUCACGUTT。
1.4 细胞培养与转染 HL60及HL60/ADR细胞购于中国科学院上海细胞库,均用含10%胎牛血清(Gibco,USA)的RPMI 1640培养基(Gibco,USA),并将细胞培养于37℃、5%CO2培养箱。加入1.0mg/L 阿霉素(深圳市思美泉生物科技有限公司)以维持HL60/ADR细胞株的耐药性,停药2周后进行后续实验。HL60及HL60/ADR 细胞培养于六孔板中,当细胞融合度达到80~90%时细胞转染。细胞转染过程均按脂质体2000(Invitrogen,USA)试剂说明书进行实验。脂质体2000 的终浓度为1μg/mL,寡核苷酸及质粒的转染终浓度分别为200 nmol/L 及1μg/mL。将寡核苷酸及质粒与脂质体2000 置于无血清RPMI 1640 培养基中混匀,用于后续细胞转染实验,48h后收集细胞以进行细胞生物学实验。
1.5 MTT 法检测细胞存活率 以48 孔板上每孔4×104个细胞的密度接种于细胞板内,细胞在培养箱中培养过夜后转染寡核酸探针。细胞转染24h后,将配好的不同浓度的阿霉素加入细胞中,最后置于培养箱中培养。处理48h 后,向每孔中加入25 μl 配好的MTT 溶液,再置于培养箱中培养。4h 后将48孔板中的培养液倒掉,每孔加入300 μl DMSO溶解蓝色结晶,然后将48孔板放入酶标仪中37℃孵育10 min,在570 nm下测定每孔的吸光度。
1.6 实时荧光定量PCR检测miR-181a和BCL-2的表达 利用Trizol(Invitrogen, USA)提取骨髓有核细胞、HL60细胞或HL60/ADR细胞的总RNA。采用TaqMan MicroRNA Reverse Transcription Kit(Life Technologies, USA)将总RNA 逆转录成特定microRNA的cDNA:miR-181a和内参U6的特异性逆转录引物分别为:5’-GTCGTATCCAGTGCAGG GTCCGAGGTAT-TCGCACTGGATACGACACTCAC-3’;5’-GTCGTATCCAGTGCAGGGTCCGA-GGTAT TCGCACTGGATACGACACGATT-3’。使用TaqMan MicroRNA Assay Kit(Applied Biosystems,USA)检测miR-181a 的表达水平。其中miR-181a 和U6 定量PCR 上游引物分别为: 5’-GAACATTCAACGC TGTCG-3’;5’-CCTGCGCAAGG ATGAC-3’。下游引物均为5’-GTGCAGGGTCCGAGGT-3’。采用ReverTra Ace qPCR RT Kit (TOYOBO, Japan)将总RNA 逆转录成cDNA,并使用SYBR Green Realtime PCR Master Mix(TOYOBO, Japan)检测Bcl-2 的mRNA 水平。其中Bcl-2 定量引物序列为5’-ATGGCGCACGCTGGGAGAACAGGGT-3’(上游引物)和5’-ACAGCCAGGAGAAATCAAA CAGAGGC-3’(下游引物)。使用β-Actin 作为内参,其序列为5’-CAGAGCCTCGCCTTTGCC-3’(上游引物)和5’-GTCGCCCACATAGGAATC-3’(下游引物)。PCR扩增程序如下:94℃变性5 min,随后94℃作用30 s,60℃作用30 s,72℃作用40 s,共进行40个循环。
1.7 Western Blot实验 将HL60或HL60/ADR细胞置于RIPA 裂解液中(50 mM Tris–HCl,pH 7.4;1% NP-40; 150 mM NaCl; 1 mM EDTA;1 mM phenylmethylsulfonyl fluoride)。使用10%SDS-聚丙烯酰胺凝胶电泳(SDS-Polyacrylamidegelelectrophoresis, SDS-PAGE)将蛋白进行分离,再转移到PVDF膜(Millipore,USA)上。将PVDF膜置于5%脱脂奶粉里封闭2h 后,将其置于4℃用Bcl-2(Abcam,UK)或β-actin 抗体(Santa Cruz Biotechnology,Canada)孵育过夜,抗体使用稀释度均为1∶1000。第二天将辣根过氧化物酶标记的二抗滴加于PVDF膜上,在室温中孵育1小时。ECL显色后曝光。
1.8 统计学方法 采用Graphpad Prism 5软件进行分析,应用配对T 检验进行统计学分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-181a 和Bcl-2 在临床标本中的表达水平 通过实时荧光定量PCR 方法,分别检测了miR-181a 和Bcl-2 在正常者、AML 初诊者、复发者和缓解者样本中的表达,以正常者的表达水平设为1。结果如图1 所示,与正常者的样本比较,缓解者样本中miR-181a 和Bcl-2 表达量差异均无统计学意义(P>0.05)。而与缓解者的样本比较,初诊者和复发者样本中miR-181a 表达量均下降,Bcl-2的表达量均升高,差异均有统计学意义(P<0.05)。这一结果说明miR-181a 低表达以及Bcl-2的高表达可能与临床复发相关。
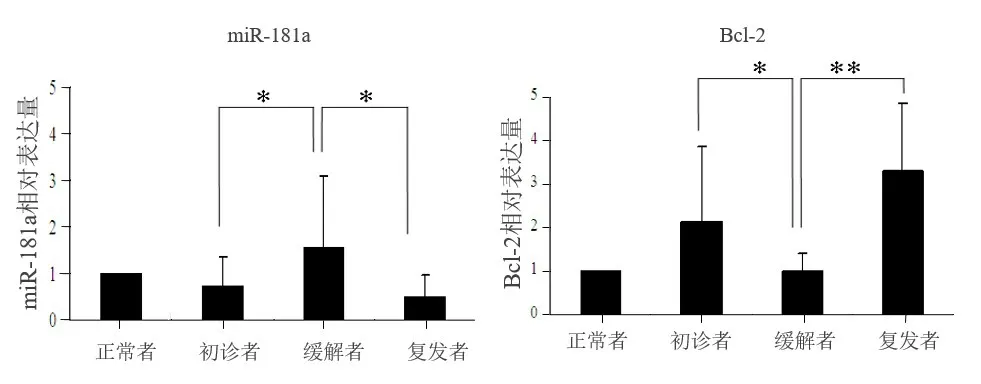
图1 miR-181a和Bcl-2在临床样品中的表达水平
2.2 HL60 及HL60/ADR 细 胞 中miR-181a 和Bcl-2 的表达水平 实时荧光定量PCR 分别检测HL60 和HL60/ADR 细 胞 中miR-181a 和Bcl-2 的mRNA 表达水平变化。结果如图2 所示,与HL60细胞比较,HL60/ADR 细胞中miR-181a 的mRNA表达水平明显降低,差异有统计学意义(P<0.01);而HL60/ADR 细胞中Bcl-2 的表达水平明显升高,差异有统计学意义(P<0.01)。Western Blot 检测结果如图3 所示,与HL60 细胞比较,HL60/ADR细胞中Bcl-2的蛋白表达水平明显升高,差异有统计学意义(P<0.01),表明miR-181a低表达及Bcl-2的高表达与细胞耐药紧密相关。
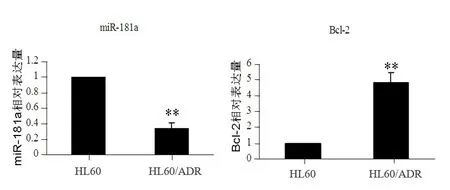
图2 miR-181a和Bcl-2在HL60及HL60/ADR细胞中的表达水平
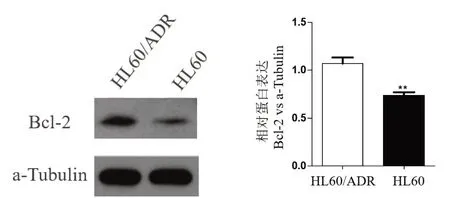
图3 Bcl-2在HL60/ADR和HL60细胞中的蛋白表达水平
2.3 miR-181a 能逆转白血病细胞的耐药性 将miR-181a 模拟物转染入HL60/ADR 细胞中。24h之后,将配好不同浓度的阿霉素(0.2、0.4、0.8、1.6、3.2、6.4mg/ml)加入细胞中。刺激48h,通过MTT 法检测处理后细胞的存活率,并计算细胞的半数抑制浓度IC50。结果如图4A所示,未转染的HL60/ADR细胞IC50值为4.67 mg/ml。与转染对照寡核苷酸探针的HL60/ADR 细胞比较,转染miR-181a模拟物的细胞的存活率显著降低,差异有统计学意义(P<0.01)。转染对照探针的细胞IC50 为3.69 mg/ml,而转染miR-181a 模拟物的细胞IC50 为1.44 mg/ml,说明细胞对药物变得敏感。同样地,将miR-181a 抑制物转染入HL60 细胞,24h 之后,将配好不同浓度的阿霉素(0.2、0.4、0.8、1.6、3.2、6.4mg/ml)加入细胞中。刺激48h,通过MTT 法检测处理后细胞的存活率,并计算细胞的半数抑制浓度IC50。结果如图4B 所示,未转染的HL60 细胞IC50 值为0.08 mg/ml。与转染对照寡核苷酸探针的HL60 细胞比较,转染miR-181a 抑制物的细胞的存活率显著升高,差异有统计学意义(P<0.01)。转染对照探针的细胞IC50为0.07 mg/ml,而转染miR-181a 抑制物的细胞IC50为0.51 mg/ml,表明细胞对药物敏感性降低。综上所述说明miR-181a 能改变白血病细胞的耐药性。当miR-181a表达增强时,药物对白血病细胞起一定的作用;当miR-181a表达减少时,药物对白血病细胞没有作用。
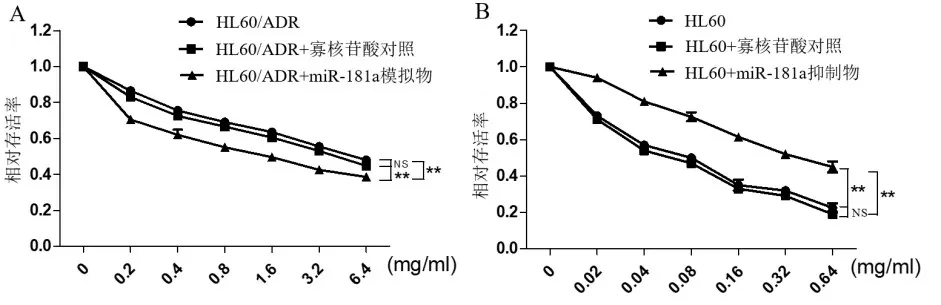
图4 miR-181a对HL60/ADR和HL60细胞增殖抑制的影响
2.4 miR-181a 能调节白血病细胞中Bcl-2 的表达 与转染对照寡核苷酸探针的HL60/ADR 细胞比较,转染miR-181a 模拟物的细胞中Bcl-2 的表达水平明显减少,差异有统计学意义(P<0.01)(图5A);与转染对照寡核苷酸探针的HL60 细胞比较,转染miR-181a 抑制物的细胞中Bcl-2 的表达水平明显提高,差异有统计学意义(P<0.01)(图5B)。Western Blot 检测结果与定量PCR 一致,与转染对照寡核苷酸探针的HL60/ADR 细胞比较,转染miR-181a模拟物的细胞中Bcl-2的蛋白表达水平明显减少,差异有统计学意义(P<0.01)(图5C);与转染对照寡核苷酸探针的HL60细胞比较,转染miR-181a抑制物的细胞中Bcl-2的蛋白表达水平明显提高,差异有统计学意义(P<0.01)(图5D)。
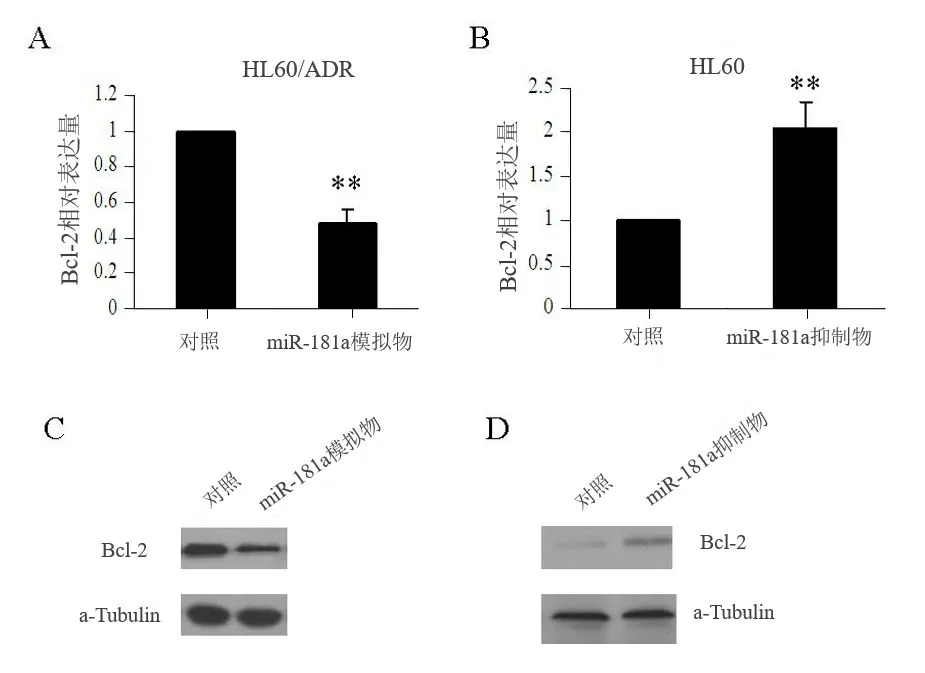
图5 miR-181a对Bcl-2表达的调节作用
3 讨论
microRNA(miRNAs)是一类广泛表达于后生动物和真核生物中的非编码的小(长度约22个核苷酸)RNA。miRNA 似乎是肿瘤发生和产生耐药性的重要调节因子。目前,少有研究探讨miRNA在造血中的重要性,仍需更多的研究。miR-181a是近年来广泛研究的一类与造血调控相关的miRNA,不仅可以促进B 细胞分化,而且有研究表明miR-181a 在T 细胞成熟中具有重要作用,其在CD4+CD8+T 细胞发育阶段特异性富集,并能够抑制阳性选择和T 细胞成熟相关的基因表达,如Bcl-2、CD69和TCR[6]。
近年来,越来越多的研究关注miR-181a与白血病之间的关系。miR-181a作为正常造血的调节因子,其破坏与各种类型的癌症有关,包括血液系统恶性肿瘤。它是淋巴细胞中含量最丰富的miRs之一。在AML中,miR-181a具有致癌基因以及肿瘤抑制基因的双重作用,这取决于细胞环境及其靶标的后续表达[7]。Xu 等[8]研究表明人白血病细胞HL60中过表达miR-181a能抑制细胞的增殖。
本研究通过临床标本的检测发现,AML 复发患者骨髓核细胞中除了miR-181a低表达,另一个与白血病发生相关的重要分子Bcl-2高表达,这一结果说明miR-181a和Bcl-2可能都与AML复发相关。进一步通过细胞转染、实时荧光定量PCR、Western Blot 及MTT 法检测结果证实了与HL60/ADR 细胞比较,HL60 细胞中miR-181a 的表达水平明显升高。通过miR-181a模拟物和抑制物的转染结果进一步发现,过表达miR-181a 的HL60/ADR 细胞存活率明显减少,其IC50 由3.69 mg/ml降低为1.44 mg/ml,说明HL60/ADR 细胞的耐药性下降。反之,低表达miR-181a的HL60细胞存活率明显提高,其IC50由0.07 mg/ml增加为0.51 mg/ml,说明HL60 细胞的耐药性增强。这些结果表明miR-181a不仅参与了白血病细胞的增殖抑制,而且参与了白血病细胞的耐药。阿霉素对HL60/ADR 细胞抑制的IC50 值为4.67 mg/ml,而对HL60细胞抑制的IC50值为0.08 mg/ml,HL60/ADR耐药倍数约为58 倍,与文献报道一致[9]。与HL60 比较,HL60/ADR 中Bcl-2表达水平明显升高;与转染对照寡核苷酸探针的HL60/ADR 细胞比较,转染miR-181a 模拟物的细胞中Bcl-2 的表达水平明显减少,差异有统计学意义(P<0.01);与转染对照寡核苷酸探针的HL60 细胞比较,转染miR-181a 抑制物的细胞中Bcl-2 的表达水平明显提高,差异有统计学意义(P<0.01),这些结果说明miR-181a对Bcl-2的表达具有负调控作用。
综上所述,本研究发现miR-181a参与白血病耐药形成,并发现miR-181a 可负调控Bcl-2 的表达。下调Bcl-2 可引发细胞凋亡,这表明miR-181a 可能通过靶向Bcl-2 发挥其作用。在该项研究中,发现miR-181a 低表达是Bcl-2 在HL60/ADR细胞中高表达的原因之一,Bcl-2表达的调控机制仍有待进一步研究。由于此次临床样本量较少的原因,通过构建相关细胞株验证相关结论。因此,后续仍需更多的标本量和更严格的前瞻性临床研究,进一步探索白血病的耐药及复发的分子机制,为逆转白血病耐药提供潜在的作用新靶点,有助于为AML 患者的未来诊断、治疗和预后开辟新的可能性。

