安罗替尼联合信迪利单抗治疗复发性胆管癌1例
王忠辉,陈国林,苏树英
胆管癌(cholangiocarcinoma,CCA)是一类原发于胆管上皮细胞的恶性肿瘤,由于早期症状隐匿,胆管细胞癌患者往往诊断较晚,预后较差[1]。根据原发肿瘤发生位置的不同,胆管癌可分为肝内胆管癌(intrahepatic cholangiocarcinoma,ICCA)及肝外胆管癌(extrahepatic cholangiocarcinoma,ECCA),肝外胆管癌又可根据原发肿瘤与胆囊管开口的相对位置分为肝门部胆管癌(hilar cholangiocarcinoma,HCCA)及远端胆总管癌(distal cholangiocarcinoma)[2]。外科根治性切除手术被认为是胆管癌的首选治疗方式[1]。对于晚期胆管癌患者,全身化学治疗是主要治疗手段,2010年,Valle等[3]报道的一项Ⅲ期临床试验证实了吉西他滨联合顺铂方案对进展期胆道肿瘤的疗效,为该方案成为胆道肿瘤标准一线化疗方案奠定了基础。然而,对于晚期及复发性胆管癌的患者,一线化疗方案的疗效仍难令人满意。近年来,针对胆管癌的靶向治疗和免疫治疗成为新的热点,国内外有零星病例报道。本文报道1例经外科根治性手术切除后拒绝辅助性化疗的远端胆管癌患者,术后5月即发现肿瘤肝内转移、肝门部淋巴结多发转移,予安罗替尼联合替吉奥治疗2月后停用替吉奥,再予安罗替尼联合9疗程信迪利单抗免疫治疗后坚持安罗替尼治疗,成功控制病灶进展、减少肿瘤负荷至临床治愈,显著提高了生活质量。报道如下。
1 病例资料
患者,女性,68岁,2020年6月17日因“反复右上腹痛1周”就诊于我院胆胰外科,既往体健,无家族性肿瘤病史。入院后实验室检查:WBC:5.36×109/L,HGB:119 g/L,PLT:390×109/L,ALT:222 IU/L,AST:207 IU/L,总蛋白:63.5 g/L,白蛋白37.9 g/L,TBil:11.0 μmol/L,DBil:4.1 μmol/L,IBil:6.9 μmol/L,AFP:5.63 ng/mL,CEA:3.00 ng/mL,CA19-9:184.28 U/mL。腹部B超:肝内胆管扩张(约3 mm);胆总管囊状扩张(范围约67 mm×28 mm);脾胰未见异常;双肾膀胱未见异常。腹部CTA见胆总管扩张并胆总管上段后壁占位(图1所示)。术前诊断考虑先天性胆管扩张症并恶变,相关检查未发现肿瘤远处转移,于6月24日接受根治性高位胆管切除+胰十二指肠切除术,术中见:胆总管上段至肝总管下段后壁一3 cm×3 cm×1 cm大小质硬肿块,边界欠清,侵犯肝右动脉近端。术中切除受肿瘤侵犯的肝右动脉;清扫第5、6、7、8、9、12、13组淋巴结。术后病理提示:(胆总管肿瘤)中分化腺癌,胆管型,大小约3.0 cm×2.5 cm×1.3 cm,癌组织浸润胆总管壁全层并突破至周围脂肪组织,可见广泛神经纤维侵犯,未见明确脉管内癌栓;周围胆总管黏膜呈重度非典型增生;两端切缘局部黏膜上皮呈轻-中度非典型增生(图2所示)。镜检淋巴结未见癌转移(0/11)。术后诊断:①胆管癌;②先天性胆管扩张症;③慢性胆管炎;④亚急性胆囊炎。术后恢复顺利,无相关并发症,患者未行肿瘤基因检测,拒绝术后辅助化疗,于2020-7-14(术后第20天)出院。出院后每月定期门诊复诊,无特殊情况。2020年11月23日患者因“间歇性上腹痛1周”再次入院,实验室检查:WBC:7.19×109/L,HGB:122 g/L,PLT:367×109/L,ALT:35 IU/L,AST:35 IU/L,总蛋白:64.5 g/L,白蛋白38.9 g/L,TBil:4.0 μmol/L,DBil:1.2 μmol/L,IBil:2.8 μmol/L,CA19-9:>1200 U/mL。全腹增强CT提示肝内多发转移癌并肝门淋巴结多发转移(图3A-B)。上腹部PET-CT提示肝内多发转移、肝门区淋巴结转移(如图3C-D所示)。遂于12月1日予替吉奥(40 mg po bid)+安罗替尼(12mg po qd)抗肿瘤治疗(家属拒绝PD-1治疗)。并于12月4日接受TACE局部治疗肝右叶转移灶,术后症状好转出院,定期门诊随访。2021年2月3日因“上腹痛不适、纳差、乏力1周”入院;入院实验室检查:WBC:17.82×109/L,HGB:141 g/L,PLT:32×109/L,ALT:42 IU/L,AST:32 IU/L,总蛋白:55.5 g/L,白蛋白31.3 g/L,TBil:13.8 μmol/L,DBil:6.0 μmol/L,IBil:7.8 μmol/L,CA19-9:>1200 U/mL;复查全腹增强CT:肝左叶转移灶较前稍缩小,但肿瘤压迫肝右前叶胆管合并胆管感染,遂于2月10日在B超引导下经皮穿刺肝右前叶胆管引流术。于2月13日予安罗替尼(12 mg po qd)联合信迪利单抗(200 mg iv.drip q3w)免疫治疗,停用替吉奥。定期复查腹部CT及血清肿瘤指标CA19-9,见肝内转移灶逐渐缩小,CA19-9指标持续下降(如图4、5所示)。11月19日行第9疗程信迪利单抗治疗,4天后患者突然出现左上腹疼痛,逐渐加重,偶伴剧烈胀痛,上腹部腹膜刺激明显;腹部增强CT、消化道造影等检查后明确诊断“胃肠吻合口瘘并局限性腹膜炎,胃肠炎症”,考虑为信迪利单抗治疗后免疫性胃肠炎所致,予禁食、肠内外营养支持、甲基强的松龙注射液40 mg qd×5 d抑制炎症反应,抑酸抑酶、抗感染、输液,腹腔积液穿刺引流等积极保守处理;于12月17日出院,继续家庭肠内营养支持。此后停用信迪利单抗。2022年1月7日门诊复查消化道造影提示胃肠吻合口通畅、未见明显造影剂外渗至腹腔,原胃肠吻合口瘘已闭合。2022年1月19日返院复诊,复查CA19-9:56.51 U/mL;于1月24日接受超声引导下肝左叶转移癌微波消融术巩固疗效;1月26日复查CA19-9:161.16 U/mL,2月16日复查CA19-9:51.70 U/mL,7月21日复查CA19-9:17.35 U/mL;复查CT提示肝左叶转移灶已基本吸收(图4D),达到临床治愈。截至目前,患者一般情况良好,坚持安罗替尼单药靶向治疗,定期门诊随访,生活质量满意。

图1 2020年6月17日上腹部CTA A:横断位平扫;B:横断位增强扫描;C:冠状位平扫;D:矢状位平扫注:各图红色箭头标记位置为胆总管后壁占位

图2 术后病理石蜡切片A:低倍镜视野(10倍);B:高倍镜视野(20倍);见明显异型性细胞
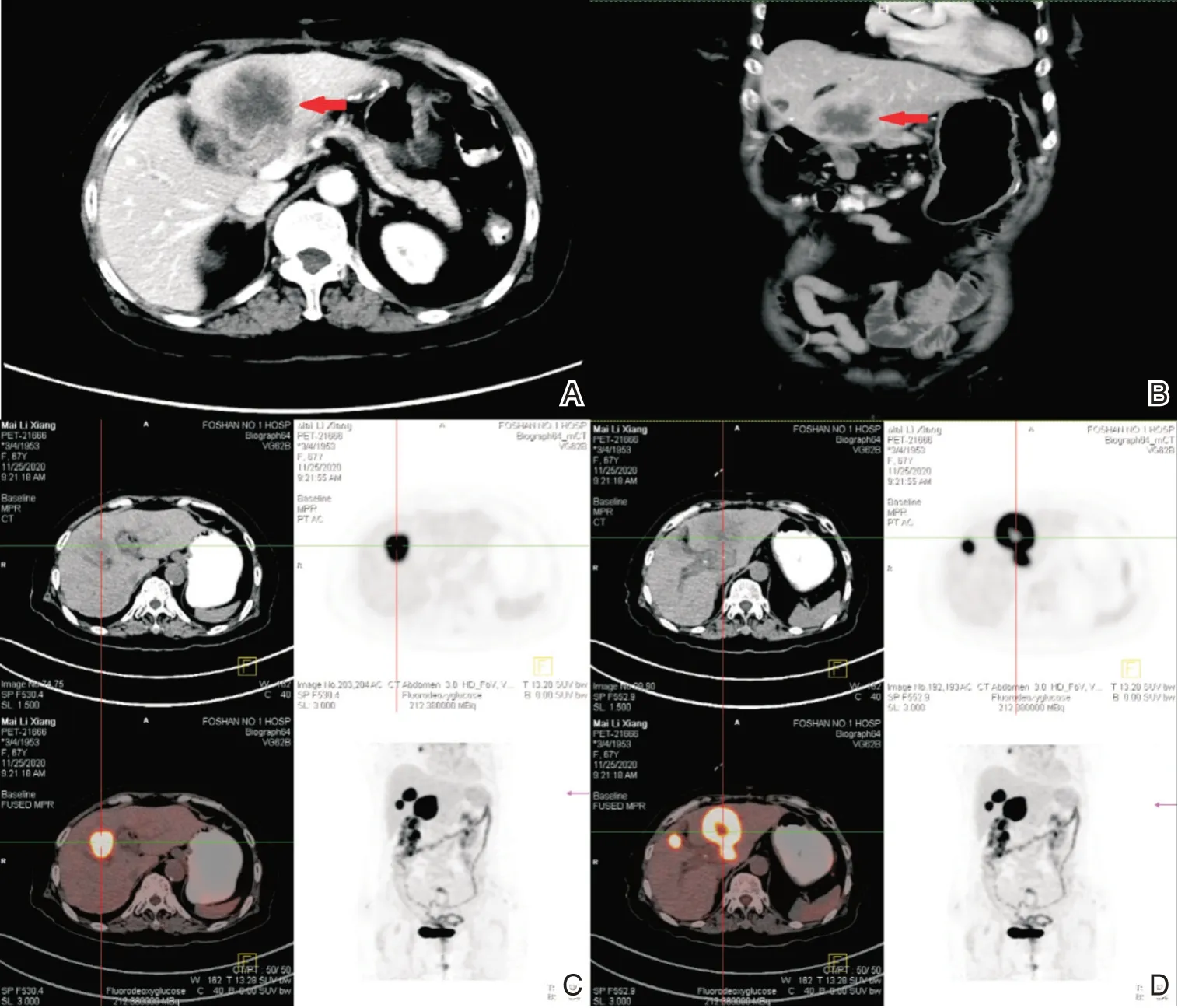
图3 2020年11月23日腹部增强CT及PET-CT A:腹部增强CT横断面肝左叶转移灶(红色箭头所示);B:腹部平扫CT冠状面肝左叶转移灶(红色箭头所示);C:腹部PET-CT横断面肝右叶转移灶;D:腹部PET-CT横断面肝左叶转移灶
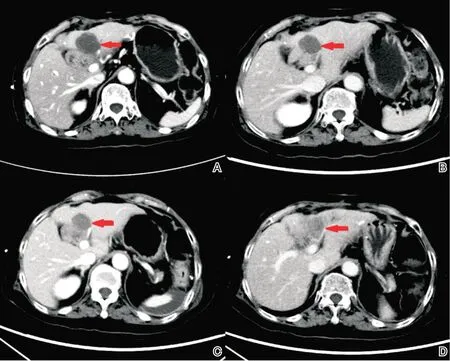
图4 安罗替尼联合信迪利单抗治疗后复查CT A:2021年4月27日上腹增强CT;B:2021年9月14日上腹增强CT;C:2021年11月29日上腹增强CT;D:2022年4月15日上腹增强CT;其中A~C红色箭头标记位置为肝左叶转移灶,逐渐缩小,D红色箭头标记见原肝左叶转移灶已完全坏死、无活性
2 讨论
本文报道1例胆管癌患者接受根治性切除手术后早期即发现肿瘤复发肝内转移并肝门淋巴结多发转移,予替吉奥+安罗替尼抗肿瘤治疗2个月后,加予信迪利单抗免疫治疗并停用替吉奥,共计予安罗替尼+9疗程信迪利单抗抗肿瘤治疗,复查影像学检查提示肝内及肝门转移瘤逐渐缩小、坏死并吸收,复查血清肿瘤指标CA19-9逐渐下降至正常值,达到临床治愈。患者一般情况良好,坚持安罗替尼单药靶向治疗,定期门诊随访,生活质量满意。
外科根治性切除手术被认为是各型胆管癌的首选治疗方式[1],但术后复发率较高,达49%~64%,绝大多数为肝内转移,且常发生于术后的2~3年内[4]。此例胆管癌患者接受了根治性高位胆管切除+胰十二指肠切除术,术中冰冻病理检查提示胆管远、近端切缘均未见癌,但术后石蜡切片见不同程度的不典型增生。患者术后5月即发现肿瘤肝内转移、肝门区淋巴结转移,原因可能与本例患者的肿瘤大小、已侵犯肝右动脉近端、手术切缘有不典型增生,肿瘤微转移以及术后未及时进行辅助性化疗相关。
对于胆管癌的化疗,Valle等[3]于2010年报道了ABC-02Ⅲ期临床试验,证实了吉西他滨联合顺铂对胆管癌的疗效,并成为胆管癌的一线辅助治疗方案。本病例因拒绝术后辅助化疗,直至发现肿瘤复发才开始接受安罗替尼联合不规律的口服替吉奥治疗。根据本例临床资料分析,口服替吉奥与转移灶的缩小及CA19-9的下降并没有时间上的关联,替吉奥对复发性胆管癌的疗效有待进一步探索。
近年来,随着对胆管癌基因表达谱研究的深入和基因测序技术的发展,已经发现了一些潜在的胆管癌治疗靶点,靶向治疗正成为胆管癌的治疗选择。本病例患者在发现肿瘤复发转移后不同意接受基因检测,与患者详细沟通及取得知情同意后,实验性予安罗替尼抗肿瘤治疗。安罗替尼(Anlotinib)是一种多靶点小分子络氨酸激酶抑制剂,特别针对血管内皮生长因子受体2型和3型(vascular endothelial growth factor receptor type 2 and 3,VEGFR-2/3)、血小板源性生长因子β(platelet-derived growth factor b,PDGFRb)以及干细胞因子受体(stem cell-factor receptor,c-Kit)等通路,能抑制肿瘤血管的生成,是晚期非小细胞肺癌的三线治疗用药[5]。2019年Zhang等[6]在国际上率先报道了一例安罗替尼治疗肝内胆管癌的病例,之后陆续有报道安罗替尼对胆管癌的治疗机制的体外研究[7-9],而国内也有零星个案报道。
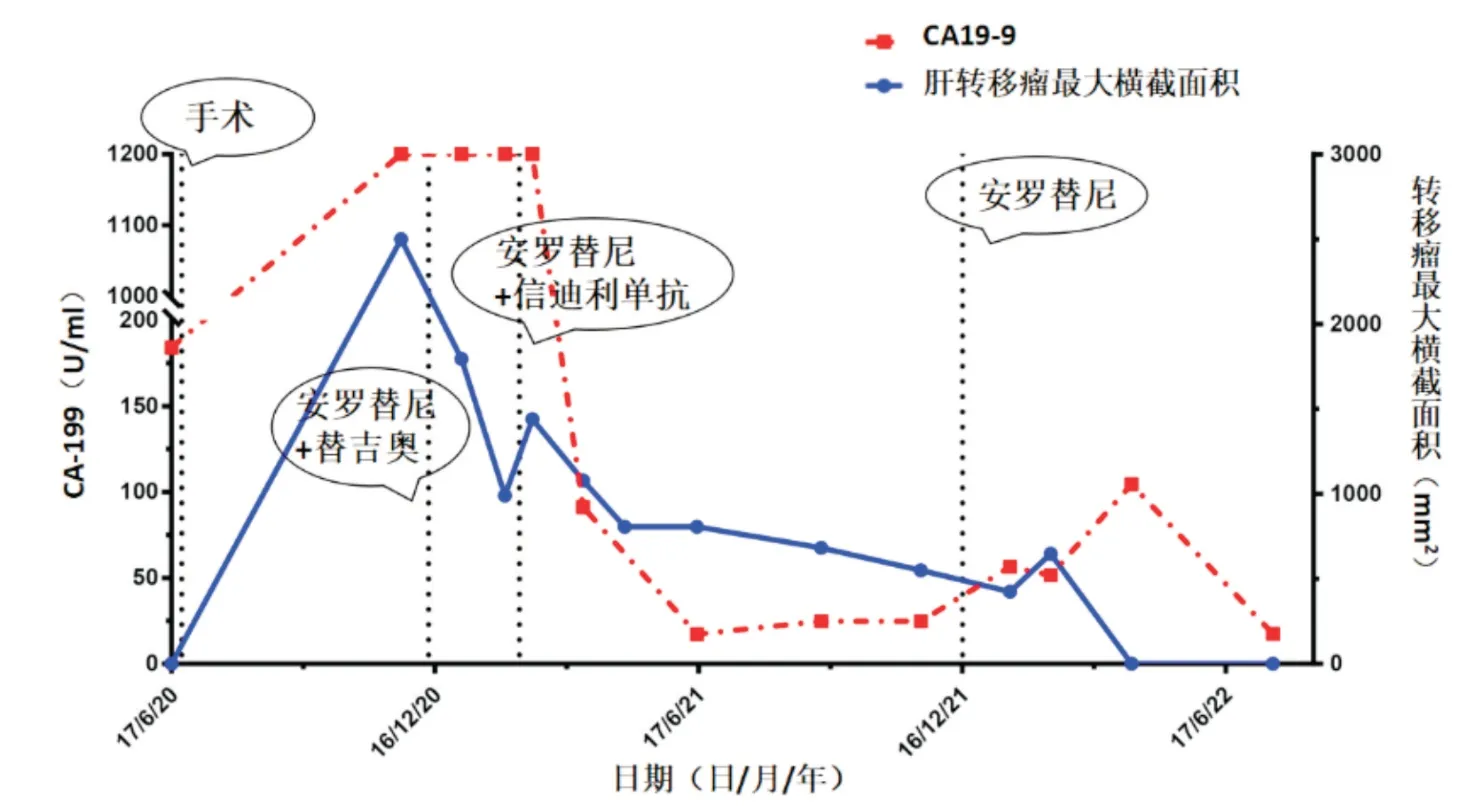
图5 CA19-9以及转移瘤最大横截面积动态变化
免疫治疗是一种近年新发展的抗肿瘤治疗方法,而程序化细胞死亡蛋白(programmed death 1,PD-1)/程序化细胞死亡配体-1(programmed death ligand 1,PDL1)这对免疫共抑制分子作为肿瘤免疫治疗的靶点备受关注。临床上常用抑制剂阻断PD-1/PD-L1这对免疫共抑制分子的信号通路,恢复人体对肿瘤细胞的免疫应答。信迪利单抗(Sintilimab)是一种人源性针对PD-1的单克隆抗体,可识别并结合PD-1,阻断PD-1与受体的结合,恢复T细胞对肿瘤的免疫监视能力和杀伤能力,产生肿瘤免疫应答[10]。信迪利单抗目前主要用于复发或难治性经典型霍奇金淋巴瘤[11]、非小细胞肺癌[12]以及不可切除的肝癌[13]等,其他诸如胃癌、食管癌、黑色素瘤、神经内分泌肿瘤等也有相应的临床研究。国内有零星关于信迪利单抗联合用药治疗肝内胆管癌的病例报道[14-17],但尚无信迪利单抗治疗肝外胆管癌以及信迪利单抗联合安罗替尼治疗肝外胆管癌的相关报道。本病例患者自发现肿瘤复发转移开始口服安罗替尼不能控制肿瘤进展,联合信迪利单抗后肿瘤转移灶明显缩小、坏死甚至完全吸收,CA19-9显著下降,提示安罗替尼联合信迪利单抗在此例进展期胆管癌的治疗当中发挥了重要作用。
总结该病例经验,对于复发性胆管癌患者,安罗替尼联合信迪利单抗是一种有效的治疗手段,可以显著降低肿瘤负荷,延长患者生存时间,提高生活质量;本病例的临床实践或能提供一种肝外胆管癌治疗的新思路,但其治疗机制及有效性有待进一步研究证实。

