解冻损失约束下罗非鱼冻结效率控制参数优化研究
杨信廷 李佳铖 韩佳伟 朱文颖
(1.上海海洋大学信息学院, 上海 201306; 2.北京市农林科学院信息技术研究中心, 北京 100097;3.农产品质量安全追溯技术及应用国家工程研究中心, 北京 100097;4.农业农村部农产品冷链物流技术重点实验室, 北京 100097)
0 引言
速冻技术可显著降低食品冻结过程最大冰晶生成带的时间[1-2],降低残留水对细胞组织内部的危害与损伤,进而有效抑制由冻结引起的食品品质损耗[3-4]。因此,速冻技术已成为行业内主要采用的食品冻结方法,对有效提升食品冻结速率与效率具有重要意义。然而,冷冻食品行业存在多种速冻方式,其对食品速冻速率、均匀性以及解冻后食品品质损耗等方面的影响具有显著差异。速冻过程食品温度分布规律与解冻后品质变化成为当今相关学者研究的主要焦点问题之一,对行业内最佳速冻方式选取与促进高均质冷冻食品的发展等具有重要价值[5-9]。
速冻方式主要包括冷风式速冻和浸渍式速冻,食品温降过程主要受冷介质与食品之间热量交换强度的影响,单纯依靠传感器点位监测很难准确表明速冻过程食品温度时空分布规律与温降速率。加之传感器自身误差与人为读写误差影响,很难精准评估速冻方式对食品冻结效率的影响,难以满足最佳速冻方式选取与效率提升的需求。近年来,计算流体力学(Computational fluid dynamics,CFD)数值模拟技术被广泛应用于食品冷链低温环境稳定性与均匀性优化、食品预冷与速冻效率评估等方面,既可宏观获取低温环境食品温度时空变化规律,又可微观反映冷介质与食品之间对流换热强度与均匀性,为提升低温环境食品工业加工效率、维持食品品质安全与延长货架期等提供了重要理论基础与应用借鉴。但相关研究[10-15]为降低模型构建复杂度、增强传热传质模拟可操作性,将食品形状简化为规则结构体(如圆柱形、球形、矩形),不易精准表明食品表面对流换热强度与食品内部温度时空变化规律,同时也是加大模拟误差的主要影响因素。因此,食品外形高真实物理模型构建对精准探究食品冻结过程的传热传质具有重要意义。
本文以罗非鱼为例,首先,采用3D扫描逆向工程技术实现鱼体高真实三维物理建模,同时基于工业速冻场景展开不同速冻方式实验研究。其次,结合计算流体力学数值模拟对比分析不同速冻方式下罗非鱼温度时空分布规律,探明不同速冻方式对罗非鱼冻结速率、均匀性以及水分流失的影响机制。最后,结合实验测量验证CFD模型准确性并提出相关速冻优化方案,以期为鱼类最佳速冻方式选取与速冻效率提升等提供借鉴。
1 材料与方法
1.1 罗非鱼原材料
罗非鱼取自北京市房山区琉璃河镇某渔场,现场捕捞活鱼,单鱼体质量约为1.5 kg,以3条为单位放置于含水与增氧颗粒的储物箱中,储物箱尺寸(长×宽×高)为0.55 m×0.4 m×0.3 m,装箱后立即运输至实验室。运至实验室后,将鱼放置鱼缸中静养48 h后开始不同速冻方式下罗非鱼冻结实验。
1.2 实验方案
本研究主要针对冷风式与两种浸渍式速冻方式展开相关的实验研究,其中浸渍式速冻方式所采用的流体介质主要包括氯化钠、氯化钙溶液且质量分数均为23.1%。依据国际制冷协会规定,本文以罗非鱼肉中心温度从初始值降至-15℃时所需要的时间作为冻结终止时间[16]。为尽量降低不确定性因素对实验数据的影响,每组速冻实验重复操作3次,不同速冻方式具体实验步骤如下:
冷风式速冻:鲜活罗非鱼击晕后,去鳞、剖肚去内脏和腮,用无菌蒸馏水洗净,吸水纸吸干表面水分。将制作好的罗非鱼按编号于不锈钢架中平摊放置,鱼肉中心处插入温度传感器后放入-20℃和送风口风速9 m/s的恒温恒湿箱中(图1),每3 min温度传感器采集一次数据并传回计算机,待鱼肉中心温度到-15℃后,取出称量。

图1 恒温恒湿箱结构示意图Fig.1 Constant temperature and humidity box1.恒温恒湿箱 2.电源控制器 3.风速传感器 4.制冷机组 5.加湿系统 6.风机 7.加热器 8.控制触控板 9.不锈钢架 10.温度传感器 11.出风口
氯化钠浸渍速冻:鲜活罗非鱼击晕后,去鳞、剖肚去内脏和腮,用无菌蒸馏水洗净,吸水纸吸干表面水分。将罗非鱼按编号放入保温箱中并固定,然后注入温度为-20℃的氯化钠冷冻液直至罗非鱼全部浸没于冷冻液中,鱼肉中心处插入温度传感器后放入恒温恒湿箱内,每3 min温度传感器采集一次数据并传回计算机,待鱼肉中心温度达到-15℃后,取出称量。
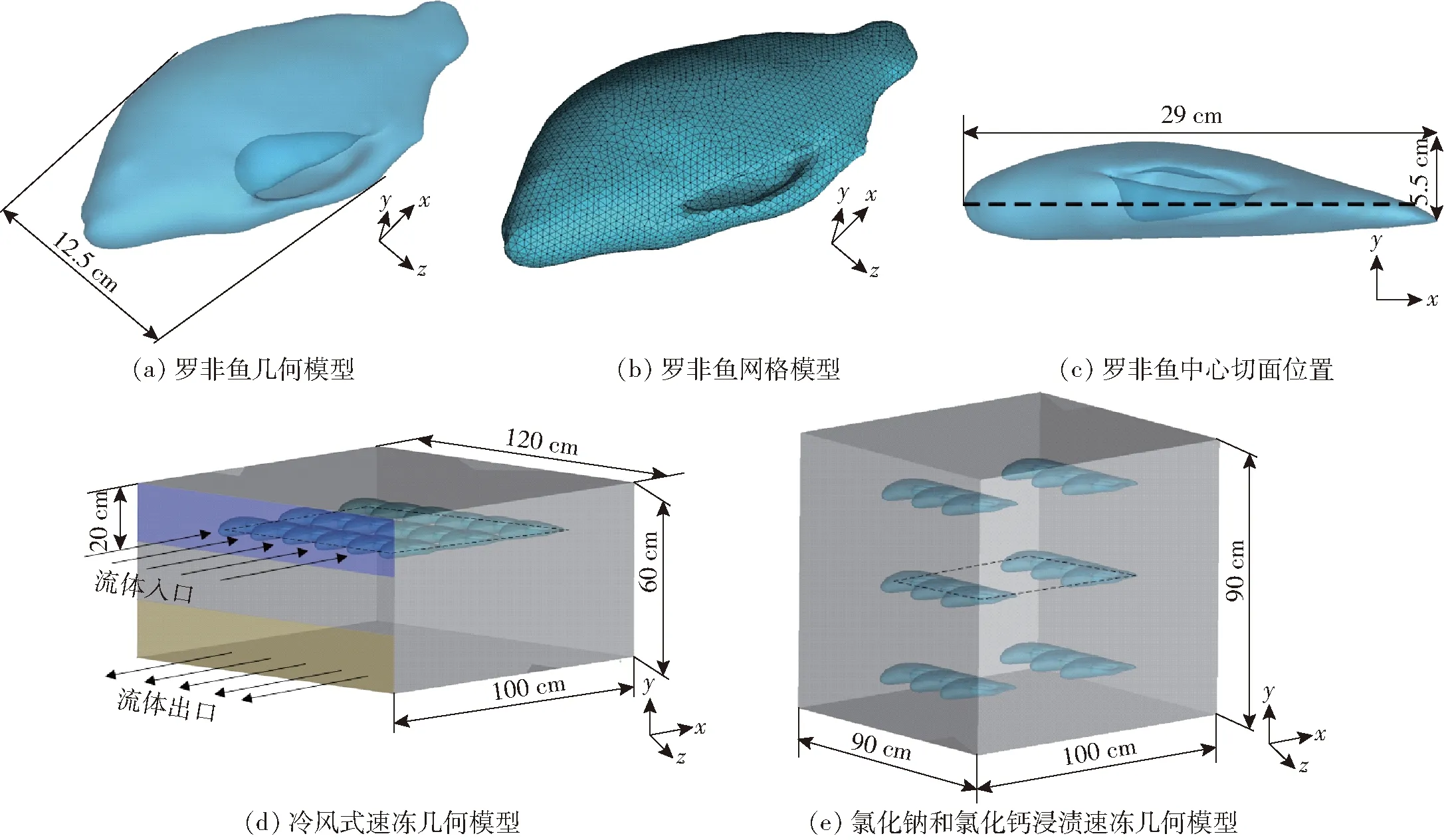
图2 速冻模型Fig.2 Quick-freezing model
氯化钙浸渍速冻:将氯化钠冷冻液换成氯化钙冷冻液,其余步骤同上氯化钠浸渍速冻。
解冻损失率是评价解冻过程中鱼肉失水程度的指标,它直接影响鱼肉的品质和组织状态。解冻损失越小,肉的品质越好。若解冻的汁液不能及时地被细胞吸收,汁液大量流失将严重影响其品质特性。测量鱼肉样品在解冻前质量w0,然后在4℃冰箱中解冻,直到鱼的几何中心温度达到4℃。然后用滤纸沥干鱼并立即称其质量w1。为尽量降低不确定性因素对实验数据的影响,解冻损失实验与速冻实验同样重复操作3次。解冻损失率计算公式为[17]
(1)
1.3 实验设备参数
HANDYSCAN BLACK型扫描仪,加拿大形创有限公司,精度0.002 5 mm,测量分辨率0.025 mm,网格分辨率0.100 mm。MX100型温度传感器,日本Yokogawa公司,量程-35~900℃,分辨率0.1℃,测量精度±0.75℃。TES-134型风速仪,台湾泰仕电子工业股份有限公司,量程0~30 m/s,分辨率0.01 m/s,精度±3%。ZH-RTH-225C型恒温恒湿箱(图1),香港正航仪器有限公司,温度范围-20~150℃,相对湿度范围40%~95%,整机尺寸(长×宽×高)为1.2 m×1 m×2 m,分别为箱体、制冷系统、加湿系统、加热系统以及自动控制系统。
2 CFD模型构建
2.1 物理模型构建
取单条罗非鱼进行3D扫描,对鱼体表面进行光顺处理后导入ANSYS ICEM进行模型构建(图2)。冷风式速冻模型中鱼头对准入口处,分1层18条鱼6行3列平行摆放,箱体尺寸(长×宽×高)为1.2 m×1 m×0.6 m,壁面为无厚度。氯化钠和氯化钙浸渍速冻中每层6条鱼分3行2列,总共3层摆放,箱体尺寸(长×宽×高)为1 m×0.9 m×0.9 m,壁面为无厚度。液流化速冻模型(图3)中每层6条鱼分3行2列,总共3层摆放,分头朝入口水平放置、背朝入口水平放置、竖直放置3种摆放方式,箱体尺寸(长×宽×高)为1 m×0.9 m×0.9 m,壁面为无厚度。
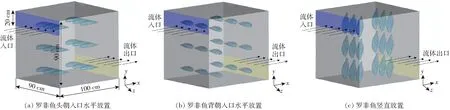
图3 液流化速冻模型Fig.3 Hydrofluidization quick-freezing model
2.2 数学模型
2.2.1模型假设
在建立物理模型时,对其作出以下假设:鱼肉大小均匀、体积相等;忽略传感器对装置内部流场的影响;鱼肉内部只存在导热,不计相变过程中的对流和传质,已冻结区的显热和冻结过程中释放的潜热通过冻结层以导热的形式传递,并向环境释放;冷冻初始时,鱼肉内部水分分布均匀且一致;冷风式速冻内部冷空气为不可压缩流体,且物性不随温度变化。
2.2.2控制方程
(1)流体区域
将瞬态的流体区域视为不可压缩流体,利用平均雷诺数纳维-斯托克斯方程(Reynolds-averaged Navier-Stokes,RANS)进行求解,连续性方程、动量方程、能量方程分别为
(2)
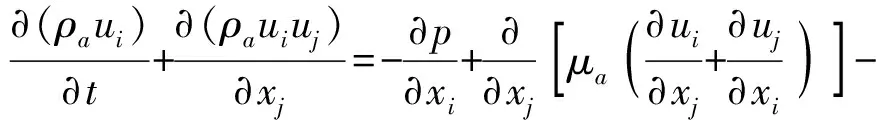
(3)
(4)
式中t——时间,s
p——压强,Pa
xi、xj——笛卡尔坐标
ui、uj——流体时均速度,m/s
ρa——流体密度,kg/m3
μa——流体动力粘度,Pa·s
u′i、u′j——流体脉动速度,m/s
g——重力加速度,m/s2
cp,a——流体比热容,J/(kg·K)
T——流体温度,K
λa——流体热导率,W/(m·K)
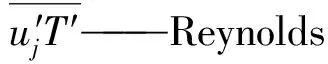
T′——流体脉动温度,K
在实验中,冷风式速冻时冷空气会快速充满整个箱体,因此冷风式速冻、氯化钠和氯化钙浸渍速冻、液流化速冻中,箱体内部流体温度Ta等于初始流体温度T0。
(2)罗非鱼肉区域
罗非鱼肉的速冻过程是一个复杂的、变物性的非稳态导热问题[18]和对流换热问题,罗非鱼内部非稳态导热的三维数学模型为
(5)
式中x、y、z——几何点坐标
c——罗非鱼比热容,J/(kg·K)
λ——罗非鱼热导率,W/(m·K)
ρ——罗非鱼肉密度,kg/m3
2.2.3热物性参数
罗非鱼肉的热物性会随着温度而变化,表观比热容变化尤为明显,以冰点为突变点剧增,而后又随着鱼肉内水分冻结吸收热焓而逐渐降低,因此以温度为变量的非线性多项式模型预测冰点以下的表观比热。
冰点预测模型和表观比热容分别为[19]
Tf=-2.16+2.62Xw-27.47Xa+4.03Xp
(6)

(7)
相变热焓预测模型为[19]
(8)
式中Tf——冰点,℃
Xw——含水率,%
Xa——灰分质量分数,%
Xp——蛋白质质量分数,%
Capp——表观比热容,J/(g·K)
Xl——脂肪质量分数,%
H——热焓,J/g
Hf——冰点处热焓,J/g
把罗非鱼看作为固体,其热导率计算方式为[20]
k=∑viki
(9)
式中ki——组分i热导率,W/(m·K)
vi——每个组分体积分数,%
为了计算每个组分的k,使用取决于温度T(℃) 的方程[20]
kw=0.571 09+1.762 5×10-3T-6.703 6×10-6T2
(10)
kp=0.178 81+1.195 8×10-3T-2.717 8×10-6T2
(11)
kl=0.180 71-2.760 4×10-3T-1.774 9×10-7T2
(12)
ka=0.329 61+1.401 1×10-3T-2.906 9×10-6T2
(13)
式中kw、kp、kl、ka——水、蛋白质、脂肪、灰分热导率,W/(m·K)
考虑到随着温度降低水会变成冰,需要估算冰的热导率作为温度的函数,得出方程[20]
kice=2.219 6-6.248 6×10-3T+1.015 4×10-4T2
(14)
冷冻过程中冰质量分数的计算可以通过文献[21]提出的方程给出,是关于温度、冰点和总含水率的函数。文献[22]通过实验证明了该方程在冰点为-2~-0.4℃以及冷冻温度在-45℃至冰点温度范围内能提供较好的精度,计算方程为
(15)
式中xice——冰质量分数,%
xwo——总含水率,%
罗非鱼肉单个组分密度在速冻过程中随温度变化,通过单个组分密度计算罗非鱼肉的密度,罗非鱼单个组分密度和罗非鱼鱼肉密度计算方程为[20]
ρw=9.971 8×102+3.143 9×10-3T- 3.757 4×10-3T2
(16)
ρp=1.330 0×103-0.518 4T
(17)
ρl=9.255 9×102-0.417 57T
(18)
ρash=2.432 8×103-0.280 63T
(19)
ρice=9.168 9×102-0.130 7T
(20)
ρ=ρwxw+ρpxp+ρlxl+ρaxa+ρicexice
(21)
式中-40℃≤T≤150℃,ρw、ρp、ρl、ρash、ρice、ρ分别为水的组分密度、蛋白质的组分密度、脂肪的组分密度、灰分的组分密度、冰的组分密度、罗非鱼肉的密度。
2.3 初始条件
本文认为罗非鱼内部为均匀介质,温度均匀,初始时装置内部流体域的温度也视为定值,初始条件:t=0时,罗非鱼初始温度T为20℃。
边界条件如下:
(1)冷风式速冻采用速度(velocity-inlet)入口,送风风速为9 m/s,温度为-20℃,湍流强度和湍流粘性比分别为3.4%和2.2,出口采用自由出流(outflow)边界条件,此处冷空气是充分发展流动的,在outflow边界上的所有变量(除压力)梯度为零,如速度分量u、v、w和温度T等。鱼肉壁面和装置壁面温度分别设置为无厚度的耦合壁面(WALL)和无厚度的-20℃恒温壁面。
(2)因为氯化钠和氯化钙浸渍速冻方式下不存在入口和出口,因此,仅需设置壁面(WALL)为无厚度的-20℃恒温壁面。
(3)液流化速冻采用速度(velocity-inlet)入口,入口流速分别为1、1.5、2、2.5、3 m/s,温度为 -20℃, 湍流强度和湍流粘性比分别为5%和10。
2.4 网格划分与数值模拟方法
采用ANSYS ICEM 进行模型的网格划分,设置网格类型为Tetra/Mixed,冷风式速冻模型和液流化速冻模型中入口和出口由于速度较快网格需要适当加密。冷风式速冻模型进行网格化和网格质量优化后共有2 966 196个单元,483 182个节点,网格质量均大于0.38;氯化钠和氯化钾浸渍速冻模型进行网格化和网格质量优化后共有2 004 304个单元,366 804 个节点,网格质量均大于0.4;液流化速冻模型进行网格化和网格质量优化后3种摆放位置分别有3 228 501、3 209 837、3 166 245个单元和527 908、524 941、517 646个节点,网格质量均大于0.41。上述模型网格质量评价要求依据文献[23]确定,在其所有壁面上,采用边界层网格,其厚度要求均由y+小于5确定,最大歪斜度和壁面y+均分别小于0.95和4。通过理查森外推法[24-25]估算由此产生的空间离散误差,冷风式速冻模型中通过容器的质量流量误差大约为2.8%,鱼肉表面的平均传热率误差约为4.9%,壁面剪切应力误差约为0.25%;氯化钠和氯化钙浸渍速冻模型中通过容器的质量流量误差大约为2.5%,鱼肉表面的平均传热率误差约为5.1%,壁面剪切应力误差约为0.22%;液流化速冻模型中通过容器的质量流量误差大约为2.7%,鱼肉表面的平均传热率误差约为4.6%,壁面剪切应力误差约为0.28%。进一步网格加密后,冷风式速冻为3 288 491个单元,氯化钠和氯化钙浸渍速冻2 299 322单元,液流化速冻分别为3 429 383、3 429 922、3 452 332个单元,网格质量变化均小于0.01,质量流量误差变化均小于0.3%,平均传热率变化和壁面剪切应力误差均小于0.1%。
将模型的网格导入Fluent,在操作条件中激活重力项,计算时采用SSTk-ω湍流模型[26-27],基于压力求解器,压力速度耦合方法采用SIMPLE算法,动量、湍动能、扩散率、能量的离散格式为二阶迎风格式,利用UDF接口把罗非鱼肉的比热容和热导率导入控制方程中。在模拟氯化钠和氯化钙浸渍速冻时,因其自然对流的温度和速度比较小,为防止当作残差收敛需要开启双倍精度。
2.5 模型验证方法
由于本文模拟了多条鱼在不同速冻条件下的鱼肉的温度分布情况,为了反映整体模拟的准确性,故取鱼肉中心平均温度为参考值。通过均方根误差(RMSE)和平均绝对百分比误差(MAPE)比较实测和模拟的温度来确定模型的有效性。
3 结果分析
3.1 模型验证
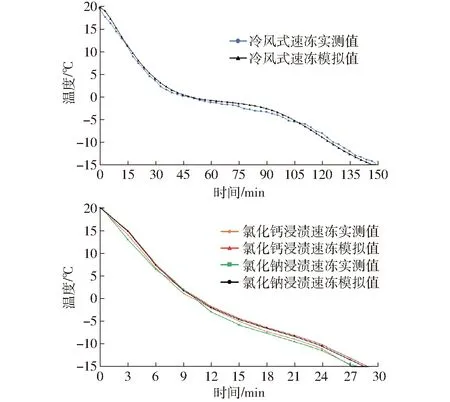
图4 温度模拟值与实测值比较Fig.4 Comparison between simulated and experimental temperature values
图4为不同速冻方式下鱼肉中心温度模拟值与实测值的对比。从图4可以看出,冷风式速冻、氯化钠和氯化钙浸渍速冻其最大温度偏差分别为1.39、1.81、1.64℃,最终模拟与实验所需的冻结时间最大偏差分别为3.95%、6.89%、4.76%,其最大均方根误差、最大平均绝对百分比误差分别为1.017℃、18.9%(表1)。因此,CFD模拟值与实测值基本一致,验证了模拟结果的准确性与可靠性。本研究模拟值和实测值之间存在偏差可能主要归因于速冻装置3D结构的简化。此外,虽然其在现有的热物性参数预测模型的基础上,建立的数值模拟方法预测的冻结时间与实验的冻结时间吻合度高,但冻结过程中的温度偏差,主要是因为模拟忽略了鱼肉内部组织中的液体是一种多组分溶液,其相变时液固区的成分会不断变化,且存在测量仪器自身误差和温度的波动以及模拟过程值的脉动等偏差原因。
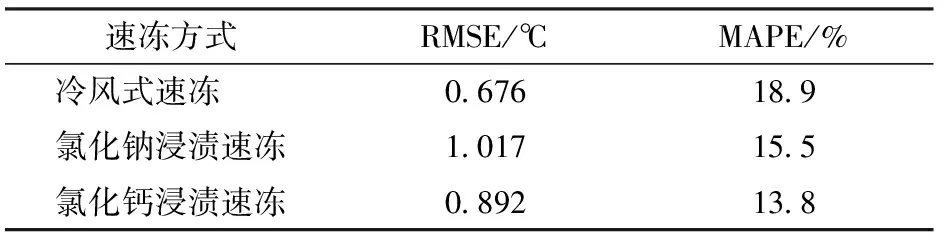
表1 均方根误差与平均绝对百分比误差Tab.1 Root mean square error and mean absolute percentage error
3.2 速冻过程鱼肉温度变化规律与均匀性
3.2.1冻结过程鱼肉温度变化规律
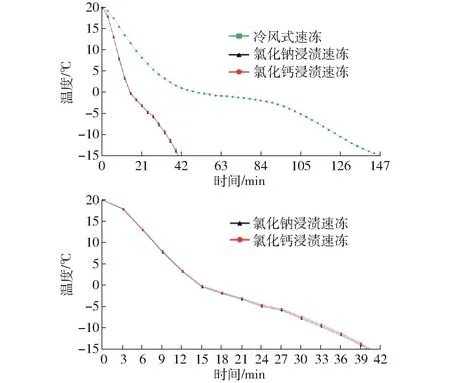
图5 不同速冻方式下鱼肉中心温度比较Fig.5 Comparison of temperature in center of fish by different quick-freezing methods
图5为罗非鱼在冷风式速冻、氯化钠和氯化钙浸渍速冻过程中鱼肉的中心温度变化曲线。在速冻初期,鱼肉中心平均温度从20℃下降到约0℃过程中,3种速冻方式的温度曲线均快速下降;当中心平均温度降至0℃以后,温度曲线下降明显变缓;当中心平均温度降至约-5℃后,温度曲线的下降又逐渐变陡。因为鱼肉冻结过程可以分为3个阶段。第1阶段鱼肉中心温度从初温急剧下降至鱼肉冰点温度附近,此阶段鱼肉会放出显热使温度略有回升,但显热相比整个阶段全部放出的热量较小,所以降温速度快,曲线较为陡峭。第2阶段为鱼肉组织内部冰晶生成阶段,该阶段鱼肉组织中大部分水分开始冻结成冰,从而导致鱼肉的比热发生剧烈变化,剧烈变化放出了大量的相变潜热,从而导致温度曲线下降变缓。第3阶段,鱼肉中残留的水分继续结冰,鱼肉的比热变化不再剧烈,已经结冰的继续降温至终温。由于冰的比热比水小,进一步降温放出的显热比较小,所以降温曲线没有初期降温曲线陡峭。冷风式速冻冻结时间相比氯化钠和氯化钙浸渍速冻的冻结时间慢约73%,而氯化钠和氯化钙浸渍速冻冻结时间基本相同,但仍有些细微差别,这与两种冷冻液的热导率不同有关。
3.2.2冻结均匀性
为了准确显示内部温度场的分布,本文选取罗非鱼肉整体平均温度Tavg为15、5、-5、-15℃时具有代表性的中心切面(图2)作为温度场分析对象。图6为罗非鱼在冷风式速冻、氯化钠和氯化钙浸渍速冻过程中鱼肉中心部位的温度分布。随着温度的降低,冷风式速冻不同位置鱼肉温度分布差异越来越明显,而两种浸渍速冻则没有明显的差异。为进一步对比分析不同时刻箱内鱼肉个体间温度差异性,选用文献[26,28]给出的变异系数量化表示速冻过程鱼肉的温度分布均匀性(图7)。
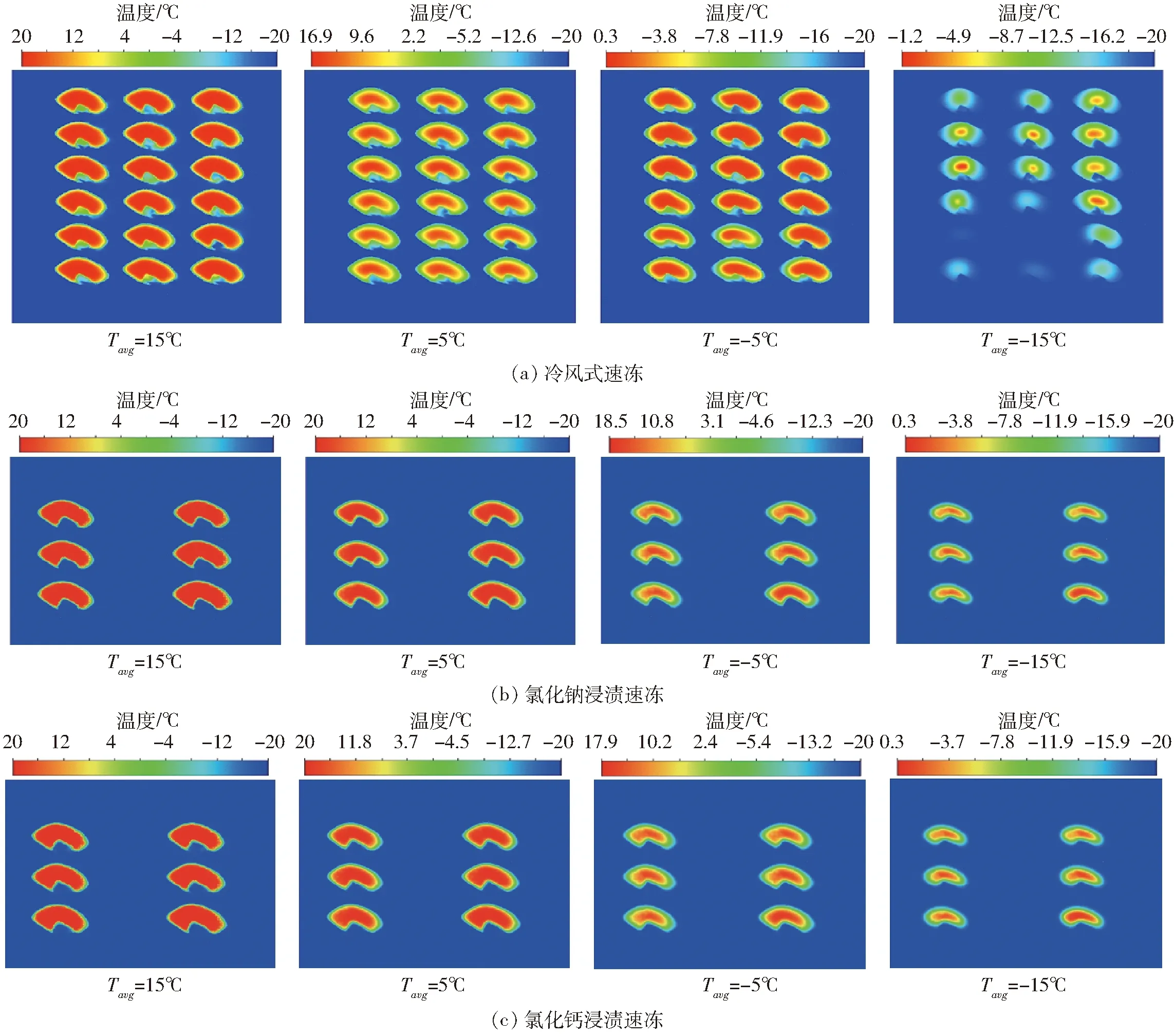
图6 不同速冻方式下鱼肉中心切面温度分布云图Fig.6 Temperature distribution clouds of central section of fish by different quick-freezing methods

图7 不同速冻方式下温度变异系数变化曲线Fig.7 Variation curves of temperature coefficient by different quick-freezing methods
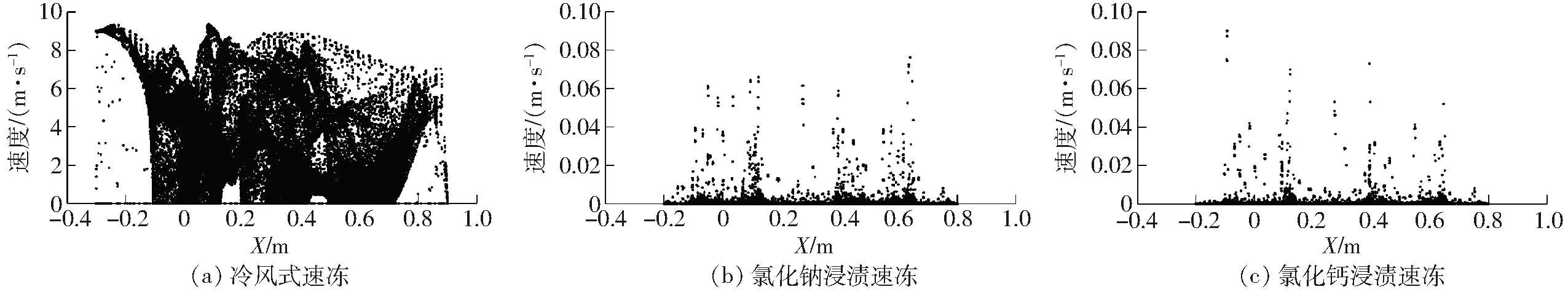
图8 不同速冻方式下鱼肉中心切面速度散点图Fig.8 Scatter diagrams of central section velocity of fish meat by different quick-freezing methods
从图7可以看出,3种速冻方式中变异系数开始迅速变大,然后冷风式速冻在10 min左右会有一段下降趋势但又开始变大,然后在110 min左右开始稳定,而氯化钠和氯化钙浸渍速冻则在4 min左右开始逐渐下降并最终趋于稳定且冻结均匀性提升10~40倍。因为冰点附近鱼肉需要吸收大量的热量导致温度变化变小,所以会有一段下降趋势,之后冷风式速冻空气对流速度不均匀(图8)导致不同位置鱼肉对流换热系数的不同,从而影响鱼肉与空气的换热效率,导致温差随着时间的推移愈发变大。氯化钠和氯化钙浸渍速冻由于冷冻液只存在细微的自然对流对冻结过程基本无影响,鱼肉温度分布均匀,由外向内呈现明显的阶梯状分布。鱼肉速冻过程温度分布不均匀会导致鱼肉品质的差异,影响鱼肉品质的保持。
3.3 解冻损失对罗非鱼品质的影响
罗非鱼解冻损失率最高的是冷风式速冻方式,为4.34%,其次是氯化钙浸渍速冻,为3.92%,氯化钠浸渍速冻为3.89%。两种浸渍速冻方式下罗非鱼解冻后水分流失率分别比冷风式速冻方式降低10.37%和9.68%左右。较低的水分流失率可能主要归因于浸渍速冻下非常高的冷冻速率与均匀性,加速了鱼肉体内均匀细小冰晶的形成,有效抑制了大冰晶生成而诱发鱼肌肉组织机械损伤问题。而冷风式速冻产生的大冰晶对鱼的肌肉组织造成很大的损伤,极易导致肌肉组织结构被严重破坏,部分融化的水解冻后无法返回细胞内,进而导致鱼肉解冻后高的水分流失率。
3.4 氯化钠浸渍速冻方式优化
3.4.1不同流速下速冻效率比较

图9 不同入口流速下鱼肉中心温度比较与均匀性 动态变化曲线Fig.9 Comparison of temperature in center of fish meat and dynamic variation of uniformity at different inflow velocities
基于以上分析,本研究提出一种氯化钠液流化速冻方案,并综合比较分析不同入口流速、鱼体朝向对鱼肉速冻效率的影响,以优化氯化钠液流化速冻方案设计。图9为鱼体头朝入口水平放置时不同入口流速下鱼肉中心温度比较与均匀性动态变化规律。从图9a可以看出,鱼肉温降速率随着入口流速的增大而不断增大,特别是当入流流速从1 m/s增长至2.5 m/s期间,但当入口流速超过2.5 m/s以后,冻结速率并无显著提高。这可能归因于表面换热系数随着入口流速增大而不断增大,但当入口流速超过2.5 m/s以后表面换热系数对鱼肉降温速率影响变小,鱼肉内部热导率成为主要影响因素。从图9b可以看出温度变异系数在整个速冻过程中呈现先增大后减小的趋势。在速冻开始的一定时间段内,不同流速下温度变异系数变化基本相同。随着入口流速增大,温度变异系数呈不断降低趋势,在整个速冻过程,入口流速越大,其变异系数越小,冷却均匀性越高,但当入口流速超过2.5 m/s时,温度变异系数降低幅度并不显著。综上,通过综合考虑不同入口流速对冻结速率、温度均匀性的影响,本研究选定2.5 m/s作为氯化钠液流化速冻方式最佳入口流速。
3.4.2不同鱼体朝向下速冻效率比较
图10为入口流速为2.5 m/s时不同摆放方式下鱼肉中心温度比较与均匀性动态变化规律。从图10a可以看出,鱼体背朝入口水平放置冻结速率最快,其次为头朝入口水平放置,最后为竖直放置。这可能是因为摆放方式的不同导致内部流场流速不同,从而影响鱼体表面换热系数。整个速冻过程中,冻结速率越大,其变异系数越小,冷却均匀性越高,结合3个不同摆放方式下温度变异系数变化曲线(图10b),鱼体背朝入口水平放置的温度变异系数最小,且相比其它摆放位置的均匀性具有显著提高,其次是鱼体头朝入口水平放置,最后为鱼体竖直放置。因此,结合入口流速和摆放方式综合考虑,本研究选定2.5 m/s作为氯化钠液流化速冻方式最佳入口流速,鱼体背朝入口水平放置为最佳摆放方式。
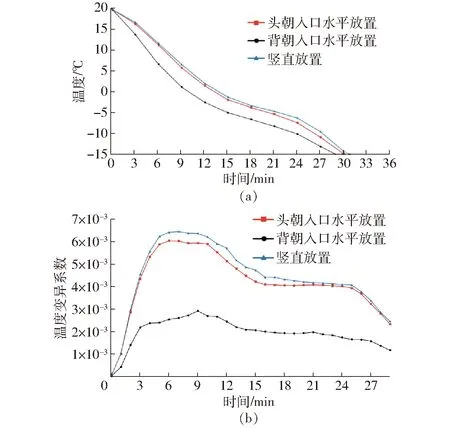
图10 不同摆放方式下鱼肉中心温度比较与均匀性 动态变化曲线Fig.10 Comparison of temperature in center of fish meat and dynamic variation of uniformity under different placement modes
4 结论
(1)结合3D扫描逆向建模与CFD数值模拟技术构建了罗非鱼不同速冻方式下热传递数值模型,揭示了罗非鱼与冷介质之间的热量耦合传递机制,直观获取了不同速冻方式下罗非鱼冻结速率、温度时空分布均匀性动态变化规律,并结合解冻损失实验得出了不同速冻方式对罗非鱼解冻后水分流失率的差异性影响,最后综合冷风式速冻、氯化钠和氯化钙浸渍速冻的对比结果提出了氯化钠液流化速冻并进行优化。
(2)通过对比模拟值与实测值得出,CFD模型最大均方根误差与平均绝对百分比误差分别为1.017℃与18.9%,充分体现了所建传热模型的准确性与实验方案设计的合理性。其次,不同速冻方式下鱼肉的冻结速率和均匀性具有显著差异,通过对比鱼肉中心点温度以及瞬时温度均匀性得出氯化钠和氯化钙浸渍速冻的冻结速率相比冷风式速冻快约73%且冻结均匀性更高。对比解冻后的水分流失率得出氯化钠和氯化钙浸渍速冻相比冷风式速冻具有更好的保水性,且水分流失率分别降低10.37%和9.68%。最后,综合不同入口流速和罗非鱼摆放方式对冻结速率、均匀性及能耗的影响,确定流速为2.5 m/s、摆放方式为背朝入口水平放置的氯化钠液流化速冻为最佳。

