MRI联合彩色超声在乳腺癌中的诊断效能研究
刘凤霞 魏艳飞 任艳丽 郭海霞
乳腺癌是一种临床常见恶性肿瘤,具有较高的发病率、病死率,且发病人群有低龄化趋势,在女性恶性肿瘤中居于第二位[1]。及早对乳腺癌患者病情作出诊断、及早予以针对性治疗,是降低患者病死率、改善预后的关键[2]。彩超是临床诊断乳腺癌的常用影像学技术,但特异性、敏感性均较低,单一诊断具有一定的局限性[3]。MRI软组织分辨率、空间分辨率均较高,且无创伤性,现已被临床广泛应用于乳腺癌诊断[4]。基于此,为进一步探究MRI联合彩色超声在乳腺癌中的诊断效能,本文选择收治的100例疑似乳腺癌患者进行比较,结果报告如下。
1 资料与方法
1.1 一般资料 选择我院2018年11月至2020年11月收治的100例疑似乳腺癌患者,均为女性,年龄32~68岁,平均年龄(50.62±5.84)岁;病程3~10个月,平均(6.52±1.64)个月;体重51~89 kg,平均(70.52±8.44)kg。已得到医院伦理委员会审批。
1.2 纳入与排除标准
1.2.1 纳入标准:①年龄≥18周岁;②均存在不同程度乳头溢液、乳腺肿块、瘙痒、疼痛等症状;③意识清醒、对答切题;④病历资料齐全、完整;⑤均知情,已签署同意书。
1.2.2 排除标准:①体内置入起搏器者;②存在幽闭症、帕金森、人格分裂症、痴呆者;③影像学检查前存在放化疗、手术治疗史者;④妊娠、哺乳期女性;⑤中途从此项研究退出者;⑥合并严重营养不良者。
1.3 方法
1.3.1 彩色超声:采用彩色多普勒超声诊断仪(型号:LOGIQ5PRO;生产企业:美国GE公司)检查,采用高频线阵探头,频率为6~12 MHz,协助患者采取仰卧位,充分暴露乳房,进行二维超声检查,探头探查患者双侧乳房各个象限,对病灶部位进行斜向、纵向、横向检查,检查乳房两侧腋窝,了解乳房淋巴结状况、周边状况、内部回声、钙化、位置、边缘、大小、形态等,了解病灶部位彩色血流信号、灰阶声像图,确认出血最丰富的切面,评价血流分级。
1.3.2 MRI:采用磁共振扫描仪(型号:Sig-na HDxt1.5;生产企业:美国GE公司)检查,以乳腺线圈检查,协助患者采取仰卧位,自然悬垂双侧乳腺在专用乳腺线圈环槽中,上举双臂直至头顶,从双侧乳腺扫描直至水平胸前部、腋窝等。常规MRI扫描:采用快速自旋回波序列(TSE)扫描,T1加权扫描参数:TR/TE是495/10 ms,扫描3 min 18 s,视野(FOV)是340 mm。T2加权扫描参数:TR/TE是4 740/120 ms,扫描3 min 48 s,FOV是340 mm。T2-压脂序列:TR/TE是4 983/60 ms,扫描2 min 39 s,FOV是340 mm。扩散加权成像(DWI)检查:以单次继发自旋回波-平面回波成像序列(SE-EPI)进行轴位、矢状位扫描,FOV是340 mm,TR/TE是5 000/115 ms,弥散敏感系数(b值)是0、800、1 000 s/mm2。MRI (动态增强成像DCE-MRI):以快速小角度激发序列(FLASH)检查,经静脉采用高压注射器注入钆喷酸葡胺注射液0.2 mmol/L,0.3 ml/s注射速率,注射前扫描1个时相,注射后扫描时相7个,TR/TE是4.4/2.2 ms,120°翻转角度,扫描6 min 29 s,FOV是340 mm。所有的图像均传输至工作站,进行矢状位、轴位图像重建,确定感兴趣区域(ROI),避开出血、坏死部位,b值取0、800、1 000 s/mm2,测量对应正常腺体ADC值。
1.4 观察指标及评价标准 将手术病理组织学检查作为金标准,比较彩色超声、MRI、MRI联合彩色超声诊断灵敏度、特异度,灵敏度=真阳性/(真阳性+假阴性)×100.00%;特异度=真阴性/(假阳性+真阴性)×100.00%。比较彩色超声、MRI、MRI联合彩色超声不同肿块直径乳腺癌检出率,分析超声与MRI影像学特征。
2 结果
2.1 彩色超声、MRI、MRI联合彩色超声诊断效能比较 手术病理组织学检查确诊乳腺癌96例、乳腺良性肿块4例。彩色超声确诊乳腺癌83例、乳腺良性肿块17例。MRI确诊乳腺癌87例、乳腺良性肿块13例。MRI联合彩色超声确诊乳腺癌92例、乳腺良性肿块8例。MRI联合彩色超声诊断灵敏度(94.79%)、特异度(75.00%)均高于彩色超声(83.33%、25.00%)、MRI(88.54%、50.00%),差异有统计学意义(P<0.05),彩色超声与手术病理组织学的Kappa一致性较差,MRI与手术病理组织学的Kappa一致性一般,MRI联合彩色超声与手术组织病理学的Kappa一致性较好。见表1~3。

表1 彩色超声诊断结果 例

表2 MRI诊断结果 例

表3 MRI联合彩色超声诊断结果 例
2.2 彩色超声、MRI、MRI联合彩色超声不同肿块直径乳腺癌检出率比较 96例乳腺癌患者,共102个病灶,MRI联合彩色超声对≤1 cm肿块(89.36%)高于彩色超声(70.21%)、MRI(85.11%),差异有统计学意义(P<0.05);MRI联合彩色超声对1~2 cm肿块的检出率(94.55%)与彩色超声(87.27%)、MRI(85.45%)比较,差异无统计学意义(P>0.05)。见表4。

表4 彩色超声、MRI、MRI联合彩色超声≤1 cm肿块、1~2 cm肿块检出率 例(%)
2.3 超声与MRI影像学特征比较 (1)彩色超声特征:肿块无清晰边界,无包膜,呈毛刺征,或有恶性晕征。检查时若见2.1 cm×1.3 cm的低回声区,有毛刺,边界不清,可见散在的强光点回声,考虑乳腺癌。(2)MRI特征:①MRI常规扫描:可见大小为15.2 mm×14.5 mm的团片状高密度影,边缘模糊,可见细小钙化影。②DWI检查:信号均比正常腺体组织低,ADC图像为低信号,b值为0时,是低信号。b值=800 s/mm2时,信号会明显减弱。③DCE-MRI检查:肿瘤直径0.82~0.91 cm,大部分呈树枝状、球状分布,有极少部分呈类圆形、圆形分布,大部分为不均匀强化。见图1~3。
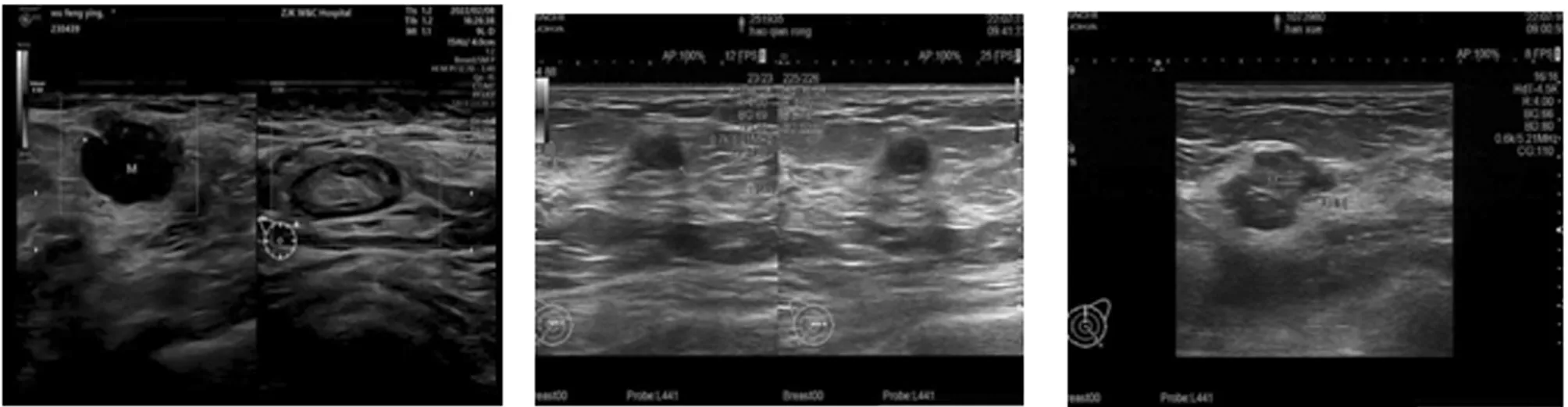
图1 彩色超声特征 图2 MRI特征 图3 DCE-MRI检查
3 讨论
据流行病学调查显示,近年来,我国乳腺癌的发病人群有低龄化、年轻化趋势[5]。目前,临床普遍认为乳腺癌的发生与自身内分泌异常、外界环境、家族遗传等有密切的联系[6]。大部分乳腺癌患者早期临床症状不明显,疾病确诊时基本发展到了中晚期,错过了手术治疗的最佳时机,预后普遍较差[7]。及早对乳腺癌患者病情作出准确的诊断,是延长患者生存期间、降低死亡率的关键。
手术病理组织学检查是当前临床确诊乳腺癌的金标准,但由于具有创伤性、诊断费用昂贵、操作过程复杂,并未在临床中推广[8],彩超以及MRI均为当前诊断乳腺癌的常用影像学技术。本研究显示,MRI联合彩色超声诊断灵敏度(94.79%)、特异度(75.00%)均高于彩色超声(83.33%、25.00%)、MRI(88.54%、50.00%),差异有统计学意义(P<0.05),彩色超声与手术病理组织学的一致性较差,MRI与手术病理组织学的Kappa一致性一般,MRI联合彩色超声与手术组织病理学的Kappa一致性较好。表明MRI联合彩色超声在乳腺癌诊断中灵敏度、特异度均较高。分析原因:彩色超声通过超声波技术通过组织产生的不同反射强度、波幅、回波等,反映结构、组织的数据、形态,具有检查费用低廉、操作方便、无创伤性等优点,可帮助医生了解病灶及周边组织血流信号。但彩色超声对于多病灶乳腺癌诊断效能较差,极易出现漏诊[9,10]。MRI具有较高的软组织分辨率,可以清楚显示出病灶的内部结构、边界、大小等,将正常腺体、皮下组织、乳腺皮肤与病灶区分开,MRI检查下良性病灶以类圆形、圆形为主,病灶形态较为规则,肿块内部信号均匀,存在清晰边界;恶性病灶边界不清晰,形态不规则,内部回声不均匀[11,12]。但MRI检查下良恶性病灶在T1扫描、T2扫描上基本相同,在良恶性病灶鉴别方面具有一定的局限性。彩色超声与MRI联合,协同作用,优势互补,可有效提高诊断灵敏度、特异度,准确鉴别良恶性病灶。
本研究显示,MRI联合彩色超声对≤1 cm肿块(89.36%)高于彩色超声(70.21%)、MRI(85.11%),差异有统计学意义(P<0.05);MRI联合彩色超声对1~2 cm肿块检出率(94.55%)与彩色超声(87.27%)、MRI(85.45%)比较,差异无统计学意义(P>0.05)。表明MRI联合彩色超声可提高对直径<1 cm肿块的检出率。分析原因:彩色超声对组织的穿透能力较差,对微小病灶、深层病灶的检出率较低,具有一定的局限性。MRI可以多方位、多序列、多参数成像,成像更为全面,不受年龄限制,无放射性,软组织分辨率较高,可以将病灶的更多生物学特征显示出,但对于微钙化病灶的检出率MRI不如彩色超声,如果病灶部位出现钙化灶,彩色超声要比MRI更容易检出[13]。将彩色超声与MRI联合,优势互补,可提高微小病灶检出率,避免患者错过最佳治疗时机。
综上所述,乳腺癌患者采用MRI联合彩色超声检查,可提高灵敏度、特异度及对直径≤1 cm肿块的检出率,为治疗方案的制定提供科学的参考依据,对于改善患者预后具有重要意义。

